Задержка роста плода (ЗРП) – это осложнение беременности, характеризующееся неспособностью плода достичь своего генетически запрограммированного потенциала роста [1, 2, 3]. Данное определение отражает механизмы развития данного патологического состояния, подчеркивая разницу между «истинной» ЗРП (intrauterine growth restriction) и понятием «плода, малого к сроку гестации» (small for gestational age), характеризующегося конституционально обусловленной маловесностью без нарушения внутриутробного состояния плода. Критерии постановки диагноза ЗРП по-прежнему дискутабельны; прежде всего, они опираются на снижение предполагаемой массы плода либо окружности живота плода менее 10 перцентиля. Наиболее распространены в современном научном сообществе диагностические критерии, включающие в себя не только отклонения в ультразвуковой фетометрии, но и ряд факторов, ассоциированных с неблагоприятными перинатальными исходами, в первую очередь характеризующих нарушение фетоплацентарного кровотока [3, 4].
Поражая до 10% всех беременностей, ЗРП вносит значительный вклад в структуру перинатальной смертности и заболеваемости [1]. При беременности с ЗРП значительно повышается риск как антенатальной гибели плода [5, 6] (причем в большинстве случаев антенатальная гибель происходит в сроки, в которые ребенок был достаточно зрел для внеутробного выживания и дальнейшего нормального развития), так и ранней неонатальной гибели плода [5, 7].
Хроническое нарушение питания плода, особенно при недоношенности, приводит к функциональной незрелости ряда органов и систем (преимущественно центральной нервной системы и органов дыхания), снижению иммунологической реактивности и метаболическим расстройствам. В структуре заболеваемости младенческого возраста превалируют респираторный дистресс-синдром, внутрижелудочковые кровоизлияния, бронхолегочная дисплазия, септические осложнения [8, 9, 10]. Репродуктивные потери и затраты на выхаживание и реабилитацию детей, перенесших ЗРП, причиняют значительный социальный и экономический ущерб [11, 12].
Адаптационные механизмы, срабатывающие у плода с ЗРП, могут иметь негативные последствия, если продолжаются достаточно долго. Так, в условиях хронической гипоксемии, обусловленной плацентарной недостаточностью, и дефицита нутриентов, сердечный выброс плода перераспределяется таким образом, чтоб осуществлять поддержку головного мозга (brain-sparing эффект). Происходят перестройка сосудов головного мозга и снижение реактивности их стенок, что приводит к нарушениям ауторегуляции кровоснабжения головного мозга, нарушая важное звено защиты головного мозга от гипо- или гиперперфузии [13, 14]. Все это повышает частоту поражений центральной нервной системы у детей, перенесших ЗРП: повышенной нервно-рефлекторной возбудимости, гипертензионно-гидроцефального синдрома, синдрома угнетения, снижения когнитивных функций у таких детей, стойких тяжелых поражений центральной нервной системы в виде детского церебрального паралича, прогрессирующей гидроцефалии, олигофрении [15].
Адаптация плода к длительному дефициту питательных веществ и кислорода при его антенатальном развитии в условиях плацентарной недостаточности и внутриутробной гипоксии позволяет ему выживать, приводя, однако, к изменениям на молекулярном и физиологическом уровне, имеющем отдаленные последствия. Так, все больше данных говорит о том, что длительное воздействие неблагоприятных внутриутробных условий существования изменяет профиль риска хронических неинфекционных заболеваний во взрослом возрасте (гипотеза «плодового программирования» Баркера) [16–19].
Одним из методов оценки внутриутробного состояния плода является допплерометрия фетоплацентарного кровотока; главным образом используется измерение пульсационного индекса в артерии пуповины и венозном протоке (ductus venosus) [3, 20–23]. Патологические кривые скоростей кровотока в артерии пуповины характеризуются снижением конечной диастолической скорости кровотока, что свидетельствует о значительном повышении периферического сосудистого сопротивления плодовой части плаценты и выражается в увеличении индексов сосудистой резистентности выше нормативных значений. Нулевой и реверсный кровоток в артерии пуповины и нарушения в венозном протоке являются признаками критического нарушения фетоплацентарного кровотока, за которыми может последовать антенатальная гибель плода. Сочетание нарушений в артерии пуповины с нулевым или реверсным кровотоком в венозном протоке увеличивает этот риск, что позволяет при их выявлении своевременно ставить вопрос о досрочном родоразрешении. Вопрос выбора оптимального времени родоразрешения в зависимости от состояния плодово-плацентарной гемодинамики является дискутабельным, критерии родоразрешения в зависимости от срока различаются в различных странах, гайдлайнах, научных школах и лечебных учреждениях [7, 24–27].
Целью настоящего исследования были проведение анализа показателей фетоплацентарной гемодинамики у женщин с ЗРП и оценка влияния плодово-плацентарного кровотока на исход для новорожденного.
Материалы и методы
В рамках настоящего исследования был проведен ретроспективный анализ историй родов. Исследования проводились на базе ГБУ РО «Перинатальный центр» в 2016–2019 гг. Все беременные получали лечение согласно приказу Минздрава России от 01.11.2012 №572 «Об утверждении порядка оказания медицинской помощи по профилю «Акушерство и гинекология»».
В исследование включены 138 женщин с диагностированной ЗРП, беременность которых окончилась преждевременными родами ребенком массой менее 2000 г. Сформировано две группы: 1-ю группу составили женщины, дети которых умерли анте-, интранатально либо в течение 28 дней после рождения (n=22), 2-ю группу – женщины с пережившими неонатальный период новорожденными (n=116).
Диагноз ЗРП выставлялся на основании данных ультразвукового и допплерометрического исследования с использованием перцентильных кривых (кривые роста Фентона для недоношенных мальчиков и девочек) [28]. Всем беременным до родоразрешения (накануне либо в день родов) произведено ультразвуковое исследование, включавшее традиционную фетометрию и оценку анатомии плода, тщательное изучение локализации плаценты, допплерометрию маточных артерий, артерии пуповины, венозного протока и средней мозговой артерии плода. Критерии исключения: женщины, имевшие многоплодную беременность, либо подтвержденные генетические и хромосомные аномалии у плода.
Статистическая обработка
Были проведены статистическая обработка полученных данных с помощью пакета прикладных программ IBM SPSS Statistics 21 с использованием статистических критериев Колмогорова–Смирнова для проверки гипотезы о принадлежности исследуемой выборки нормальному закону распределения, t-критерия Стьюдента и U-критерия Манна–Уитни, расчет относительного риска. При выполнении сравнения двух независимых групп по одному признаку были использованы методы непараметрической статистики (точный критерий Фишера, классический критерий χ² по Пирсону).
При описании признаков, имевших нормальное распределение, данные представлены в виде М (SD) – среднее (стандартное отклонение). Для проведения анализа этих данных применялся t-критерий Стьюдента для независимых выборок после предварительной проверки гипотезы о равенстве дисперсий при помощи критерия Левена (таким образом, выполнено сравнение средних при анализе срока родоразрешения и массы новорожденных в исследуемых группах).
При описании признаков, имевших распределение, отличное от нормального, данные представлены в виде Ме (Q1;Q3) – медиана (первый квартиль; третий квартиль – интерпроцентильный размах). Для проведения анализа этих данных применялся U-критерий Манна–Уитни для независимых выборок (таким образом, выполнено сравнение средних при анализе длительности пролонгирования беременности при выявлении критических нарушений фетоплацентарного кровотока, продолжительности реанимации у новорожденных).
Статистически значимыми считались различия данных при р<0,05, что соответствует критериям, принятым в медико-биологических исследованиях. Если значение p было меньше 0,001, то p указывали в формате p<0,001.
Результаты и обсуждение
Беременные сравниваемых групп были сопоставимы по возрасту, исходному индексу массы тела, сопутствующей патологии и акушерско-гинекологическому анамнезу. При анализе структуры перинатальных потерь в 1-й группе большинство (n=20, что составляет 90,9%) новорожденных умерли в неонатальный период, четверо из них – в течение первых 7 суток жизни. Одна женщина была родоразрешена по поводу антенатальной гибели плода (4,5%), и у одной пациентки ребенок погиб интранатально (4,5%).
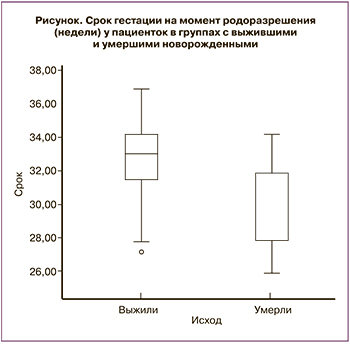 Все включенные в исследование женщины с ЗРП были родоразрешены преждевременно, в среднем в 32,3 (2,3) недели беременности (М (SD)) (рисунок). Срок гестации на момент родов в группе с умершими детьми составил 30,0 (2,3) недели, в группе с пережившими неонатальный период – 32,8 (2,0) недели, статистически значимых различий по сроку родов выявлено не было (p=0,37).
Все включенные в исследование женщины с ЗРП были родоразрешены преждевременно, в среднем в 32,3 (2,3) недели беременности (М (SD)) (рисунок). Срок гестации на момент родов в группе с умершими детьми составил 30,0 (2,3) недели, в группе с пережившими неонатальный период – 32,8 (2,0) недели, статистически значимых различий по сроку родов выявлено не было (p=0,37).
При оценке массы тела новорожденных в анализируемых группах была выявлена статистически значимая (p<0,001) разница: в 1-й группе масса тела детей при рождении составила 969,1 (214,8) г (М (SD)), во 2-й группе – 1332,4 (275,7) г. Вероятнее всего, эта разница в массе тела новорожденных при статистически незначимо различающемся сроке гестации на момент родоразрешения была обусловлена более выраженной и/или более длительной ЗРП, сопровождавшейся более тяжелыми нарушениями в системе плодово-плацентарного кровообращения.
Большинство пациенток были родоразрешены путем кесарева сечения (17 из 22 (77,3%) – в группе с умершими детьми и 105 из 116 (90,5%) – в группе с пережившими неонатальный период новорожденными, p=0,075). Анализируемые группы были сопоставимы по структуре показаний для завершения беременности. Наиболее часто женщин родоразрешали по поводу преэклампсии тяжелой степени (9 человек (40,9%) – в 1-й группе и 45 женщин (38,8%) – во 2-й группе) и фетоплацентарной недостаточности (6 женщин (27,3%) – в 1-й группе и 48 человек (41,4%) – во 2-й группе), в том числе декомпенсированной.
При сравнении показателей фетоплацентарной гемодинамики по данным допплерометрии были получены следующие результаты: беременных с критическими нарушениями плодово-плацентарного кровотока было статистически значимо больше во второй группе (таблица). К пациентам с критическими нарушениями фетоплацентарной гемодинамики были отнесены женщины, имевшие «нулевой» или реверсный конечно-диастолический кровоток в артерии пуповины, а также те, у которых определялся «нулевой» или реверсный кровоток в венозном протоке. При этом состояние гемодинамики оценивалось по наиболее тяжелым нарушениям фетоплацентарного кровотока: так, при наличии «нулевого» конечно-диастолического кровотока в артерии пуповины, но при этом ортоградного – в венозном протоке женщины были отнесены к категории «нулевого» конечно-диастолического кровотока в артерии пуповины; а при реверсном конечно-диастолическом кровотоке в артерии пуповины, сопровождавшемся «нулевым» кровотоком в венозном протоке, – к категории «нулевого» кровотока в ductus venosus.
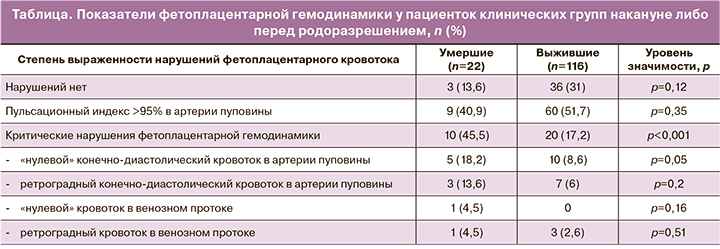
Итак, доля критических нарушений фетоплацентарного кровотока была статистически значимо (p<0,001) выше в группе, где новорожденные не выжили (10 человек – 45,5%), по сравнению с группой с выжившими детьми (20 человек – 17,2%). Таким образом, смертность среди детей, имевших критические нарушения кровотока (n=30), составила 33,3% (n=10), что статистически значимо (p=0,003) выше, чем без критических нарушений (11,1%, n=20; ОР 3,0; 95% ДИ 1,3–6,62). В структуре критических нарушений фетоплацентарной гемодинамики (по степени выраженности) преобладал нулевой либо реверсный конечно-диастолический кровоток в артериях пуповины. Нарушения в венозном протоке (ретроградный кровоток) несколько чаще (но статистически незначимо, p=0,51) встречались в 1-й группе.
При оценке смертности новорожденных у пациенток клинических групп, в зависимости от степени выраженности нарушений фетоплацентарной гемодинамики, было выявлено, что у пациенток без нарушений плодово-плацентарного кровотока смертность новорожденных составила 7,7% (3 из 39 новорожденных), при наличии нарушений, не достигающих критических значений (пульсационный индекс в артерии пуповины более 95%), – 13% (9 из 69 детей). В структуре пациенток с критическими нарушениями фетоплацентарной гемодинамики наибольшая смертность новорожденных отмечена в группе с нарушениями в венозном протоке – «нулевой» либо реверсный кровоток – 40% (двое из пяти детей). При наличии «нулевого» и ретроградного конечно-диастолического кровотока в артерии пуповины смертность составила по 30% в каждой из подгрупп (3 из 10 детей при «нулевом» и 5 из 15 детей при ретроградном конечно-диастолическом кровотоке в артерии пуповины). Таким образом, мы наблюдаем прогрессивное повышение показателей перинатальной смертности по мере нарастания выраженности нарушений фетоплацентарного кровотока, однако смертность при критических нарушениях остается стабильно высокой при различной степени выраженности.
Длительность пролонгирования беременности при выявлении критических нарушений фетоплацентарного кровотока была больше (но статистически незначимо, p=0,88) в группе, где дети умерли: 1,0 (0; 6,3) суток (Me (Q1;Q3)), в группе с выжившими детьми этот показатель составил 1,0 (0,3;1) суток.
Практически все беременные с критическими нарушениями плодово-плацентарной гемодинамики, у которых дети пережили неонатальный период, были родоразрешены в тот же день, когда эти нарушения были выявлены, либо на следующий день (за исключением двоих).
При анализе состояния детей на момент рождения у новорожденных, имевших критические нарушения плодово-плацентарной гемодинамики, отмечена более низкая оценка по шкале Апгар как на 1-й минуте – 4,5 (3,0;5,0) балла, Me (Q1;Q3), так и на 5-й минуте – 6,0 (5,0;6,0) балла) по сравнению с детьми без критических нарушений фетоплацентарного кровотока – 6,0 (5,0;6,0) балла на 1-й и 6,0 (6,0;7,0) балла на 5-й минуте соответственно; разница статистически значимая (p<0,001 на 1-й и p<0,001 на 5-й минутах). Дети с критическими нарушениями плодово-плацентарной гемодинамики менее длительно (p=0,93) нуждались в реанимации – 12,0 (9,0;25,0) дня по сравнению с детьми без критических нарушений фетоплацентарного кровотока – 15,0 (6,3;26,8) дня. Данный результат объясняется более высокой смертностью среди детей, имевших критические нарушения кровотока. Таким образом, их пребывание в отделении реанимации и интенсивной терапии было менее длительным вследствие гибели.
До родоразрешения большей части пациенток проводилась профилактика респираторного дистресс-синдрома плода курсом дексаметазона внутримышечно, суммарная доза 24 мг. Профилактику незрелости легких плода получили 15 беременных (68,2%) 1-й группы и 82 женщины (70,7%) из 2-й группы – с пережившими неонатальный период новорожденными (p=0,81).
Выводы
Проведенное клиническое исследование позволило оценить важность допплерометрического мониторинга плодово-плацентарного кровотока у беременных с ЗРП. У беременных, чьи новорожденные впоследствии умерли, статистически значимо чаще во время беременности выявлялись критические нарушения фетоплацентарной гемодинамики. Наше исследование показало, что появление критических нарушений фетоплацентарной гемодинамики на момент родоразрешения повышает риск анте-, интранатальной гибели либо смерти ребенка в течение первых 28 дней в 3 раза.
Появление критических нарушений плодово-плацентарного кровотока, вне зависимости от степени их выраженности, повышает риск рождения ребенка в тяжелом состоянии (более низкая оценка по шкале Апгар) и продолжительность реанимации, особенно при длительном пролонгировании беременности после регистрации критических нарушений фетоплацентарной гемодинамики.
Существенным фактором, определяющим исход для новорожденного с ЗРП, является масса плода при рождении: чем меньше масса плода, обусловленная длительными плацентарными нарушениями, тем риск перинатальной смертности выше.
Результаты данного исследования демонстрируют важность регулярной допплерометрии плодово-плацентарного кровотока при выявлении ЗРП с целью контроля за внутриутробным состоянием плода и улучшения перинатальных исходов. Несомненно, назрела необходимость разработки федеральных клинических рекомендаций по ведению беременных с плацентарной недостаточностью и ЗРП для регламентирования выбора оптимального момента родоразрешения. Тем не менее подход к родоразрешению пациенток с ЗРП должен быть исключительно персонифицированным, с учетом повышения риска мертворождения и более тяжелой гипоксии к моменту рождения при отсроченном родоразрешении, особенно на фоне пролонгирования беременности при критических нарушениях фетоплацентарной гемодинамики и более выраженной незрелости и низкой массе тела при рождении – при неотложном родоразрешении.



