Врастание плаценты представляет собой аномальное частичное или полное прикрепление ворсин плаценты к стенке матки. Рост частоты операций на матке способствует повышению распространенности рассматриваемой патологии: более чем в 10 раз за последние 30 лет. Не диагностированное своевременно врастание плаценты связано с высоким риском массивной кровопотери, значительной материнской смертностью и травматизацией.
Формирование мочеполовых, в частности, пузырно-влагалищных свищей (ПВС) является одним из наиболее частых итогов травматизации, обусловленной осложненным родоразрешением при врастании плаценты. ПВС приводят к длительной утрате трудоспособности, социальной дезадаптации, вызывают тяжелые моральные страдания, значительное снижение качества жизни. Несмотря на то, что первое описание ПВС датируется 1550 г. до н.э., а признаки ПВС обнаружены в мумифицированном теле женщины от 2050 г. до н.э., и сегодня проблема рецидивирующих ПВС актуальна [1, 2].
ПВС представляют собой аномальное сообщение между мочевым пузырем и влагалищем [3, 4]. Распространенность урогенитальных свищей варьирует в разных странах: являясь редкими в Европе и Северной Америке, они часто встречаются в Африке, Индии, Юго-Восточной Азии [5]. Наиболее частой (>75%) причиной формирования ПВС в развитых странах является ятрогенная травма, в развивающихся – осложненные затяжные роды [6]. Из 300 случаев хирургического лечения ПВС в клинике Mayo образование 82% фистул было связано с гинекологическими операциями, 8% – с акушерским пособием, 6% – с лучевой терапией, 4% – непосредственно с травмами. В целом эта статистика отражает этиологический спектр ПВС в развитых странах [5].
В России, как и в мире, более 70% ПВС развиваются как осложнение операций на органах малого таза, как правило, гинекологического и проктологического профиля. В среднем частота формирования мочеполовых свищей после гинекологических операций составляет 0,05–1%. После лапаротомных гистерэктомий ПВС развиваются в 0,08% случаев, после лапароскопических и влагалищных гистерэктомий – до 1%, после радикальных гистерэктомий и лучевой терапии по поводу онкологических заболеваний женской половой системы – до 4%. После тазовых экзентераций вероятность возникновения ПВС существенно выше – до 10%. При этом формированием урогенитальных фистул чаще осложняются операции, выполненные по экстренным показаниям, в результате непосредственной травмы нижних мочевых путей [5].
По данным мировой литературы, каждое четвертое родоразрешение осуществляется путем кесарева сечения, и у каждой пятой из них послеоперационный период протекает с осложнениями. Во время кесарева сечения в среднем в 2–12% наблюдений травмируются органы мочевой системы. Во время беременности стенка мочеточника теряет свой обычный тонус. Просвет его расширяется, сокращения вялые, редкие. Мочеточник приобретает множественные изгибы и располагается более латерально. Вследствие указанных изменений нередко его труднее дифференцировать, что способствует его повреждениям при операциях на органах малого таза. Также у беременных наблюдаются истончение стенки мочевого пузыря, уменьшение его тонуса. Уменьшается его переднезадний размер, который во время родов при стоянии головки в малом тазу может достигать нескольких миллиметров. Этими изменениями объясняются повреждение мочевого пузыря, иногда передней и задней стенок одновременно, при проведении кесарева сечения внебрюшинным доступом [7].
К факторам, которые увеличивают риск травм органов мочевой системы, относят также наличие рубцов после ранее перенесенных операций на органах половой системы, а также спаечные процессы после воспалительных заболеваний органов малого таза. Рубцовые изменения самой стенки матки, а также вовлечение в рубцовый процесс рядом расположенных органов (мочевого пузыря, мочеточников) приводят к тому, что при разрыве стенки матки одновременно могут повреждаться и мочевые пути. Острая или хроническая задержка мочи после операции может быть дополнительным фактором риска формирования ПВС [5].
Частота травматизации мочевого пузыря при кесаревом сечении относительно невысока и составляет 0,0016–0,94% [8]. Однако патологические особенности, в частности, врастание плаценты, значительно повышают риск этого осложнения: 11,7% [9].
Лечение при ПВС включает консервативные и хирургические методы. Консервативный подход включает постоянное дренирование мочевого пузыря уретральным катетером, строгий постельный режим в положении пациентки на животе или боку, противоположном фистуле, постоянное орошение мочевого пузыря растворами антисептиков. Этот метод эффективен лишь при диаметре свищевого отверстия менее 3 мм и небольшой продолжительности (не более 2 недель) существования свища. Эффективность консервативного лечения не превышает 12% [10].
Хирургическое лечение, как правило, выполняется в объеме трансвагинальной или трансабдоминальной фистулопластики или цистэктомии с отведением мочи [3, 4]. Фистулопластика, как менее травматичное вмешательство, более предпочтительна; в среднем ее эффективность достигает 90–98% [10]. Эффективность фистулопластики значительно ниже при обширных и, особенно, постлучевых дефектах стенки мочевого пузыря – около 60% [1].
Сложные ПВС с дефектом 2/3 и более объема тканей органов, образующих свищ, являются наиболее трудными для хирургической коррекции, о чем свидетельствует высокая частота рецидивов – 15–70% [9]. Многократные хирургические вмешательства приводят к постепенному уменьшению объема мочевого пузыря и формированию микроцистиса [9]. Утрата емкости мочевого пузыря, обширные дефекты дна мочевого пузыря и отсутствие мочеиспускательного канала являются показанием к пересадке мочеточников в кишечник или к суправезикальному отведению мочи с формированием резервуаров [5].
Клиническое наблюдение
Рассматриваемую проблематику наглядно иллюстрирует предложенное клиническое наблюдение.
05.05.2021 г. пациентка Р., 38 лет, была в плановом порядке госпитализирована в акушерское отделение по месту жительства с диагнозом Роды III, своевременные, оперативные, в 27 недель в головном предлежании, рубец на матке (состояние после 2 операций кесарева сечения). Оперативное родоразрешение осложнилось разрывом матки и мочевого пузыря, обусловленным ранее не диагностированным врастанием плаценты. Развилась массивная кровопотеря, синдром диссеминированного внутрисосудистого свертывания, геморрагический шок IV степени. По жизненным показаниям выполнена экстирпация матки с маточными трубами. Хирургическое вмешательство позволило сохранить жизнь пациентки и новорожденного, однако в ходе операции были повреждены мочеточники и мочевой пузырь, в связи с чем, потребовалось интраоперационное ушивание дефекта стенки мочевого пузыря, перевязка мочеточников и билатеральная чрескожная пункционная нефростомия. Послеоперационный период осложнился постгеморрагической анемией, миокардиодистрофией, острой сердечной и надпочечниковой недостаточностью, уретерогидронефрозом. Потребовалась длительная, в течение 30 часов, искусственная вентиляция легких.
На 2-е сутки после операции пациентка в тяжелом состоянии переведена в ФГБУ «НМИЦ акушерства и гинекологии им. В.И. Кулакова» Минздрава России. При осмотре выявлены слабоположительные перитонеальные симптомы, симптомы динамической кишечной непроходимости. По результатам общего анализа крови на момент перевода: анемия средней степени тяжести (гемоглобин 78 г/л), лейкоцитоз (13×108/л). Гемостаз без выраженных патологических изменений. По данным компьютерной томографии (КТ) органов грудной клетки и брюшной полости от 07.05.2021 г.: двусторонний гидроторакс. Воспалительные изменения легких на фоне компрессионных изменений. Динамическая кишечная непроходимость. Двусторонний гидронефроз. При ультразвуковом исследовании (УЗИ) органов брюшной полости от 09.05.2021 г.: по 150 мл свободной жидкости под печенью и в малом тазу. Перистальтика кишечника маятникообразная, петли кишечника расширены.
10.05.2021 г., после стабилизации общего состояния, выполнена верхне-, средне-, нижнесрединная лапаротомия, ревизия брюшной полости и малого таза, позволившая выявить несостоятельность послеоперационного рубца мочевого пузыря и мочевой перитонит, осложненный парезом кишечника. Дефект мочевого пузыря ушит, выполнены мобилизация, стентирование мочеточников и их реимплантация по методике Боари. В просвет мочевого пузыря установлен катетер Фолея, мочевой пузырь ушит двухрядным швом. Шов мочевого пузыря укрыт прядью сальника на сосудистой ножке. Десерозированные участки кишечника ушиты серо-серозными швами, на дефект серозы наложен погружной кисетный шов. Проведены санация, дренирование брюшной полости и малого таза.
Послеоперационный период протекал благополучно, пациентка выписана на 14-е сутки после операции в удовлетворительном состоянии, с функционирующими нефростомами и мочеточниковыми стентами обеих почек.
Через 3 месяца после операции пациентка стала отмечать боли в поясничной области, повышение температуры до 39°С, подтекание мочи из влагалища. При обследовании по месту жительства выявлена дислокация нефростомы справа, верифицированы острый тубулоинтерстициальный обструктивный пиелонефрит и формирование ПВС. Пациентка была госпитализирована в урологическое отделение по месту жительства. В срочном порядке выполнена повторная чрескожная пункционная нефростомия справа, проводилась антибактериальная терапия (ванкомицин, 500 мг, 2 раза в сутки в течение 7 суток). Острый пиелонефрит был купирован; после восстановления нефростомы справа подтекание мочи из влагалища прекратилось.
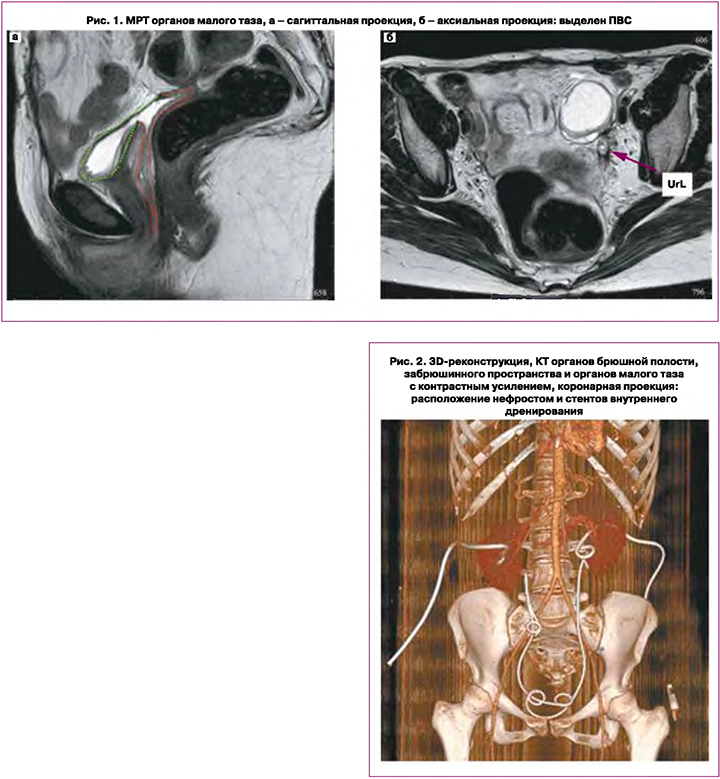
С октября 2021 г. вновь отмечено выделение мочи из влагалища, верифицирована дислокация нефростомы из расширенной лоханки правой почки. 15.11.2021 г. пациентка госпитализирована в ФГБУ «Национальный медицинский исследовательский центр хирургии им. А.В. Вишневского» Минздрава России (далее – НМИЦ хирургии им. А.В. Вишневского) с целью хирургического лечения. При дообследовании выполнена магнитно-резонансная томография (МРТ) органов малого таза, подтвердившая наличие ПВС (рис. 1). Протяженность дефекта стенки мочевого пузыря составляла 0,7 см, дистальный край свища располагался на расстоянии менее 1,5 см от меатуса, вокруг свища имел место умеренный фиброз. Объем мочевого пузыря не превышал 30 мл.
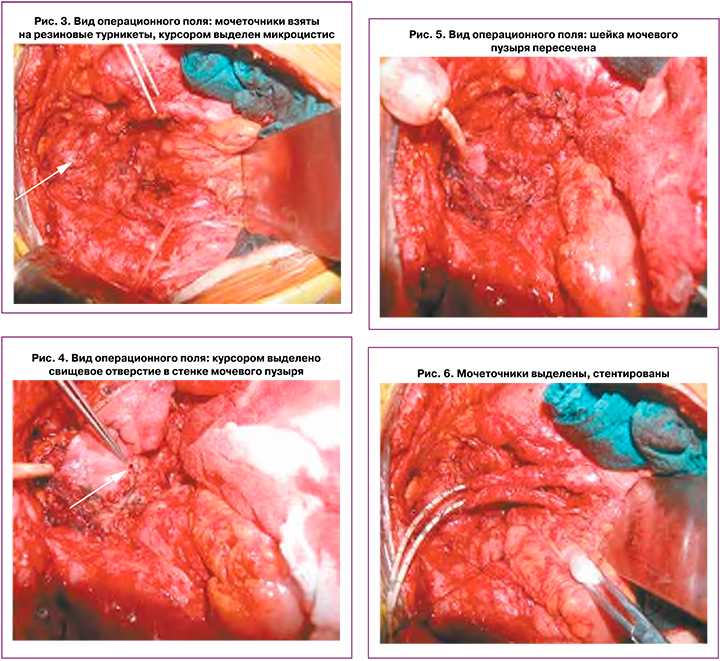
По данным КТ органов брюшной полости, забрюшинного пространства и органов малого таза с контрастным усилением, состояние после нефростомии с двух сторон, установки интегральных стентов мочеточников, миграция стента правого мочеточника. Признаки перенесенного двустороннего пиелонефрита (рис. 2).
По результатам бактериологического посева мочи выявлена Klebsiella pneumoniae 108. С учетом аллергоанамнеза и устойчивости бактерии к антибиотикам была назначена следующая антибактериальная терапия: тигециклин 50 мл 2 раза в сутки, амикацин 1 г 1 раз в сутки в течение 7 суток.
24.11.2021 г. в НМИЦ хирургии им. А.В. Вишневского выполнена операция в объеме: цистэктомия, ортотопическая везикопластика изолированным сегментом подвздошной кишки (операция Штудера). Иссечение пупочной грыжи.
В положении пациентки на спине со слегка опущенными ногами и валиком под крестцом в стерильных условиях влагалище туго затампонировано, в мочевой пузырь установлен катетер Фолея. Выполнена нижняя срединная лапаротомия с иссечением послеоперационного рубца. Ревизия брюшной полости: спаечный процесс, состояние после гистерэктомии, резекции мочевого пузыря. С техническими трудностями припаянная кишка выделена из спаечного процесса. С техническими трудностями выделены и пересечены у терминальной линии таза оба мочеточника.
Брюшина вскрыта параллельно пупочным связкам, вход в предпузырное пространство осуществлен пересечением пупочной связки. Выделен мочевой пузырь диаметром не более 3 см (рис. 3). В связи с малым объемом мочевого пузыря принято решение о цистэктомии и формировании необладера.
Дугообразным разрезом рассечены предпузырная брюшина и пузырно-лобковые связки. Обеспечен доступ в Ретциево пространство. Мочевой пузырь, левый яичник мобилизованы. Визуализирован ПВС размерами 0,7×0,5 см (рис. 4).
Выделена шейка мочевого пузыря, пересечена острым путем (рис. 5).
На уретру наложено 6 викриловых провизорных швов 4-0. На протяжении 15 см выделены правый и левый мочеточники. Произведено стентирование мочеточников J-образными мочеточниковыми стентами № 8 по Шариеру (рис. 6). Левый мочеточник проведен через сформированное окно в брыжейке сигмовидной кишки под нижней брыжеечной артерией в правую подвздошную область.
Принято решение о налаживании деривации мочи путем формирования артифициального мочевого пузыря из кишечного кондуита по методике Studer. Выделен сегмент подвздошной кишки длиной 55 см (20+20+15) на расстоянии 25 см от илеоцекального перехода (рис. 7).
Кишка пересечена с помощью линейного сшивающего аппарата. Следует отметить умеренно выраженный спаечный процесс в области слепой кишки и илеоцекального перехода (аппендэктомия в анамнезе). Восстановлена проходимость тонкой кишки аппаратным антиперистальтическим латеро-латеральным анастомозом (Endo Gia 50 мм (2) + 90 мм (1)). Линия металлического шва подкреплена серозно-мышечными узловыми викриловыми швами 3-0. Проксимальный и дистальный конец трансплантанта дополнительно погружены полукисетными викриловыми швами 3-0. Дистальные 40 см отрезка трансплантанта детубуляризированы, U-образно уложены и сшиты непрерывным однорядным викриловым швом 3-0. Полученная задняя стенка необладера сложена в поперечном направлении в соотношении 2/3 к 1/3. Продольная часть передней стенки сформирована непрерывным викриловым швом 3-0. Специально оставлена 1/3 передней стенки: как технологическое окно для манипуляций внутри необладера. В недетубуляризированную проксимальную часть резервуара имплантированы оба мочеточника по методике Сагаловски одиночными биосиновыми швами 5-0 (рис. 8).
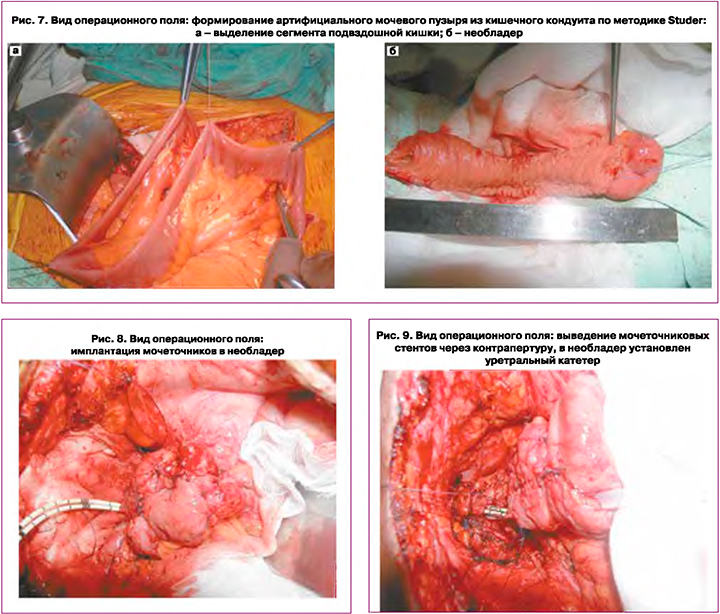
В наиболее низкой точке каудальной части необладера выполнена контрапертура диаметром 2–3 мм, через которую выведены оба мочеточниковых стента (рис. 9), и внутрь необладера введен уретральный силиконовый катетер № 18.
Оставшаяся 1/3 неушитого необладера герметизирована непрерывным викриловым швом 3–0. Наложен анастомоз между уретрой и сформированной шейкой необладера. Ортотопический резервуар низведен в малый таз. Завязаны лигатуры. В необладер введено 50 мл воды. Гидростаз адекватный. Выполнена пластика стенки влагалища сальником (рис. 10). Дополнительный гемостаз. Сухо.
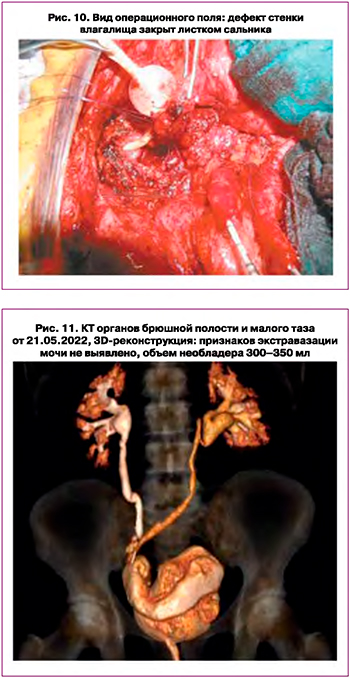
Далее выполнены герниотомия и пластика белой линии живота. Произведена мобилизация кожно-жировых лоскутов от апоневроза в стороны на 8–10 см. Гемостаз. Произведено ушивание белой линии живота с укреплением непрерывного шва отдельными узловыми швами через каждые 5–6 см. Установлен страховочный дренаж BLAKE через отдельный прокол кожи. Послойное ушивание операционной раны с наложением отдельных узловых швов. Асептическая наклейка. Время операции составило 9 ч, кровопотеря – 300 мл. На самостоятельном дыхании пациентка переведена в отделение реанимации и интенсивной терапии.
Послеоперационной период протекал без особенностей. Проводилась инфузионная, гастропротекторная, антибактериальная, антисекреторная, анальгетическая терапия и регулярные перевязки.
При контроле, 26.11.2021 г., КТ органов брюшной полости и малого таза: состояние после операции, нет данных за активное кровотечение, экстравазацию мочи. Перед выпиской выполнена антеградная замена внутренних стентов под рентгенологическим контролем. Пациентка выписана на 14-е сутки после операции в удовлетворительном состоянии.
В январе 2022 г. были удалены уретральный катетер и внешние стенты. Акт мочеиспускания восстановился. Удержание мочи удовлетворительное.
25.05.2022 г. выполнено оперативное вмешательство в объеме: Цистоскопия мочевого резервуара, замена внутренних стентов.
По данным контрольных исследований.
Цистография антеградная от 31.05.2022: Уретероэктазия слева. Сброс в необладер получен. Удовлетворительное положение стентов.
УЗИ почек, надпочечников, забрюшинного пространства от 01.06.2022: Правая почка визуализируется размерами 114,0×47,4 мм, с четкими ровными контурами, отчетливо прослеживается кортико-медуллярная дифференциация, паренхиматозный слой достаточно выражен – 13,7 мм, чашечно-лоханочная система расширена за счет чашечек максимально до 17,7 мм и лоханки – до 24,7 мм. Мочеточник расширен на всем протяжении максимально до 10,0 мм. В проекции лоханки определяется проксимальный конец стента. Левая почка визуализируется размерами 112,0×50,1 мм, с четкими ровными контурами, отчетливо прослеживается кортико-медуллярная дифференциация, паренхиматозный слой достаточно выражен – 13,5 мм, чашечно-лоханочная система значимо не расширена, структуры уплотнены. Конкрементов не выявлено. Стент лоцируется в проекции лоханки.
При контрольной КТ органов брюшной полости и малого таза от 21.05.2022 признаков экстравазации мочи не выявлено, объем необладера 300–350 мл (рис. 11).
В настоящее время продолжительность послеоперационного периода составляет 8 месяцев. Пациентка отмечает улучшение общего состояния, восстановление работоспособности.
Обсуждение
Описанный случай примечателен по ряду причин.
В первую очередь, это осложненное течение родов, обусловленное врастанием плаценты. Проблемы своевременной диагностики врастания плаценты и определения тактики лечения и родоразрешения пациенток с данной патологией представляются чрезвычайно актуальными, так как это состояние сопряжено с высоким риском профузного кровотечения во время отделения плаценты, что представляет угрозу жизни матери и новорожденного и нередко приводит к гистерэктомии. Кроме того, в настоящее время сохраняется тенденция к значительному увеличению распространенности врастания плаценты в связи с ростом числа кесаревых сечений и внутриматочных хирургических вмешательств [11–14]. Только при своевременной диагностике врастания возможно осуществление полноценной подготовки к операции. Для ранней постановки диагноза необходимо учитывать анамнез пациенток (многократные внутриматочные вмешательства с повреждением структуры миометрия), а также наличие предлежания плаценты по данным инструментальных обследований. Зачастую осуществить органосохраняющую операцию при врастании плаценты крайне сложно, что связано с обширной площадью и топографией врастания, а также необходимостью высокой квалификации хирургической бригады и условий предоперационной диагностики. Для снижения частоты патологической плацентации необходимо с особой серьезностью подходить к вопросам, связанным с инвазивными вмешательствами на матке. Любая инструментальная процедура на матке должна осуществляться только при абсолютной необходимости.
Следующей важной проблемой данного клинического наблюдения является определение объема операции при ПВС. Выбор в пользу цистэктомии в данном случае был обусловлен не столько размерами и локализацией дефекта, сколько его рецидивным характером и отсутствием достаточного объема мочевого пузыря: микроцистис объемом 30 мл не представлял возможности адекватной фистулопластики и восстановления резервуарной функции мочевого пузыря. Формирование ортотопического необладера, напротив, позволило минимизировать травмирующие последствия операций и обеспечило оптимальное качество жизни пациентки.
В целом ортотопическое замещение мочевого пузыря обоснованно считается лучшей методикой отведения мочи на сегодняшний день. Она имеет не только более низкую частоту осложнений, но и хорошие функциональные результаты. Формирование ортотопического необладера способствует достижению достаточной социальной, психологической адаптации и высокой самооценки [15]. Как бы то ни было, ортотопическая везикопластика сохраняет статус одного из наиболее сложных по технике выполнения и особенностям периоперационного ведения вмешательств, выполняемого на должном уровне только в крупных специализированных многопрофильных центрах.
Заключение
Таким образом, очевидна необходимость мультидисциплинарного подхода в ведении беременности и родоразрешении пациенток с повторными кесаревыми сечениями и внутриматочными вмешательствами. На наш взгляд, необходимо введение общих стандартов обследования беременных при высоком риске врастания плаценты. Хирургическое родоразрешение пациенток группы высокого риска должно осуществляться в многопрофильном центре, при участии не только акушерско-гинекологической бригады, но и специалистов урологического профиля.



