Рак молочной железы (РМЖ) является наиболее частым злокачественным новообразованием у женщин во всем мире. По данным J. Ferlay и соавт., ежегодно диагностируется примерно 1,4 млн новых случаев рака [1]. По данным В.И. Чиссова, в 2011 г. в России смертность от РМЖ в структуре смертности женщин от злокачественных новообразований составила 17,3% [2]. По данным ФГБУ МНИОИ им. П.А. Герцена Минздрава России, в 2012 г. число вновь выявленных случаев РМЖ составило 56 154 [3]. Учитывая лидирующие позиции РМЖ у женщин репродуктивного возраста, в последнее время приобретает актуальность изучение проблемы сочетания его с беременностью.
К наиболее часто встречаемым онкологическим заболеваниям во время беременности относят: РМЖ, онкогематологические заболевания и рак шейки матки [4, 5]. РМЖ, связанный с беременностью (РМЖСБ) – это рак, диагностируемый во время беременности, а также на фоне лактации в течение первого года после родов. Он встречается в когорте молодых женщин, составляет 1% всего РМЖ [6]. В последнее время происходит изменение отношения к проблеме РМЖСБ в связи с лидирующими позициями в структуре онкозаболеваемости среди женщин репродуктивного возраста, а также желанием женщины иметь детей. Благодаря накопленным данным, разработанным алгоритмам ведения таких пациенток, проведением адекватного противоопухолевого лечения во время беременности, увеличивается число женщин, которые отказываются прерывать беременность. Для лучшего прогноза общей и безрецидивной выживаемости у женщин с РМЖСБ лечение во время беременности необходимо проводить, используя те же схемы, что и для лечения рака вне беременности [7, 8].
Одним из важных индикаторов качества при проведении противоопухолевого лечения является оценка состояния здоровья новорожденного. По литературным данным, основными осложнениями у детей, рожденных у матерей с проведенной полихимиотерапией (ПХТ) во время беременности, являются: синдром задержки развития плода, недоношенность, низкая масса тела, мертворождения, пороки развития, нейтропения и анемия [7, 9]. В России до настоящего времени не проводились работы по оценке состояния здоровья новорожденных и детей у матерей с РМЖСБ на фоне противоопухолевой терапии во время беременности, что и стало целью данной работы.
Материал и методы исследования
 В проспективное когортное исследование были включены 38 детей, рожденные в период с 2009 по 2013 г. у матерей с РМЖСБ. Все дети были распределены на 2 группы. 1-ю группу составили 22 ребенка (из них одна двойня), матери которых получали ПХТ во время беременности по поводу РМЖ, 2-ю группу составили 16 детей (из них 2 двойни), матери которых во время беременности не получали противоопухолевого лечения. Химиотерапия в 1-й группе проводилась по следующим схемам: FAC (фторурацил, доксорубицин, циклофосфамид); FEC (фторурацил, эпирубицин (фарморубицин), циклофосфамид); AC (доксорубицин, циклофосфамид). Все дети оценивались по сроку гестации, антропометрическим показателям, шкале Апгар на 1-й и 5-й минуте. Всем детям проводили наружный осмотр с целью выявления возможных пороков развития, стигм дисэмбриогенеза, оценку зрелости по шкале Баллард, оценку показателей кислотно-основного состояния (КОС) в пуповинной крови ребенка после рождения и в периферической крови в случае нахождения ребенка в отделении интенсивной терапии новорожденных. Контроль нейтропении, анемии, тромбоцитопении проводили на 1-й и 3–5-й сутки жизни ребенка. Всем детям проводилось ультразвуковое исследование (УЗИ) головного мозга, внутренних органов (печени, селезенки, почек, надпочечников, тимуса, сердца).
В проспективное когортное исследование были включены 38 детей, рожденные в период с 2009 по 2013 г. у матерей с РМЖСБ. Все дети были распределены на 2 группы. 1-ю группу составили 22 ребенка (из них одна двойня), матери которых получали ПХТ во время беременности по поводу РМЖ, 2-ю группу составили 16 детей (из них 2 двойни), матери которых во время беременности не получали противоопухолевого лечения. Химиотерапия в 1-й группе проводилась по следующим схемам: FAC (фторурацил, доксорубицин, циклофосфамид); FEC (фторурацил, эпирубицин (фарморубицин), циклофосфамид); AC (доксорубицин, циклофосфамид). Все дети оценивались по сроку гестации, антропометрическим показателям, шкале Апгар на 1-й и 5-й минуте. Всем детям проводили наружный осмотр с целью выявления возможных пороков развития, стигм дисэмбриогенеза, оценку зрелости по шкале Баллард, оценку показателей кислотно-основного состояния (КОС) в пуповинной крови ребенка после рождения и в периферической крови в случае нахождения ребенка в отделении интенсивной терапии новорожденных. Контроль нейтропении, анемии, тромбоцитопении проводили на 1-й и 3–5-й сутки жизни ребенка. Всем детям проводилось ультразвуковое исследование (УЗИ) головного мозга, внутренних органов (печени, селезенки, почек, надпочечников, тимуса, сердца).
Результаты исследования
В 1-й группе средний гестационный возраст составил 34,0±0,86 недели, во 2-й группе – 34,0±2,24 недели. В 1-й группе недоношенными родились 15 из 22 детей (68,2%), из них в результате ранних преждевременных родов на сроке 28–33 недели родились 3 детей, преждевременных родов при сроке 34–36 недель – 12 детей. Во 2-й группе недоношенными родились 14 из 16 детей (87,5%), из них в результате очень ранних преждевременных родов до 28 недель родился 1 ребенок, ранних преждевременных родов при сроке 28–33 недели – 2 детей, преждевременных родов при сроке 34–36 недель – 11 детей. При анализе антропометрических данных среднее значение массы тела новорожденных составило 2491,45±105,33 г в 1-й группе и 2493,69±158,18 г во 2-й группе. В обеих группах дети с малым весом к сроку гестации составили 6%. Среднее значение длины в исследуемых группах составило 46,82±0,75 см и 46,91±0,85 см соответственно. Обе группы были сопоставимы по массе и росту. Следует отметить, что при анализе состояния детей по шкале Апгар на 1-й минуте в 1-й и во 2-й группе медиана составила 8 баллов (Р5-Р95 для 1-й группы – 7–8 баллов, для 2-й группы – 7–9 баллов). На 5-й минуте медиана составила 8 баллов (Р5-Р95 для 1-й группы – 7–9 баллов, для 2-й группы – 5–9 баллов). В 1-й группе в асфиксии легкой степени родилось 4 ребенка, в средне-тяжелой – один. Во 2-й группе в асфиксии легкой степени родилось 3 детей, в средне-тяжелой – один. После рождения были проанализированы показатели газов крови. Установлено, что значение рН у детей 1-й группы составило 7,27±0,03, во 2-й группе – 7,30.
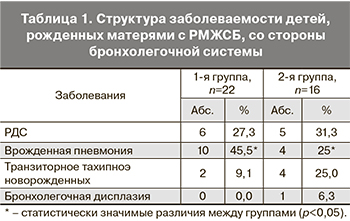
При анализе заболеваний со стороны дыхательной системы чаще всего у детей выявлялись: респираторный дистресс-синдром (РДС), врожденная пневмония, транзиторное тахипноэ. У одного ребенка, длительно находившегося на искусственной вентиляции легких (ИВЛ), развилась бронхолегочная дисплазия (табл. 1). Несмотря на то что всем пациенткам, родоразрешенным до 34 недель беременности, проводилась профилактика РДС во время беременности, частота развития РДС плода составила 27,3% в 1-й группе и 31,3% во 2-й группе (табл. 1).
Как видно из данных, представленных в табл. 1, у детей 2-й группы чаще отмечалось транзиторное тахипноэ (25%) по сравнению с 1-й группой – 9,1%. У детей 1-й группы врожденная пневмония развивалась в 2 раза чаще и составила 45,5 против 25% у детей 2-й группы. Выраженных различий в группах по развитию РДС не установлено. Следует отметить, что использование заместительной терапии экзогенным сурфактантом в 1-й группе было проведено в 4,5% случаев, во 2-й группе – в 12,5% случаев. В 1-й группе респираторная поддержка различными методами (SIPAP, BIPHASIC, традиционная ИВЛ) проводилась у 50% детей, во 2-й группе – у 56%. Статистически значимых межгрупповых различий в частоте применения различных способов дыхательной поддержки выявлено не было (SIPAP, р=0,985; BIPHASIC, р=0,844; ИВЛ, р=0,773).
При проведении химиотерапии препаратами антрациклинового ряда во время беременности следует уделять особое внимание их потенциально возможному кардио- и нейротоксичному воздействию на данные системы и органы. Так, при исследовании сердечно-сосудистой системы в 1-й группе по данным УЗИ у одного ребенка был выявлен синдром фетальных коммуникаций (незаращение овального окна), а во 2-й группе у одного ребенка выявлен гемодинамически незначимый порок развития сердца – аневризма межпредсердной перегородки. По данным УЗИ головного мозга у двоих детей 2-й группы выявлены субэпендимальные кисты. Следует также отметить, что у двоих детей 1-й группы диагностирован синдром угнетения центральной нервной системы, который купировался в течение первых 3 суток.
У одного ребенка 1-й группы развилась геморрагическая болезнь, проявившаяся в виде желудочного кровотечения.
Учитывая возможный тератогенный эффект противоопухолевого лечения во время беременности, все дети в исследуемых группах были обследованы на наличие мальформаций. Пороков развития в группах не выявлено.
Одним из ведущих осложнений противоопухолевого лечения является воздействие химиопрепаратов на кроветворную функцию. К основным осложнениям со стороны кроветворных органов относятся анемия, нейтропения, тромбоцитопения. Всем детям проводился динамический контроль показателей периферической крови на 1-е и 3–5-е сутки (табл. 2).
Как видно из данных, приведенных в таблице, у детей обеих групп изменений в виде анемии, нейтропении, тромбоцитопении не выявлено ни в одном случае. В исследуемых группах не выявлено статистически значимых различий по уровню лейкоцитов, эритроцитов, гемоглобина, тромбоцитов при сравнении с нормой на 1-е и 3–5-е сутки (р>0,05).
Обсуждение
В работе представлен первый опыт наблюдения детей, рожденных у матерей с РМЖСБ в России, проведен анализ состояния здоровья новорожденных у матерей в зависимости от проведения химиотерапевтического лечения и без него. Было установлено, что достоверных различий между группами по срокам родоразрешения, антропометрическим показателям, оценке состояния новорожденных по шкале Апгар не выявлено. Большинство из новорожденных в исследуемых группах были недоношенными: в 1-й группе 15 из 22 детей (68,2%), во 2-й группе – 14 из 16 детей (87,5%). Основной причиной высокого уровня преждевременных родов у женщин с РМЖСБ была необходимость родоразрешения для проведения дальнейшего более агрессивного лечения РМЖ, а не показания со стороны плода. К основным осложнениям у недоношенных детей следует отнести развитие дыхательных нарушений, требующих респираторной поддержки (у 50% детей 1-й группы, 56% – для 2-й группы), геморрагическую болезнь (в 4,5% случаев в 1-й группе). Было установлено, что у женщин с РМЖСБ высок процент недоношенных детей (29 из 38 детей (76%)), что позволяет сделать вывод о необходимости дальнейшего совершенствования алгоритмов ведения беременности с целью возможного более частого пролонгирования беременности до доношенного срока. При определении оптимальных сроков родоразрешения должна быть дана комплексная оценка состояния здоровья женщины и ребенка. Родоразрешение после 34 недель беременности является оптимальным в связи с формированием сурфактантной системы у плодов.

В исследовании большинство детей, рожденных у матерей с РМЖСБ, имели вес в пределах нормального диапазона для данного срока гестации. Лишь у 3 из 15 детей масса тела при рождении была ниже 10-го перцентиля для гестационного возраста. В то время как в проведенном Ring и соавт. исследовании (2005) у 17 из 28 детей, рожденных женщинами с РМЖСБ, получавшими ПХТ во время беременности, наблюдалась малая для гестационного возраста масса тела. Однако полученные данные не имели статистически значимых различий при сравнении с общепопуляционными показателями [10]. В основном тенденцию к рождению детей с низкой массой тела к сроку гестации, по данным Van Calsteren и соавт. (2010), имеют женщины с онкогематологическими заболеваниями во время беременности [7]. Опубликованное в 2012 г. исследование Abdel-Hady и соавт. показало отсутствие существенных различий в массе тела новорожденных, матери которых получали ПХТ во время беременности по поводу РМЖ, лимфомы Ходжкина или лейкоза с группой контроля (детей, рожденных здоровыми женщинами на том же сроке беременности) [11].
Причиной развития дыхательных нарушений, потребовавших респираторной поддержки, стала прежде всего незрелость органов дыхания, связанная с преждевременным родоразрешением, а не противоопухолевое лечение, что согласуется с данными, полученными Kristel Van Calsteren и соавт. (2007) [7].
Изменений со стороны сердечно-сосудистой системы в виде тахикардии, аритмии, сердечной недостаточности, кардиомиопатии, связанных с проведением ПХТ, в исследовании выявлено не было. В литературе описаны единичные случаи, когда у детей при рождении были заподозрены признаки кардиомиопатии, сердечной недостаточности. Однако проведение полного обследования после рождения позволило снять диагноз о врожденной патологии сердечно-сосудистой системы у этих детей [12, 13]. Изменения со стороны центральной нервной системы у детей связаны в первую очередь с их недоношенностью и незрелостью, что подтверждается и другими исследованиями [14, 15] .
В исследуемых группах пороков развития у детей не выявлено, что косвенно может свидетельствовать о безопасности применения ПХТ после окончания 1-го триместра, завершения процессов эмбриогенеза. Однако для окончательных выводов требуется дальнейшее изучение данной проблемы. Так, в работе Azim и соавт. (2010) использование ПХТ в 1-м триместре беременности приводило к повышению риска развития мальформаций у детей, а также мертворождений по сравнению с применением ПХТ во 2-м и 3-м триместрах [16].
Большинство препаратов для химиотерапии обладают миелосупрессивным действием после непосредственного окончания их применения [17].
Это необходимо учитывать при выборе срока родоразрешения. Промежуток времени должен составлять не менее 3 недель с момента окончания ПХТ, так как к основным проявлениям миелосупрессии относится развитие нейтропении, тромбоцитопении. В настоящее время в литературе описаны немногочисленные случаи наблюдения развития миелосупрессии у детей, матери которых получали противоопухолевое лечение РМЖ во время беременности. Описываются единичные случаи наблюдения нейтропении и/или панцитопении, например, при использовании высокодозной химиотерапии по поводу острого лейкоза [7]. В нашем исследовании у детей, матери которых получали или не получали химиотерапию, не выявлено статистически значимых различий в снижении количества эритроцитов, гемоглобина, тромбоцитов, а также нейтрофилов по сравнению с нормативными показателями на 1-е и 3–5-е сутки жизни. В исследованиях Garcia и соавт. (1999), Baumgartner и соавт. (2009) развитие анемии относится к проявлениям миелосупрессивного действия препаратов антрациклинового ряда, используемых для проведения ПХТ при РМЖСБ. [18, 19]. В наблюдении Massey Skatulla и соавт. (2012) у одного новорожденного анемия была отнесена к проявлению эмбриональной и в дальнейшем неонатальной дисфункции [20].
Заключение
Проведенный анализ полученных результатов позволяет сделать вывод, что основная патология новорожденных детей, родившихся у матерей с РМЖСБ как с лечением, так и без него во время беременности, связана с досрочным родоразрешением, и как следствие морфофункциональной незрелостью и недоношенностью ребенка. Прямого же воздействия на заболеваемость новорожденных химиотерапии в данном исследовании не установлено. Однако требуются дальнейшие исследования состояния здоровья детей, матери которых получали ПХТ, и оптимизация тактики ведения беременности с целью снижения частоты преждевременного родоразрешения без ухудшения прогноза для матери.



