Венозный проток вместе с артериальным протоком и овальным окном являются физиологическими шунтами, необходимыми для нормального развития органов и тканей плода. Кроме того, венозный проток – единственный венозный сосуд, которому отводится ключевая роль в поддержании уникальной схемы плодового кровообращения. Благодаря значительному ускорению насыщенная кислородом кровь из вены пуповины через венозный проток попадает в нижнюю полую вену, далее из правого предсердия через овальное окно – в левое предсердие и в левый желудочек: в большой круг кровообращения, минуя трикуспидальный клапан и правый желудочек. Именно этот механизм обеспечивает достаточную оксигенацию и поступление высокого содержания питательных веществ к миокарду и структурам мозга – жизненно важным тканям организма [1].
Внедрение ультразвуковой диагностики в акушерскую практику позволило детально изучить физиологические особенности развития и функционирования венозного протока, оценить гемодинамические изменения, связанные с плацентарной дисфункцией, пороками сердца и нарушением состояния плода, установить наличие различных вариантов аномального строения и/или отсутствие венозного протока, а также взаимосвязь последних с перинатальной патологией [1–3].
И тем не менее, до настоящего времени антенатальное определение даже самого факта наличия нормального венозного протока – важнейшего компонента фетальной гемодинамической системы – не является обязательным [4, 5], а классификация нарушений кровотока в маточно-плацентарной системе, используемая в большинстве медицинских учреждений нашей страны в течение нескольких десятилетий, не включала оценку кровотока в венозном протоке при критических состояниях плода [6].
Подобная ситуация диктует необходимость дополнительного обсуждения как теоретических моментов, так и практических аспектов и принципов оценки этого фетального шунта с врачами акушерами-гинекологами, генетиками и специалистами пренатальной ультразвуковой диагностики для повышения уровня их профессиональных компетенций и качества оказываемой медицинской помощи беременным пациенткам.
История первых описаний венозного протока
Первое описание венозного протока как ветви, отходящей от задней части ствола пупочной вены и впадающей в полую вену на ее передней поверхности, сделано в 1561 г. Андреасом Везалием (Andreas Vesalius). Однако имя протоку было дано в честь итальянского анатома Джулио Чезаре Арантиуса (Giulio Cesare Arantius), который в своей работе «Маленькая книга о человеческом зародыше (De humano fetus libellus)», вышедшей в свет в 1564 г., также описал наличие связи между пупочной веной и полой веной, существовавшей у плода и «высыхавшей» после рождения [7–9]. В том же веке один из основоположников научной анатомии Евстахий Бартоломео (Eustachio Bartolomeo) описал полулунный клапан нижней полой вены (valvula venae cavae inf. (Eustachii)), направляющий ее потоки крови через открытое у плода овальное окно в левое предсердие. Составленные Бартоломео анатомические таблицы и рисунки были обнаружены и опубликованы в 1714 г. [10, 11].
В середине прошлого столетия патологоанатомические данные начали дополняться результатами ангиографии, выполняемой перед искусственным прерыванием беременности живым плодам, либо катетеризации вены пуповины новорожденным, что позволило исследователям детально изучить правильное строение венозного протока, а также выявить и описать случаи его аномалий, в том числе у детей с врожденными пороками и синдромальной патологией [12–18].
Нормальное развитие и анатомия венозного протока
На настоящий момент установлено, что дефинитивные вены эмбриона начинают развиваться на 4-й неделе беременности из группы капиллярных сетей, формируя три парные венозные системы: желточные, пупочные и кардинальные вены. Последние дренируют сам эмбрион, пупочные вены – хорион и позднее плаценту, желточные вены – желточный мешок и развивающийся желудочно-кишечный тракт.
По мере развития эмбриона левая желточная вена регрессирует, и из правой желточной вены развивается внутри- и внепеченочная портальная венозная система. В пупочной системе правая пупочная вена регрессирует, а оставшаяся левая – напрямую присоединяется к портальной системе, образуя пупочно-портальную систему. Венозный проток, который выходит из пупочно-воротной системы, доставляет обогащенную кислородом кровь далее к сердцу [19, 20].
В фетальном периоде в норме интраабдоминально пупочная вена направляется от области пупочного кольца вверх, соединяется с левой портальной веной, затем идет резко вправо, создавая L-образный сегмент, известный как портальный синус. Именно от портального синуса и берет свое начало венозный проток, представляющий собой короткий сосуд, не имеющий ответвлений и поднимающийся вверх в направлении диафрагмы.
Устье венозного протока вместе с устьями печеночных вен открывается непосредственно под диафрагмой в нижнюю полую вену, впадающую в правое предсердие. Важной для нормального развития плода особенностью гемодинамики является ранее упомянутый факт, что, в отличие от уже родившегося человека, большая часть крови из нижней полой вены направляется через овальное окно из правого в левое предсердие, чему способствует Евстахиева заслонка, затем в левый желудочек, аорту и ее первые ветви: коронарные и брахиоцефальные артерии, обеспечивая таким образом максимальный приток кислорода и питательных веществ к миокарду и головному мозгу [21].
После рождения в нормальных условиях венозный проток регрессирует и становится соединительнотканным тяжом (венозной связкой: ligamentum Arantii) [22, 23].
Ультразвуковая оценка венозного протока у плода
Первые ультразвуковые описания венозного протока у плодов на сроках более 22 недель беременности были сделаны пионерами и отцами – основателями современной пренатальной диагностики Philippe Jeanty и Roberto Romero в 1980-х гг. [24–26].
При ультразвуковом исследовании для оценки венозного протока используют средне-сагиттальный либо косопоперечный срез живота плода с использованием различных цветовых допплеровских модальностей, а также объемных режимов их реконструкции. Нормальное развитие венозного протока может быть констатировано при визуализации всех компонентов так называемого афферентно-венозного комплекса плаценты – последовательно соединяющихся пупочной и левой воротной вены, портального синуса и венозного протока.
Для осмотра данного комплекса в косопоперечном срезе после выведения стандартного поперечного среза, используемого для измерения окружности живота плода, в котором в обязательном порядке должен определяться желудок и портальный синус в виде L-образного изгиба (рис. 1а), сохраняя изображение последнего на мониторе, необходимо наклонять датчик до визуализации пупочного кольца, интраабдоминального отдела пупочной вены, портального синуса (рис. 1б), и затем отходящего от него в сторону сердца венозного протока (рис. 1с). В средне-сагиттальном сечении туловища плода также необходимо проследить непрерывную связь пупочной вены, портального синуса и венозного протока, определить место его дренирования в нижнюю полую вену под диафрагмой (рис. 2) [27, 28].
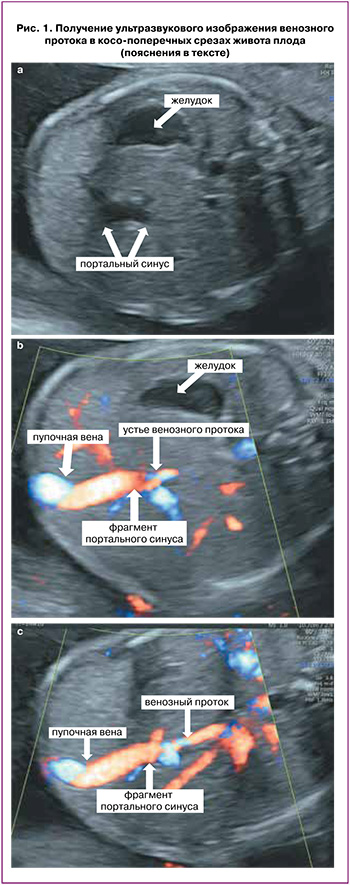
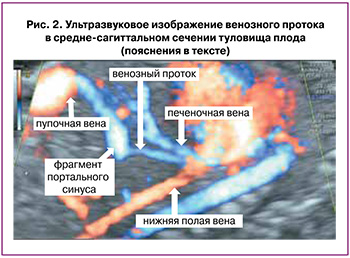
Многочисленными исследованиями продемонстрировано, что оценка наличия нормального венозного протока у плода не представляет сложностей в условиях рутинной практики и рекомендована для каждого клинического случая [29].
При отсутствии нормального венозного протока необходимы уже более детальная оценка всего венозного комплекса и поиск альтернативного пути плацентарного дренажа: поступления оксигенированной крови к сердцу плода.
Пренатальное выявление пупочно-портально-системных венозных шунтов
На пренатальном этапе возможно выявить множественные аномальные варианты формирования соединений вены пуповины, портальных, печеночных, нижней полой вен и венозного протока, объединенные в понятие «пупочно-портально-системные венозные шунты» [28, 30].
На настоящий момент наиболее часто применяется классификация шунтов, предложенная и детально описанная Achiron R. et al. (2016) [28], выделяющая 4 основные группы аномальных анастомозов со следующими характеристиками.
Тип 1. Агенезия (полное отсутствие) венозного протока с дренированием пупочной вены непосредственно в правое предсердие либо системные (подвздошные) вены. Частота живорождения при данном типе патологии составляет 33% за счет аномального усиления преднагрузки на сердце, вызывающего антенатальное развитие сердечной недостаточности у плода. Кроме того, в сочетании с подобными типами шунтов в 67% случаев отмечаются аномалии внутрипеченочной портальной венозной системы, прочие структурные мальформации и задержка роста более чем у половины плодов.
Тип 2. Венозный проток – системные шунты, при которых присутствует аномальный, укороченный венозный проток с дренированием либо в нижнюю полую вену на уровне ниже нормального – в ее среднюю треть, либо в печеночную вену. У плодов данной группы внутрипеченочная портальная венозная система развита правильно, однако частота анеуплоидий превышает 20%.
Тип 3. Внутрипеченочные порто-системные шунты с дренированием внутрипеченочных ветвей портальных вен в печеночные вены и отсутствием венозного протока в 25% случаев. Сочетанные аномалии выявляются у 42% плодов, задержка роста и отклонения биохимических параметров функции печени от нормы отмечаются у половины детей после рождения [28–32].
Тип 4. Внепеченочные порто-системные шунты с соединением главной воротной вены либо ее корней (селезеночной, брыжеечных вен) с системными венами и отсутствием венозного протока в 75% случаев. В половине таких случаев отмечается полное отсутствие внутрипеченочной портальной венозной системы. У всех новорожденных выявляется аномалия функции печени [28–32].
Точная пренатальная диагностика типов аномалий развития венозной системы печени плода с определением прогноза для жизни и здоровья будущего ребенка должна проводиться исключительно специалистами со значительным опытом работы в данной области. Однако каждый врач пренатальной ультразвуковой диагностики, проводящий исследование плода, а также акушер-гинеколог или генетик, консультирующие беременную по представленному заключению, должны помнить, что в случае отсутствия нормального венозного протока возможно рождение живого и здорового ребенка, но при этом существует повышенный риск наличия сочетанных структурных и генетических патологий, задержки роста и антенатальной декомпенсации состояния плода, требующий индивидуального плана обследования и ведения данной пациентки [31, 32].
Ультразвуковая допплерографическая оценка кривой скорости кровотока в венозном протоке
Оценка кривой скорости кровотока в венозном протоке, отражающей изменение давления в полостях сердца и коррелирующей с функциональными параметрами сердечно-сосудистой системы, позволяет выявить случаи повышенного риска широкого спектра различных патологических состояний плода. При проведении ультразвуковой допплерографии во избежание диагностических ошибок необходимо строгое соблюдение методики исследования, принимая во внимание небольшие размеры венозного протока и расположение печеночных вен в непосредственной близости от него [33–36].
При проведении ультразвукового исследования в сроки раннего пренатального скрининга I триместра беременности оценка кровотока в венозном протоке проводится в средне-сагиттальном срезе туловища плода с обязательным увеличением, при котором грудь и живот плода занимают более 75% изображения. Выбор контрольного объема, равного 0,5–1 мм [35].
Исследование кровотока в венозном протоке во II и III триместрах беременности рекомендуется проводить в его перешейке в непосредственной близости от места отхождения венозного протока от портального синуса в средне-сагиттальном либо поперечном срезе живота плода (рис. 3). Перешеек идентифицируется с помощью цветной допплерографии по высокой скорости кровотока или наличию aliasing-эффекта. Использование высокоскоростной цветной допплеровской шкалы выше 48 см/с помогает отличить венозный проток от соседних венозных сосудов с более медленным кровотоком.
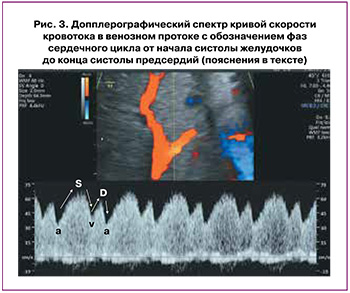
Контрольный объем импульсно-волнового допплера величиной 2 мм размещается в области перешейка с наименьшим возможным углом инсонации.
При установке контрольного объема >2 мм увеличивается риск контаминации полученной кривой скорости кровотока таковыми из рядом расположенных сосудов.
При соблюдении требуемых критериев корректно полученная нормальная кривая (рис. 3) будет иметь пиковые систолические скорости (S) 48–71 см/с и пиковые диастолические скорости (D) 31–58 см/с в зависимости от гестационного возраста; однако нужно помнить, что около 3% здоровых плодов могут иметь кривую скорости кровотока венозного протока с очень небольшой пульсацией или даже без нее (монофазный тип) [37].
Оценка кривой скорости кровотока в венозном протоке
После получения корректного изображения кривой скорости кровотока для проведения ее анализа необходимо определить фазы сердечного цикла от начала систолы желудочков до конца систолы предсердий, учитывая, что S-волна и v-волна возникают во время систолы желудочков, D-волна и а-волна – во время диастолы желудочков (рис. 3) [33, 34].
Далее возможно проведение как качественной оценки кривой скорости кровотока: определение факта наличия положительной, нулевой или реверсной (обратной) а-волны, так и количественной и полуколичественной оценки абсолютных скоростей кровотоков и угол-независимых допплеровских индексов.
При количественной оценке проводятся измерения пиковой скорости систолы желудочков (S-волна), конца систолы желудочков (v-волна), желудочковой диастолы (D-волна), систолы предсердий (а-волна) и усредненной по времени максимальной скорости (ТАМХ), которая является результатом усреднения скоростных составляющих огибающей допплеровский спектр (рис. 4) [33, 34].
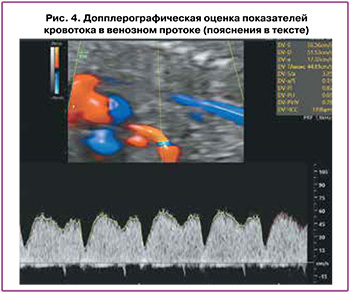
Для оценки кровотока в венозном протоке может применяться ряд допплеровских индексов, из числа которых наиболее широко в клинике используется индекс пульсации вен (PIV), рассчитывающийся по формуле: PIV=(Vs–Va)/TAMX, где Vs – пиковая скорость антеградного (прямого) потока во время систолы желудочков («S-волна»), а Va – самая низкая скорость антеградного (прямого) потока или максимальная скорость ретроградного (обратного) потока во время сокращения предсердий («а-волна») [38].
Патологическими считаются значения PIV более 95-го процентиля для гестационного срока [39–41].
Также могут быть рассчитаны и проанализированы: индекс пиковой скорости для вен (PVIV), который рассчитывается по формуле: PVIV=(Vs–Va)/Vd, где Vd – пиковая скорость антеградного (прямого) потока во время сокращения предсердий (диастолы) («D-волна»); индекс преднагрузки (PLI), определяемый как PLI=(Vs–Va)/Vs, и S/a отношение [33, 39, 40].
Причины патологических изменений кривой скорости кровотока в венозном протоке
При выявлении аномальных кривых скорости кровотока в венозном протоке необходимо проведение поиска вызывающих их причин. Объемы и давление в камерах сердца определяются постнагрузкой сердца, сократительной способностью и растяжимостью сердечной мышцы, а также давлением, оказываемым объемом крови, обычно называемым преднагрузкой. Соответственно, основные патологические состояния, вызывающие изменения кривой скорости кровотока венозного протока, могут быть разделены на три группы.
К первой относятся факторы, повышающие преднагрузку: увеличение венозного возврата и пороки развития трехстворчатого клапана, вызывающие его недостаточность, такие как дисплазия и аномалия Эбштейна [42].
Вторая группа факторов связана с нарушением сократительной и расслабляющей способностей самого миокарда: его диастолическая и/или систолическая дисфункция, фетальные аритмии, кардиомиопатии, опухоли сердца [42].
Третья группа факторов повышает постнагрузку на сердце плода, что отмечается при обструктивных пороках развития клапанов и сосудов: аортальном или легочном стенозе/атрезии, коарктации аорты, сужениях артериального протока. Также постнагрузка возрастает при увеличении резистентности кровотоку в сосудах плаценты – развитии плацентарной дисфункции [42].
В некоторых случаях данные состояния могут сосуществовать; например, при прогрессирующем ухудшении состояния плода с задержкой роста и аномалией Эбштейна, когда имеет место сочетание повышенной преднагрузки – вследствие наличия порока сердца, постнагрузки – из-за высокого сопротивления сосудистого русла плаценты, а также снижения сократительной способности сердца из-за плохой оксигенации миокарда.
Для определения конкретных факторов, влияющих на аномальную форму волны, необходима комплексная оценка размеров плода, маточно-плацентарного, фето-плацентарного и плодового кровотоков, оценка путей притока и оттока сердца, а также исследование функции миокарда [42].
Клиническое применение допплерографической оценки кровотока в венозном протоке в I триместре беременности
Учет результата оценки кровотока в венозном протоке при расчете рисков хромосомных аномалий плода увеличивает чувствительность и специфичность раннего комбинированного скрининга. При этом следует отдавать предпочтение количественной оценке индекса пульсации для вен (PIV), нежели качественной оценке расположения предсердной а-волны относительно базальной линии. Масштабные исследования Wagner P. et al. (2017) у более 5 тыс. плодов в I триместре подтвердили результаты ранее опубликованных работ о важности данного скринингового маркера и продемонстрировали, что отрицательная а-волна в венозном протоке выявляется у 2,3% эуплоидных плодов и у 66,1% плодов с трисомией 21 хромосомы, в то время как повышение PIV более 95-го процентиля отмечается в 8,3 и 77,2% случаев соответственно [35, 36, 43–45].
Соответственно, введение показателя PIV в программно-аппаратные комплексы, вычисляющие вероятность хромосомных аномалий у плода, может значимо повысить эффективность раннего скрининга.
Корреляция кривой скорости кровотока в венозном протоке с гемодинамическими изменениями в сердце при патологии сердечных структур позволяет использовать венозный проток в качестве маркера врожденных пороков сердца плода уже в I триместре беременности, улучшая эффективность скрининга в сравнении с практикой оценки только показателя толщины воротникового пространства.
К примеру, на популяции более 40 тыс. плодов было установлено, что качественная оценка кривой скорости кровотока в венозном протоке на наличие реверсной а-волны позволяет выявить таковую у 28,2% плодов с пороками сердца и 2,1% плодов без пороков сердца. Проведение ранней расширенной эхокардиографии у плодов с подобными нарушениями позволяет вне зависимости от величины толщины воротникового пространства уже в I триместре диагностировать 38% случаев аномалий сердечных структур [46].
Еще более значимое увеличение ранней выявляемости пороков сердца у плода может быть достигнуто при измерении допплерографических индексов. Wagner P. et al. (2019) было установлено, что при кардиальной патологии плода в 54,2% случаев отмечено повышение пульсационного индекса для вен PIV в венозном протоке более 95-го процентиля. Соответственно, ранняя эхокардиография в случаях патологического увеличения данного показателя позволяет выявить более половины случаев врожденных пороков сердца [47, 48].
В случаях многоплодной беременности с монохориальным типом плацентации аномальный кровоток в венозном протоке увеличивает не только риски наличия синдромальной и кардиальной патологии у плодов, но и риски последующего развития фето-фетального трансфузионного синдрома [49, 50].
Более того, по аналогии со второй половиной беременности, уже в I триместре продемонстрировано повышение резистентности кровотоку в венозном протоке, увеличивающее риски неблагоприятных исходов беременности: невынашивания и антенатальной гибели плода, что еще раз отражает необходимость дополнительного ультразвукового и допплерографического контроля за ростом и функциональным состоянием плода в данных случаях [51, 52].
Клиническое применение допплерографической оценки кровотока в венозном протоке во II и III триместрах беременности
Наиболее часто оценка кровотока в венозном протоке проводится во второй половине беременности для предотвращения развития тяжелых гипоксических поражений головного мозга и антенатальной гибели плодов с задержкой роста и выраженными гемодинамическими нарушениями в артериях пуповины на сроках до 34 недель гестации. Пролонгирование беременности в таких случаях направлено на снижение ассоциированных с недоношенностью показателей заболеваемости и смертности у детей [53–57].
В соответствии с действующими на момент публикации Клиническими рекомендациями Министерства здравоохранения Российской Федерации «Недостаточный рост плода, требующий предоставления медицинской помощи матери (задержка роста плода)» (2022) оценка кровотока в венозном протоке при одноплодной беременности проводится с момента выявления нулевого или реверсного диастолического кровотока в артериях пуповины каждые 24–48 ч при наличии положительной а-волны и каждые 24 ч в случаях нулевой или реверсной а-волны.
Наблюдение проводится в стационарных условиях с обязательной профилактикой респираторного дистресс-синдрома новорожденных до момента родоразрешения. К показаниям для родоразрешения со стороны плода на сроках 26–30 недель беременности относят реверсную а-волну в венозном протоке. При наличии положительной а-волны в венозном протоке показаниями для родоразрешения будут являться: реверсный диастолический кровоток в артериях пуповины на сроках 30–32 недели беременности, нулевой диастолический кровоток в артериях пуповины на сроках 32–34 недели беременности.
При наличии положительного диастолического кровотока в артериях пуповины оценка кровотока в венозном протоке для контроля за состоянием плода с задержкой роста не показана [58].
Для случаев многоплодия проведение оценки кровотока в венозном протоке регламентировано Клиническими рекомендациями Министерства здравоохранения Российской Федерации «Многоплодная беременность» (2021) при развитии осложнений с высоким риском перинатальной гибели плода, таких как селективная задержка роста плода при выраженных нарушениях кровотока в артериях пуповины; 3–4 стадии фето-фетального трансфузионного синдрома и синдрома анемии-полицитемии; синдром обратной артериальной перфузии с признаками декомпенсации состояния у плода-помпы [59, 60].
Помимо плацентарной дисфункции, оценка кровотока в венозном протоке проводится в случаях высокого риска развития сердечной недостаточности у плода, к которым относятся, к примеру, экстракардиальные патологии, связанные со значимым увеличением преднагрузки – венозного притока к сердцу: крестцово-копчиковые тератомы, сосудистые мальформации плода или плаценты, а также водянка плода различной этиологии, диабетическая фетопатия, фетальные анемии и аритмии [61–68].
В подобных наблюдениях анализ кривой скорости кровотока является частью расчета так называемого кардиоваскулярного профиля плода, включающего также кардио-торакальный индекс, характер диастолического кровотока в артериях пуповины и допплер-эхокардиографические параметры сердечной функции [68, 69].
Вне зависимости от этиологического фактора, негативно воздействующего на плод, наличие реверсной а-волны в венозном протоке свидетельствует о выраженных нарушениях компенсаторных функций плода, высоком риске развития ацидоза и антенатальной гибели, что требует незамедлительного обсуждения дальнейшей акушерской тактики с семейной парой.
Исключения составляют наблюдения, при которых аномальная кривая скорости кровотока в венозном протоке связана с повышением давления в правом предсердии при пороках сердца с обструктивным поражением правых отделов и интактной межжелудочковой перегородкой. Подобные варианты не являются показанием к родоразрешению, что также необходимо помнить наблюдающим беременных специалистам [70].
Постнатальная патология венозного протока
Спонтанное закрытие венозного протока, обусловленное изменением внутрисердечного давления и снижением уровня эндогенных простагландинов, в норме начинается сразу после рождения; при этом его полное функциональное закрытие обычно наблюдается к 18-дневному возрасту [71, 72].
Открытый после рождения венозный проток – чрезвычайно редкая форма врожденного порто-системного шунта, встречающаяся чаще у детей с кардиальной патологией, сопровождающейся повышением давления в правых отделах сердца, и получающих комплексную терапию с применением препарата простагландина E1.
Сохранение кровотока в венозном протоке приводит к отведению портальной крови в большой круг кровообращения, минуя печень, что клинически может выражаться в нарушениях ее функции с изменениями коагуляции и тромбозами, гипербилирубинемией, галактоземией, гипоксемией, гипераммониемией, приводящих к энцефалопатии. Неспецифичность и разнообразие клинических симптомов и недостаточная врачебная осведомленность о данной патологии могут приводить к диагностическим ошибкам, либо запоздалой постановке диагноза. В таких случаях спонтанное закрытие постнатально функционирующего венозного протока происходит редко; хирургическое вмешательство или катетеризация требуются чаще, чем при прочих видах внутрипеченочных шунтов. Необходима максимально ранняя верификация данного осложнения, визуальную основу которой также представляет ультразвуковая диагностика. В этой связи врачам ультразвуковой диагностики в неонатологии так же, как и специалистам медицины плода, необходимо помнить о возможных аномалиях венозного протока, которые могут встретиться в их клинической практике [73–75].
Заключение
Венозный проток – уникальный сосудистый шунт, необходимый для нормального антенатального развития человека, связывающий в единую систему пупочную вену, доставляющую кровь от плаценты, две важнейшие венозные системы: портальные и нижнюю полую вену, дренирующуюся в сердце и обеспечивающую за счет наличия у плода евстахиевой заслонки и овального окна поступление максимального количества кислорода и питательных веществ к активно развивающимся миокарду и головного мозгу.
Аномальное формирование пупочно-портально-системной коммуникации и нарушение кровотока в венозном протоке ассоциированы со значительными рисками наличия генетической и структурной патологии плода, последующего замедления его роста и антенатальной гибели.
Осведомленность медицинских специалистов о современных возможностях ультразвуковой диагностики патологий венозного протока, принципах и методических подходах к проведению исследований и их использование в практической деятельности позволят уже с I триместра беременности повысить эффективность выявления пациенток группы высокого риска широкого спектра осложнений, снизить показатели перинатальной и детской заболеваемости и смертности.



