В эпоху XXI в. наметилась долгожданная смена парадигмы в плане повторного абдоминального родоразрешения у пациенток с рубцом на матке. Это связано с практически двукратным ростом частоты кесарева сечения с 250,7 тыс. в 2005 г. до 422,5 тыс. в 2020 г. и, как результат, с ростом частоты гнойно-септических осложнений и разрывов матки. В структуре показаний для повторного кесарева сечения рубец миометрия занимает первое место. В этой связи назрела настойчивая необходимость в поиске новых методов повышения эффективности репарации миометрия после перенесенной операции, чтобы спустя 2–3 года интергенетического интервала женщины могли родить самопроизвольно. Для повышения регенерации тканей в клинической медицине на протяжении 15 лет с успехом используются клеточные технологии [1–3]. Тем не менее, существуют определенные трудности для их широкого внедрения [4–7]. Среди многообразия уникальных механизмов действия стволовых клеток заслуживает самого пристального внимания их способность взаимодействия и обмена, как белковым, так и генетическим материалом посредством секреции микровезикул. Эти межклеточные коммуникаторы перспективны в плане улучшения репарации тканей, поскольку они могут участвовать в передаче межклеточной информации и работать в качестве модулятора [8–13].
Основываясь на выше изложенном, мы полагаем, что использование экстрацеллюлярных микровезикул (ЭМВ) улучшает течение послеоперационного периода и повышает шансы для дальнейшего самопроизвольного родоразрешения пациенток с рубцом на матке после кесарева сечения. Данный оптимизм основан на проведенных экспериментальных исследованиях, в ходе которых была создана модель кесарева сечения у лабораторных крыс инбредной линии Wag. Уже 4 года назад была убедительно продемонстрирована способность экзосом находиться в миометрии, как интактных животных, так и после произведенного кесарева сечения не менее 8 суток [14–18].
Цель исследования: оценить течение послеоперационного периода у пациенток, которым в ходе предшествующего кесарева сечения вводились ЭМВ мезенхимальных стромальных клеток (МСК) плацентарного происхождения и результаты их повторного родоразрешения.
Материалы и методы
Обследованы и родоразрешены 160 пациенток. В зависимости от ведения послеоперационного периода все они были разделены на 2 группы: 1-я группа (основная) – 60 беременных и рожениц, которым в ходе кесарева сечения после ушивания матки однорядным непрерывным викриловым швом в область разреза вводилось 500 мкл ЭМВ МСК, полученных в лаборатории клеточных технологий ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. В.И. Кулакова» (НМИЦ АГП им. В.И. Кулакова) [14, 15, 19]. 2-я группа (контрольная) – 100 беременных и рожениц, которым в ходе кесарева сечения проводилось традиционное ушивание нижнего сегмента матки однорядным непрерывным викриловым швом.
В зависимости от тактики родоразрешения беременные основной и контрольной групп были дополнительно разделены на подгруппы: a – роды per vias naturalis и b – повторное кесарево сечение. Все пациенты подписали информированное согласие на введение экзосом.
Получение культуры МСК
Материал пуповины человека был получен после родов здоровых женщин в возрасте от 25 до 30 лет, которые родили здоровых доношенных детей путем кесарева сечения в НМИЦ АГП им. В.И. Кулакова. Образцы пуповин, полученных после рождения, промывали в фосфатно-солевом буферном физиологическом растворе (ФСБ) («ПанЭко», Москва, Россия) несколько раз. После удаления кровеносных сосудов ткань пуповины измельчали на фрагменты размером 1–2 мм3. Клетки выращивали в полной питательной среде (ППС) состоящей из культуральной среды DMEM/F12 («БИОЛОТ», Москва, Россия) (1:1), 7% фетальной бычьей сыворотки (HyClone, Cytiva, Австрия) с добавлением пенициллина (100 ЕД/мл), стрептомицина (100 мкг/мл) (Gibco, Нью-Йорк, США) и 2 мм L-глутамина («ПанЭко», Москва, Россия) и инкубировали во влажной атмосфере с 5% СО2 при 37°С. Питательную среду заменяли раз в 3–4 дня. Эту же среду использовали для получения ЭМВ, продуцируемых МСК. Для этого ее предварительно центрифугировали (108 000×g в течение 1,5 ч при 4°C) с целью очищения от ЭМВ содержащихся в фетальной бычьей сыворотке. Центрифугированную среду добавляли к МСК на 3-м пассаже, достигшем конфлюэнтности 80–90% и отбирали через 24 ч. Рост и морфологию клеток контролировали ежедневно под инвертированным световым микроскопом. По достижении 80% конфлюэнтности, клетки трипсинизировали, центрифугировали (1600×g в течение 3 мин.), ресуспендировали в ППС и пересаживали на новые культуральные флаконы. МСК, использованные в работе, были положительными для маркеров МСК (CD73 – 98%, CD90 – 100%, CD105 – 100%) и содержали небольшую примесь гемопоэтических клеток (около 4,6% CD14, CD20, CD45, CD34).
Получение ЭМВ из кондиционной среды
Для выделения ЭМВ из кондиционированной среды использовали метод дифференциального центрифугирования [19]. Собранную через 24 ч после добавления среду, подвергали последовательным центрифугированиям для удаления мертвых клеток и дебриса (400×g в течение 10 мин. и 10000×g при 4°C в течение 30 мин.). Полученный суперанатант использовали для выделения ЭМВ с помощью ультрацентрифугирования при 108000×g в течение 1,5 ч при 4°C на высокоскоростной центрифуге Avanti JXN-30 (Beckman Coulter Inc., США) с последующей промывкой осадка ЭМВ в ФСБ и повторным центрифугированием в аналогичных условиях. Окончательный осадок ЭМВ ресуспендировали в 500 мкл ФСБ. Образцы везикул хранили при -80°С.
Количественный и качественный анализ ЭМВ
Характеристику ЭМВ проводили методом анализа траектории наночастиц в жидкости (NTA). Для этого применяли систему NTA LM10, оснащенную синим лазером (405 нм, 60 МВт, технология NanoSight, Лондон, Великобритания) и CMOS-камерой (Hamamatsu Photonics K.K., город Хамамацу, Япония). Каждый образец ЭМВ разбавляли 10000 раз ФСБ для достижения оптимального линейного диапазона измерений прибора (12–22 частицы/кадр). Съемку проводили в 12 повторностях по 1 минуте на каждую при скорости 30 кадров в секунду. Для анализа концентрации и распределения по размерам использовалось программное обеспечение NTA 2.3 со следующими настройками обработки видеоизображений: калибровка – 166 нм/пиксель; размытие – автоматическое; порог обнаружения – 8, минимальная длина дорожки – автоматическая, минимальный ожидаемый размер частиц – 30 нм, температура – 24,7°C, вязкость – 0,90 cp. Калибровка (по размеру и флуоресценции) проводилась с использованием стандартов производителя (Malvern Panalytical, Великобритания). NTA анализ показал, что была получена популяция ЭМВ, состоящая преимущественно из экзосом (40–150 нм) с примесью микровезикул со средним размером наночастиц 124,2±6,67 нм и концентрацией 4,1×1010 частиц/мл. При этом наибольшая доля микрочастиц (более 54%) в популяции ЭМВ распределилась в диапазоне от 60–160 нм.
Патоморфологическое исследование
У 19/28 (67,8%) пациенток проведено патоморфологическое исследование биоптатов иссеченных рубцов и участков нижнего сегмента матки. Все пациенты подписали информированное согласие на получение биопсийного материала. Материал фиксировали в 4% растворе параформальдегида на фосфатном буфере (рН 7,4) не менее 24 ч, обезвоживали в серии этанола возрастающей концентрации, просветляли в ксилоле и заключали в парафин. Срезы толщиной 5 мкм окрашивали гематоксилином и эозином, по Ван-Гизону и по Романовскому [20] и изучали на световом микроскопе Triton (Seti, Бельгия). Морфометрическое исследование структуры различных отделов рубца на матке пациенток проводили в соответствии с рекомендациями, посвященными теоретическому обоснованию и конкретным примерам применения этих методов [21].
Статистический анализ
Для статистической обработки данных использовали электронные таблицы Microsoft Excel и пакет программ GraphPad Prism 6 (GraphPad Software, USA). При описании количественных данных, имеющих нормальное распределение, использовали среднее арифметическое (M) и стандартное отклонение (SD). При анализе параметрических данных рассчитывали среднее значение и среднеквадратичное отклонение. Различия считали значимыми при p<0,05.
Результаты
Первое в мировой акушерской практике интраоперационное введение ЭМВ МСК плацентарного происхождения было осуществлено 14 ноября 2019 г. Этому событию предшествовало получение положительного решения локального этического комитета ГБУЗ НСО «Новосибирский городской клинический перинатальный центр» и добровольного информированного согласия пациентки К., 24 лет (история родов № 5894). Все 60 пациенток, включенных в исследование, которым проводилась интраоперационная экзосомная поддержка, имели желание через 2–3 года родить повторно и самопроизвольно.

Возраст (в годах) беременных и рожениц представлен в таблице 1. Как видно из представленной таблицы, пациентки были молодыми – в основной группе 27,25 (4,13) лет, в контрольной – 26,28 (3,64) лет, и возраст в группах сравнения значимо не различался (р=0,12).
Клинико-демографические характеристики участниц исследования представлены в таблице 2.
Что касается соматической патологии, то у беременных и рожениц из групп сравнения не было обнаружено достоверно значимых отличий. Практически каждая вторая страдала хроническим тонзиллитом (от 51 до 56,6%). Более чем у 40% диагностировано хроническое воспаление почек, у 19% – бронхов, и у каждой шестой (16%) – ожирение. Практически половина беременных (от 45 до 48,3%), родоразрешенных путем кесарева сечении, не работали и занимались домашним хозяйством.
При анализе исходов предыдущих беременностей у пациенток групп сравнения заслуживает внимания и настораживает, что каждая четвертая пациентка – 15/60 (25%) из группы с экзосомной поддержкой и 23/100 (23%) – из контрольной группы, имели в анамнезе прерывание беременности путем артифициального аборта по желанию, что в последующем могло провоцировать самопроизвольное прерывание беременности у 11/60 (18,3%) и 17/100 (17%) женщин из основной и контрольной групп, соответственно.
Из анамнеза генитальной патологии и при объективном исследовании была выявлена высокая частота перенесенных инфекционно-воспалительных заболеваний женских половых органов, что могло спровоцировать бесплодие, на которое предъявляла жалобы практически каждая восьмая беременная из основной – 8/60 (13,3%) и каждая десятая – 10/100 (10%) из контрольной группы.
Возраст менархе у обследованных и родоразрешенных пациенток был практически среднестатистическим для женщин нашей страны и составил в группе пациенток с экзосомной поддержкой 12,9 (1,7) лет, а в контрольной группе – 12,81 (1,76) лет (табл. 3), значимо не отличаясь друг от друга (p=0,75).
Таким образом, выполненный анализ клинического материала беременных и рожениц не выявил значимых различий в группах сравнения.
В основной группе первое предшествующее плановое абдоминальное родоразрешение было произведено 26/60 (43,3%) беременным (табл. 4).
В структуре плановых кесаревых сечений преобладали пациентки с полным (смешанным) ягодичным предлежанием – 21/26 (80,8%). Также 5/26 (19,2%) пациенткам с экзосомной поддержкой, которые в анамнезе имели 2 артифициальных аборта, первое кесарево сечение было произведено в связи с краевым предлежанием плаценты (табл. 4). У 34/60 (56,7%) рожениц основной группы было родоразрешение в экстренном порядке, и им в ходе предшествующего кесарева сечения было интраоперационно введено 500 мкл ЭМВ МСК плацентарного происхождения. Практически каждая третья роженица основной группы – 18/60 (30%) была прооперирована по поводу острого дистресса плода, каждая четвертая – 14/60 (23,3%) – по поводу слабости родовой деятельности, неподдающейся медикаментозной коррекции и 2/60 (3,3%) роженицы – из-за выпадения петель пуповины. Структура показаний для первого абдоминального родоразрешения у пациенток контрольной группы достоверно значимо не отличалась.
У всех женщин кесарево сечение выполнялось в условиях эпидуральной анестезии с проведением однократной интраоперационной антибактериальной профилактики. Среди пациенток из группы сравнения не выявлено значимых различий, ни по времени оперативного вмешательства (34,8 (3,76) мин., в основной группе – 34,6 (4,66) мин., p=0,77), ни по объему интраоперационной кровопотери (586,9 (77,6) мл, в основной группе – 610,0 (87,7) мл, p=0,08), ни по продолжительности первого периода родов (9,01 (1,43) ч, в основной группе – 9,29 (2,55) ч, p=0,52), который был подсчитан у 34 рожениц основной и 53 пациенток контрольной групп, прооперированных в экстренном порядке (табл. 5).
При этом в ходе проведенного сравнительного анализа были выявлены достоверные отличия между родильницами основной и контрольной групп по продолжительности безводного промежутка (8,75 (1,82) ч в группе с экзосомной поддержкой, что значимо больше чем в контрольной группе – 7,87 (1,45) ч, p=0,02). Значимые различия были зарегистрированы и по продолжительности послеоперационного койко-дня, который у пациенток с экзосомной поддержкой был значительно меньше, чем у родильниц контрольной группы (4,35 (0,51) против 5,15 (1,64), р=0,03). На наш взгляд, это могло быть связано с замедленной инволюцией матки у пациенток контрольной группы. У родильниц без экзосомной поддержки расширение полости матки было значимо больше, по сравнению с родильницами из основной группы (19,4 (0,47) мм и 16,59 (0,36) мм, соответственно, p=0,006). Подобная динамика прослеживалась и по числу лейкоцитов при выписке, которое в группе с интраоперационным введением экзосом составило 10,9 (1,79)×109/л, и их количество было достоверно меньше, чем в группе сравнения – 13,1 (1,19)×109/л, р=0,03). У пациенток основной группы, несмотря на достоверно больший безводный промежуток, не было послеродовых инфекционно-воспалительных осложнений, тогда как у 8/100 (8%) родильниц без введения экзосом было зафиксировано осложненное течения послеродового периода – в 6 /100 (6%) случаях был диагностирован эндометрит и в 2/100 (2%) случаях – лохиометра.
Поскольку женщины групп сравнения планировали повторные беременности, у 50 пациенток с предшествующей экзосомной поддержкой и у 40 пациенток с традиционным ведением послеродового периода проведена магнитно-резонансная томография (МРТ) через 6 месяцев после предыдущего кесарева сечения. У пациенток, которым в ходе первого кесарева сечения вводились ЭМВ МСК плацентарного происхождения признаков неполноценности рубца и «ниши» не обнаружено – толщина миометрия в области рубца составила 8,14 (1,04)мм, тогда как в группе контроля – 6,7 (2,09) мм (p<0,001). При этом, у 6/40 (15%) женщин из группы контроля, которые перенесли послеродовый метроэндометрит, имело место истончение послеоперационного рубца менее 2 мм с формированием «ниши» на протяжении 4–6 мм (табл. 6).

Для объективизации состояния послеоперационного рубца на матке 45 пациенткам основной группы и 30 женщинам контрольной группы проведено ультразвуковое исследование (УЗИ) и офисная гистероскопия через 6–12 месяцев после предшествующего кесарева сечения. По данным УЗИ, еще на этапе предгравидарной подготовки абсолютно гомогенный миометрий, не имеющий плотных включений и по виду не отличающийся от остальных стенок матки был выявлен у 39/45 (86,7%), т.е у подавляющего большинства пациенток основной группы (табл. 6). Толщина миометрия в области рубца у этой когорты женщин составила 7,86 (0,91) мм, что оказалось значимо больше показателей из группы контроля – 6,9 (1,02) мм, p<0,001). При этом в контрольной группе практически у каждой четвертой пациентки – 7/30 (23,3%) визуализировались крупные уплотнения в сочетании с эхо-негативностью окружающей ткани, более крупные эхо-негативные включения в области рубца и в окружающей ткани, а также между маткой и мочевым пузырем с локальным истончением рубца.
При гистероскопии в основной группе был выявлен внутренний эндометриоз у 4/45 (8,9%) женщин; других признаков внутриматочной патологии не было: область рубца на матке по своему строению не отличалась от других отделов, имело место наличие небольшого количества соединительно-тканных волокон со слабо выраженной сосудистой сетью в этих участках. В контрольной группе у 8/30 (26,6%) женщин были визуализированы признаки неполноценности: выпрямление рубца, образование углов и асимметрии, наличие углублений и выбуханий, вдавление по ходу части или всего рубца и изменение окраски над рубцом, вплоть до белого цвета.
С 2019 г. у 8 женщин, которым в ходе первого кесарева сечения вводились ЭМВ МСК плацентарного происхождения, и у 20 пациенток из группы сравнения возникли желанные беременности в естественном цикле, которые в обеих группах сравнения протекали без осложнений. Каждая вторая – 4/8 (50%) пациентка с рубцом на матке из основной группы поступила на роды со спонтанным развитием родовой деятельности. В контрольной группе регулярная родовая деятельность наблюдалась у 12/20 (60%) беременных. Остальные 12/28 (42,8%) беременных из групп сравнения были госпитализированы для подготовки к родам в плановом порядке при сроке беременности 40 недель и родоразрешены в Новосибирском городском клиническом перинатальном центре. Их возрастная характеристика и гестационный срок были сопоставимы и значимо не различались (табл. 7).
Единственным показанием к преиндукции родов была тенденция к перенашиванию беременности. Данное состояние встречалось у 4/8 (50%) беременных основной группы и у 8/20 (40%) пациенток группы сравнения. Этим 12/28 (42,8%) пациенткам с рубцом на матке после кесарева сечения проводилась преиндукция родов при помощи баллона для ускорения созревания шейки матки, что не противоречит Клиническим рекомендациям МЗ РФ «Роды одноплодные, родоразрешение путем кесарева сечения» [22].
Таким образом, на момент написания статьи родоразрешено 28 беременных с рубцом на матке. У 5/8 (62,5%) пациенток, которым в ходе предшествующего абдоминального родоразрешения вводились ЭМВ МСК плацентарного происхождения, роды благополучно завершились через естественные родовые пути. В то же время 16/20 (80%) беременных и рожениц контрольной группы были повторно прооперированы. Показания для повторного абдоминального родоразрешения представлены в таблице 8.
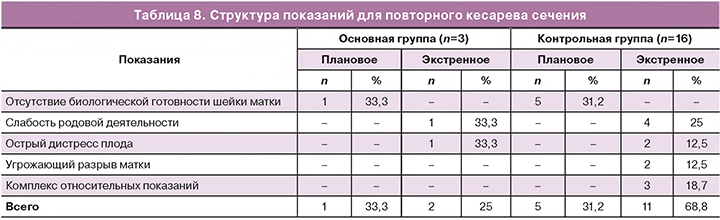
Поскольку 19/28 (67,8%) пациенткам не удалось избежать повторного абдоминального родоразрешения, всем этим родильницам проведено патоморфологическое исследование биоптатов иссеченных рубцов и участков нижнего сегмента матки. Ткани нижнего сегмента матки, фрагменты которого были получены при иссечении рубца после экзосомной поддержки, характеризовалась полнокровием. На некоторых участках миометрия присутствовали небольшие, разные по сроку возникновения, кровоизлияния. Сосуды в миометрии были расширены незначительно, но на некоторых участках наблюдали расширение лимфатических сосудов. Содержание соединительной ткани было не выражено, небольшие прослойки этой ткани присутствовали, в основном, по ходу сосудов. Численность тканевых лейкоцитов в миометрии была оценена, как умеренная. Присутствовали лейкоцитарные инфильтраты с преобладанием нейтрофилов и лимфоцитов. Численная плотность тканевых лейкоцитов в рубце достоверно не различалась между родильницами с экзосомной поддержкой и без таковой. Для фрагментов из основной группы было характерно параллельное расположение волокон и единичные геморрагии, расширенные полнокровные сосуды и единичные лимфоциты в тканях рубца миометрия (рис. 1, 3, 5). В то время как у пациенток контрольной группы визуализировалось хаотичное расположение волокон и обширные геморрагии в тканях рубца, а также большое количество сосудов со склерозированными стенками и увеличение численной плотности всех лейкоцитов с большим количеством нейтрофилов и эритроцитов в тканях рубца миометрия (рис. 2, 4, 6).
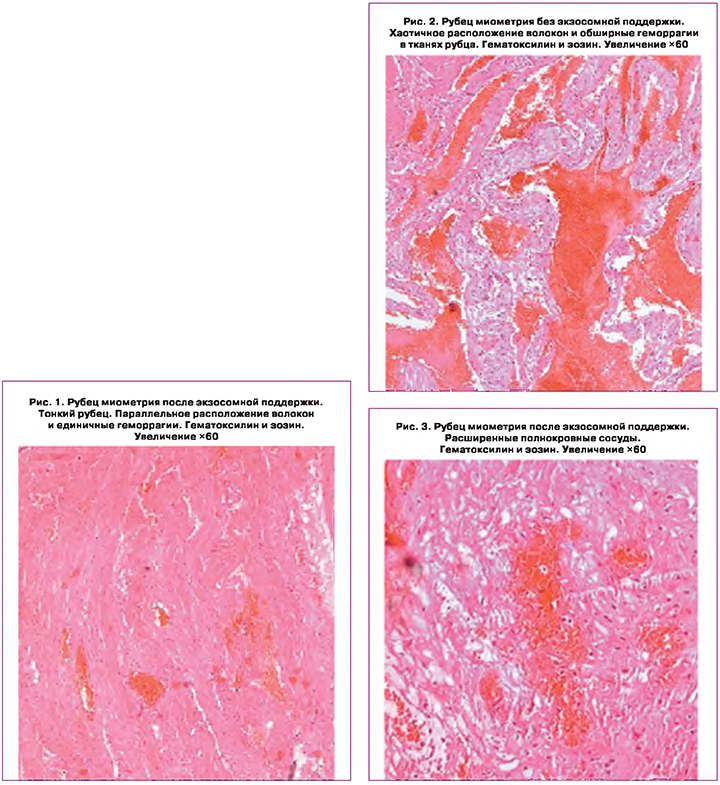
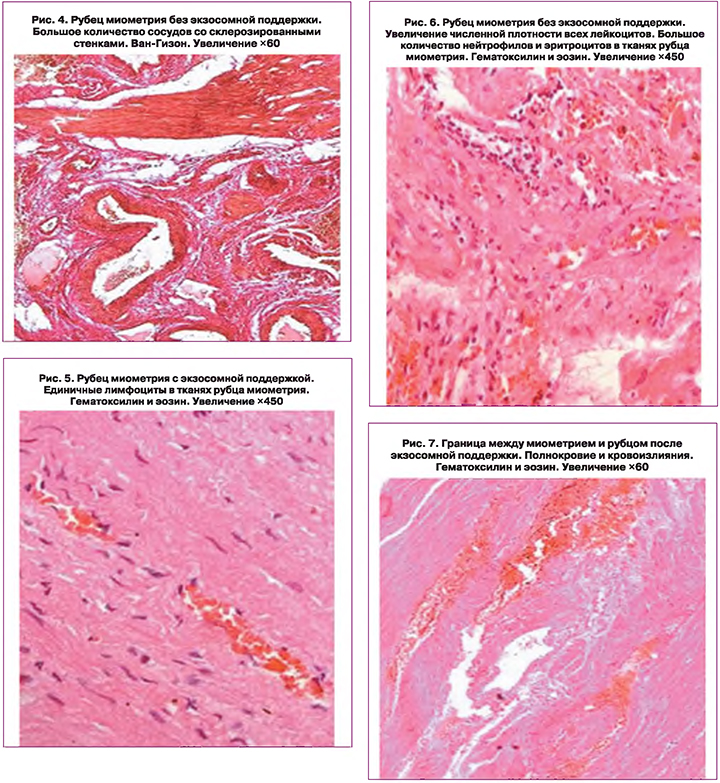
Граница между миометрием и рубцом у пациенток основной группы характеризовалась полнокровием и единичными кровоизлияниями (рис. 7). В отличии от основной группы, на границе рубца матки и миометрия у пациенток контрольной группы отчетливо визуализировался склероз стенки сосудов и резкое расширение самих сосудов, преимущественно в зоне рубца (рис. 8). Как в рубце матки, так и в миометрии родильниц контрольной группы, были обнаружены расширения сосудов и склероз их стенок на границе рубца матки, различные по величине и срокам возникновения кровоизлияния. Кроме того имели место многочисленные разрывы самих сосудов, старые кровоизлияния по ходу границы тканей рубца и миометрия, преимущественно в зоне рубца и по ходу границы разных тканей (рис. 9, 10). В то же время гистологические фрагменты были представлены рубцом, состоящим из хорошо сформированной грубоволокнистой соединительной ткани. Кроме кровоизлияний, на границе рубца на матке были обнаружены различные по размерам кисты, выстланные эндотелием и заполненные прозрачным содержимым. Именно на границе рубца с миометрием прочность тканей была сильно снижена и имела место несостоятельность не самого рубца, а его границы с миометрием. Из-за наличия кровоизлияний и кист на границе рубца на матке и миометрия прочность этих отделов матки у пациенток контрольной группы даже после однократных родов была значительно снижена.

Заключение
Таким образом, полученные данные указывают на более высокую эффективность интраоперационного введения ЭМВ, по сравнению с традиционным ведением послеродового периода. На это указывает отсутствие гнойно-септических осложнений, достоверное повышение толщины рубца по данным МРТ и УЗИ, а также гистологическая картина иссеченных фрагментов нижнего сегмента на границе рубца и миометрия. Пациентки с экзосомной поддержкой в 3 раза чаще рожали самопроизвольно, по сравнению с группой контроля (62,5% и 20%, соответственно).



