Преждевременные роды (ПР) на сегодняшний день являются важной междисциплинарной проблемой, которая требует решения не только для практических акушеров, но и для неонатальных служб [1–3]. Частота ПР в развитых странах варьирует в пределах от 7 до 9%, а в развивающихся – достигает 20%, не имея тенденции к снижению [4–6]. Дети, рожденные преждевременно, имеют тяжелые последствия для здоровья в виде неврологических, метаболических, когнитивных расстройств, что, несомненно, определяет значимость и необходимость поиска причин, а также методов профилактики данного осложнения беременности [7–9].
На сегодняшний день патогенез ПР до конца не изучен, а предрасположенность к их развитию может быть обусловлена различными факторами риска [10–13]. В ряде публикаций в рамках концепции роли асептического воспаления в генезе ПР особое значение придается так называемым факторам, ассоциированным с повреждением клеточных структур (DAMPs) [14–16]. Эффекторное действие последних, обладающих провоспалительным действием, выполняет роль триггера, вызывающего индукцию ПР [17, 18]. Механизм этого явления остается недостаточно изученным, в связи с чем представляет особый интерес изучение корреляционных зависимостей между уровнями DAMPs митохондриального происхождения (мтДНК, мембранные белки) с вероятностью реализации ПР [10, 14, 19]. По данным литературы, к mtDAMPs также относятся: TFAM (митохондриальный фактор транскрипции), OPA1 (мультифункциональный митохондриальный белок), ответственный за слияние митохондрий, и VDAC1 (митохондриальный мембранный канал). Последний является основным каналом митохондриальной наружной мембраны, обеспечивая диффузию АТФ из митохондрий, играет ключевую роль в опосредованном митохондриями апоптозе, а его дисрегуляция приводит к различным патологическим состояниям [1, 4, 9, 15, 18, 20]. В связи с вышеизложенным, перспективным является изучение митохондриальной ДНК (мтДНК) и VDAC1 для уточнения патогенетических механизмов и прогнозирования ПР.
Цель исследования: изучить прогностическую роль определения содержания мтДНК в крови и структурно-функционального белка VDAC1 в плаценте при ПР.
Материалы и методы
Обследованы 142 пациентки. Принимая во внимание различный генез спонтанных ПР (СПР) и ПР с преждевременным разрывом плодных оболочек (ПРПО), женщины были разделены на группы с учетом патогенетических форм [2, 12, 18]. Группу 1 составили 43 беременные со СПР; группу 2 – 47 беременным с ПР и ПРПО. Кроме того, в группу 3 были включены 52 пациентки с угрожающими ПР с последующим родоразрешением при доношенном сроке беременности.
Критериями включения в исследование для основной группы являлись: одноплодная беременность, наступившая в естественном цикле, беременность с 22 до 36,6 недели с ПР, добровольное информированное согласие на участие в исследовании. Критериями невключения для всех групп являлись: абдоминальное родоразрешение, тяжелые экстрагенитальные заболевания, акушерская патология, требующая элективного досрочного родоразрешения, задержка роста и пороки развития плода, многоплодная беременность. Всем пациенткам, включенным в исследование, было выполнено стандартное обследование. Проведено изучение клинико-анамнестических данных, особенностей течения, исходов беременностей, а также изучение состояния плодов и новорожденных.
Наряду со стандартными, в работе применялись следующие методы: определение уровня копийности мтДНК в плазме периферической крови (метод полимеразной цепной реакции в режиме реального времени с обратной транскрипцией); определение содержания структурно-функционального белка VDAC1 в образцах плаценты (метод вестерн-блот).
Статистический анализ
Для статистического анализа данных использовали программу SPSS Statistics 23.0 for Windows. Количественные данные, подчиняющиеся нормальному распределению, были представлены в виде M±SD, где M – среднее значение и SD – среднеквадратическое отклонение. Остальные данные представлены в виде Ме (Q1;Q3), где Me – медиана, (Q1;Q3) – интерквартильный интервал. Для парного сравнения групп использовали непараметрический критерий Манна–Уитни для несвязанных совокупностей. При сравнении долей применяли критерий χ2. Использованы критерий Краскела–Уоллеса и множественное сравнение групп тестом Данна, оценка их прогностической ценности и построение моделей ROC-анализа. Для установления порога отсечения («cut-off») проводился пересмотр значений уровня мтДНК от максимального до минимального значения. Для каждого значения проводилось разделение групп с определением чувствительности и специфичности. Критерием порога отсечения выбрано требование максимальной суммарной чувствительности и специфичности модели. Непосредственная оценка эффективности классификации и качества модели была получена путем расчета AUC с помощью метода трапеций. Нулевая гипотеза отвергалась с учетом поправки на множественность сравнения [9]. Результаты считали статистически значимыми при уровне p<0,05.
Результаты и обсуждение
Все беременные, включенные в исследование, были сопоставимы по клинико-анамнестической характеристике. В группах СПР и ПР с ПРПО превалировали женщины старшего репродуктивного возраста, что подтверждает представления о связи развития ПР с возрастом женщины [1, 11, 14]. Среди заболеваний сердечно-сосудистой, дыхательной, эндокринной, пищеварительной систем, ЛОР-органов статистически значимых различий по группам выявлено не было. При сравнительном анализе заболеваний мочевыделительной системы статистически значимо чаще в группе ПР с ПРПО отмечалось наличие хронического цистита – у 13/47 (27,6%) пациенток (p=0,0051). В структуре гинекологических заболеваний в группе ПР с ПРПО превалировали хронический эндометрит – у 3/47 (6,4%) и сальпингоофорит – у 11/47 (23,4%) пациенток (p<0,05).
В анамнезе пациенток было выявлено статистически значимое увеличение в группах CПР и ПР с ПРПО частоты внутриматочных инструментальных вмешательств – у 6/43 (27,9%) и 17/47 (36,2%) пациенток, а также ПР – у 14/43 (32,6%) и 16/47 (34,0%) по группам соответственно (p<0,01), что свидетельствует о несомненной роли отягощенного акушерско-гинекологического анамнеза в развитии ПР [10, 12, 19]. Клинико-анамнестическая характеристика обследованных беременных представлена в таблице 1.
Принимая во внимание указание многих исследователей [2, 5, 12, 14] на высокую частоту развития ПР на фоне осложненной беременности, был проведен анализ ее течения. В I триместре у пациенток с ПРПО статистически значимо чаще отмечали ранний токсикоз – 8/47 (17,0%), а у пациенток со CПР – острую респираторную вирусную инфекцию – 5/43 (11,6%) (p<0,01). Во II триместре – в группе с ПРПО была отмечена статистически высокая частота угрозы ПР – 25/47 (53,1%) (p<0,01). В III триместре статистических различий между исследуемыми группами выявлено не было. Согласно критериям невключения, пациентки с абдоминальным родоразрешением не входили в исследование, и все роды произошли через естественные родовые пути. Послеродовый период у пациенток с ПРПО протекал с осложнениями: с анемией у 12/47 (25,5%) и эндометритом у 1/47 (2,1%) пациенток.
Известно, что ПР сопряжены с высокой частотой неблагоприятных перинатальных исходов, в связи с чем особый интерес представляло изучение течения раннего неонатального периода. Все дети родились живыми, однако в группах со CПР и ПРПО отмечались более низкие массо-ростовые показатели и оценка по шкале Апгар, что обусловлено более ранними сроками родоразрешения. В структуре неонатальной заболеваемости у детей в группах СПР и ПРПО статистически чаще встречались респираторный дистресс-синдром – 33/43 (76,7%) и 37/47 (78,7%), врожденная пневмония – 6/43 (13,9%) и 9/47 (19,1%), внутрижелудочковые кровоизлияния – 30/43 (69,7%) и 29/47 (61,7%) (p<0,01) соответственно по группам. Полученные результаты согласуются с данными литературы о связи ПР с высокой заболеваемостью новорожденных [4, 11, 14].
Причины реализации ПР различны как по патогенетическому механизму, так и в зависимости от гестационного срока. Вопрос о ранней и доклинической диагностике остается нерешенным, и в настоящее время ведется активный поиск предикторов на молекулярном и клеточном уровнях [1, 2, 8, 19, 20]. На следующем этапе исследования для прогнозирования ПР нами проведено изучение копийности мтДНК в плазме крови и содержания структурно-функционального белка VDAC1 в плаценте.
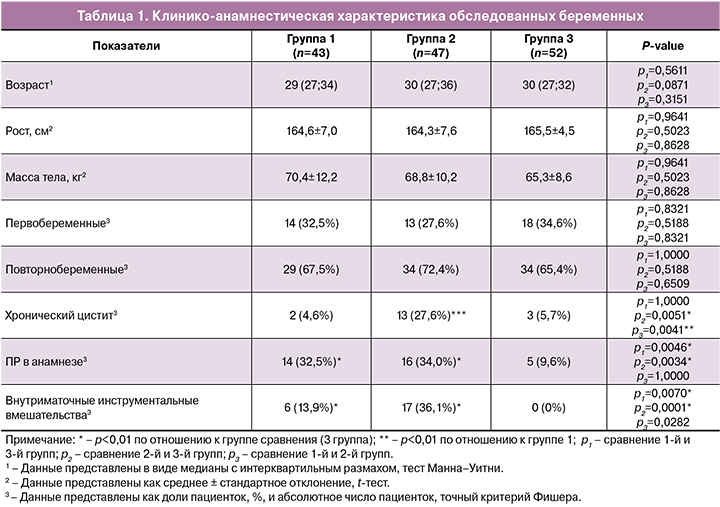
При анализе содержания белка VDAC1 в плаценте при ПР были получены статистически значимые различия при сроке 22–27,6 недели как при СПР – 0,43 (0,18;0,96), так и при ПР с ПРПО – 0,75 (0,72;0,90) в отличие от своевременных родов – 0,63 (0,46;0,82). При СПР в сроке 28–33,6 недели его содержание составило 0,69 (0,54;1,20), в 34–36,6 недели – 0,85 (0,73;0,97); в то время как при своевременных родах – 0,63 (0,46;0,82). При ПР с ПРПО на сроках 28–33,6 недели содержание VDAC1 составило 0,85 (0,73;0,97), при сроке 34–36,6 недели – 0,77 (0,61;1,07), при своевременных родах – 0,63 (0,46;0,82). Анализ его содержания при сроке 34–36,6 недели установил статистически значимо низкий уровень в группе со СПР по сравнению с ПРПО (p=0,027); других статистически значимых различий получено не было. Данные представлены на рисунках 1 А и Б.
Принимая во внимание полученные различия в содержании VDAC1, на следующем этапе проведено изучение мтДНК в периферической крови беременных. Для уточнения референсных значений мтДНК была дополнительно проанализирована группа пациенток с физиологически протекающей беременностью.
При физиологически протекающей беременности наблюдалось повышение уровня мтДНК пропорционально сроку, достигая максимальных значений при сроке 37–40 недель (рис. 2).
При СПР анализ уровня мтДНК на сроках 22–27,6 и 34–36,6 недели установил его более высокий уровень (р<0,05) в отличие от физиологической беременности. При сроке 28–33,6 недели отмечалась аналогичная тенденция, но статистически значимых различий не было выявлено. При ПРПО также были установлены различия: уровень мтДНК на сроках 22–27 и 28–33 недель был статистически значимо выше, чем при физиологически протекающей беременности (р<0,05), однако было отмечено статистически значимое снижение в отличие от своевременных родов. Анализ уровня мтДНК на сроке 34–37 недель показал, что его уровень при ПРПО также был выше, чем при физиологически протекающей беременности, но статистически значимых различий выявлено не было (рис. 3 А и Б).

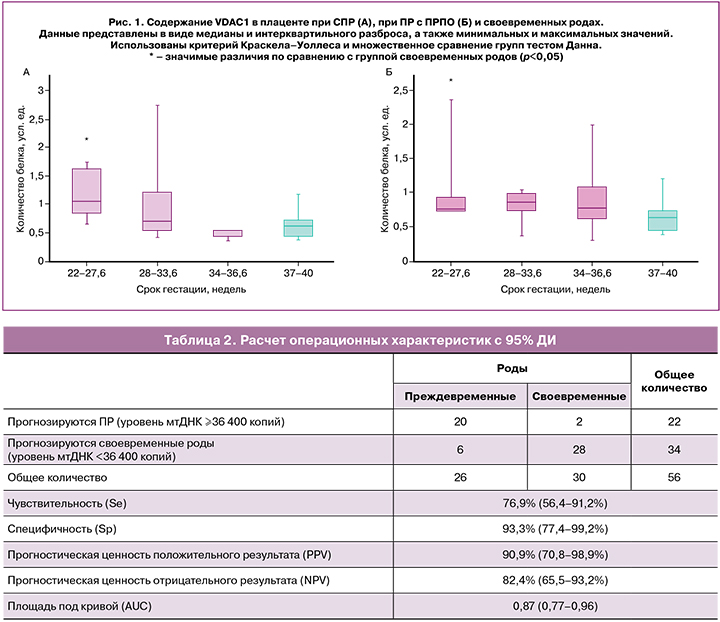
Для оценки диагностической эффективности определения уровня мтДНК при ПР был проведен ROC-анализ (рис. 4). В качестве прогнозируемого исхода выбран факт наступления ПР в течение 7 суток от момента взятия биоматериала.
Площадь под кривой AUC=0,87 (0,77–0,96), р=0,00002. Согласно экспертной шкале, данная модель оценки определяется как «отличная». При выборе порогового уровня использовали критерий максимальной суммарной чувствительности и специфичности. В качестве уровня отсечки выбран уровень мтДНК, равный 36 400 копий (4,6 десятичный логарифм), при котором чувствительность составила 77% (56,4–91,2), а специфичность 93% (77,4–99,2). Прогностическая ценность положительного результата (PPV) составила 90,9 (70,8–98,9), а отрицательного результата (NPV) – 82,4 (65,5–93,2). Данные представлены в таблице 2.
Таким образом, определение у пациентки уровня мтДНК ≥36 400 копий прогнозирует ПР в ближайшие 7 дней. Определение данного маркера может способствовать своевременной диагностике и началу персонифицированной комплексной терапии, направленной на пролонгирование беременности.
Митохондриальная дисфункция различной этиологии, приводящая к нарушению баланса окислительно-восстановительных реакций в клетках и тканях, рассматривается как один из ведущих факторов патогенетических изменений фетоплацентарного комплекса, приводящих к таким осложнениям беременности, как ПР [5, 15, 20]. Митохондрии являются одними из центральных медиаторов воспаления. Для изучения связи наблюдаемых различий функционального проявления митохондриальной активности при СПР и при ПРПО, а также при своевременных родах с возможным изменением количества митохондрий в плаценте проведено изучение содержания митохондриального мембранного белка VDAC1, являющегося маркером внешних мембран митохондрий. Полученные различия в содержании VDAC1 в плаценте подтвердили его вовлеченность в развитие данного осложнения и послужили основой для изучения мтДНК, также относящейся к представителям митохондриальных DAMPs.
Следует отметить, что динамика повышения уровня мтДНК при ПР различного генеза также имела различный характер, что отражает механизмы развития процесса индукции родов при СПР и ПРПО. Установленные статистически значимо высокие уровни мтДНК при СПР и ПРПО в отличие от физиологически протекающей беременности, достигающие уровня при своевременных родах, отражают их потенциальную роль в развитии данного осложнения, что согласуется с данными R. Romero et al. [18]. Вышеуказанное обусловливает возможность определения данного маркера для предикции ПР и необходимости проведения своевременных лечебных и профилактических мероприятий.
Заключение
Таким образом, митохондриальные DAMPs могут служить предикторами возникновения как СПР, так и ПР с разрывом плодных оболочек. Определение данного маркера может способствовать своевременной диагностике и началу персонифицированной комплексной терапии, направленной на пролонгирование беременности.



