Значительное увеличение частоты воспалительных заболеваний влагалища и шейки матки, в
частности экзо- и эндоцервицитов, требует поиска новых методов и схем лечения данного заболевания. Раннее начало половой жизни, инфекции, передаваемые половым путем, наличие нескольких половых партнеров, бесконтрольное применение антибактериальных препаратов, приводящих к нарушению биоценоза влагалища, ведет к хронизации заболевания и частым обострениям. Высокая частота встречаемости хронических цервицитов обусловлена изменением общей реактивности организма в результате нарушения клеточных и гуморальных звеньев иммунной системы [2, 7, 10].
Несмотря на возможности и широкий спектр препаратов, применяемых в лечении цервицитов, не всегда удается добиться элиминации возбудителя, вызвавшего заболевание, и ликвидации воспалительного процесса. По данным разных авторов, частота рецидивов заболевания достигает 40% [7, 9].
На фоне хронического цервицита могут формироваться дистрофические изменения шейки
маткисдальнейшимразвитиемдиспластических процессов. Ряд авторов относят больных хроническим цервицитом специфической и неспецифической этиологии к группе риска в отношении развития рака шейки матки [5, 9].
Наличие цервицита у беременных повышает риск инфицирования амниона, хориона, околоплодных вод и плода, преждевременного прерывания беременности, осложнений в родах,
послеродовом периоде, высокой заболеваемости новорожденного [12]. Воспалительный процесс в
цервикальном канале считают одним из этиологических факторов бесплодия [2, 11].
Основными повреждающими агентами при развитии воспалительного процесса являются
возбудители инфекций. Механизм повреждения тканей может различаться:
· возбудители могут входить в контакт или проникать в клетки хозяина и непосредственно вызывать гибель клеток;
· вырабатываются эндо- и экзотоксины, которые приводят к гибели клеток, находящихся рядом
с поврежденными клетками;
· развиваются иммунные клеточные и гуморальные реакции, направленные против инфекционного агента, способные вызывать дополнительные повреждения тканей;
· вырабатываются ферменты, повреждающие кровеносные сосуды и вызывающие опосредованно ишемический некроз тканей [5].
Проводимая на ранних этапах развития воспаления антибактериальная терапия с учетом конкретной инфекции и чувствительности к антибиотикам ликвидирует воздействие инфекционного агента на эпителий влагалища и шейки матки и нормализует состояние многослойного плоского эпителия. Однако при длительно текущих хронических процессах лечение
не оказывает столь благотворного воздействия, так как воспаление – это полисистемная патологическая реакция, которая поддерживается образованием провоспалительных медиаторов. Основными из них являются циклооксигеназы. Циклооксигеназа 2 (ЦОГ-2) в нормальных условиях во многих тканях отсутствует и образуется под действием цитокинов, индуцирующих воспалительную реакцию, участвуя в синтезе простагландинов при воспалении [1, 3, 5, 13].
Воспаление повреждает глубокие слои ткани шейки матки, нарушает физиологический процесс метаплазии, способствует появлению атипичных клеток. Кольпоскопически ткань экзоцервикса становится рыхлой, гиперемированной, отечной и за счет этого бугристой, сосудистая сеть приобретает вид атипичной (крупные, легко травмирующиеся сосуды, плохо сокращаются на уксусной пробе), наблюдается гипертрофия шейки матки. На пробе Шиллера отмечаются йоднегативные участки с размытыми краями. Цитологически и гистологически может наблюдаться картина цервикальной интраэпителиальной неоплазии. Несмотря на отсутствие инфекционного агента во всех анализах, состояние шейки матки и слизистой оболочки влагалища не улучшается. Проведение на таком фоне коагуляции шейки матки тем или иным методом неэффективно, так как эпителизация практически не наступает и это способствует развитию различных осложнений [5].
В достижении эффективности лечения хронических цервицитов используются методики и препараты комплексного действия, лазеро- и рефлексотерапия, различные фитопрепараты,
иммуномодуляторы [11]. Развитие хронических воспалительных процессов сопровождается изменениями иммунной системы организма, которые влияют не только на течение, но и исход заболевания. Это служит основанием для разработки и изыскания новых средств и методов, оказывающих эффективное терапевтическое воздействие, направленное на восстановление функции нарушенного иммунного статуса человека в целом или же на конкретное звено в иммунной системе.
Основными показаниями к назначению иммуномодуляторов является индуцированная или
спонтанная вторичная иммунная недостаточность, клинически проявляющаяся следующими особенностями:
· склонностью к активно протекающим инфекционно-воспалительным процессам любой локализации;
· частыми рецидивами и вялым течением;
· резистентностью к лечению традиционными средствами;
· преобладанием среди возбудителей оппортунистических или условно патогенных микроорганизмов, а также патогенной флоры с атипичными биологическими свойствами;
· наличием множественной устойчивости к этиотропным средствам.
Выбор иммуномодуляторов должен быть определен с учетом состояния иммунной системы
пациента, цели иммунофармакотерапии, иммунофармакологических свойств, эффективности
и безопасности применяемого препарата, особенностей взаимодействия с другими лекарственными средствами.
Ведущая функция в формировании иммунитета принадлежит интерферонам, являющимися
важнейшими компонентами врожденной неспецифической защиты организма от инфекций.
Интерфероны представляют собой семейство белков местной (аутокринной и паракринной)
регуляции, которые способны активировать внутриклеточные процессы и межклеточные
взаимодействия, обеспечивающие устойчивость к вирусным инфекциям, усиливающие врожденный и приобретенный иммунные ответы, модулирующие процессы развития и гибели нормальных и опухолевых клеток. Резистентность организма к инфекционным заболеваниям, в
том числе к вирусным инфекциям, во многом зависит от активности группы генов системы
интерферонов.
Эффекты интерферонов непрямые – активация интерферонами специфических рецепторов
вызывает каскад клеточных процессов, приводящих к индукции специфических стимулируемых интерферонами генов, кодирующих синтез множества белков, которые и обеспечивают противовирусные эффекты, противоопухолевое и антипролиферативное действия интерферонов.
Индуцируемые интерферонами белки включают ферменты, транскрипционные факторы, клеточные поверхностные гликопротеиды, цитокины, хемокины и другие факторы, действие которых продолжают исследовать. Продукция интерферонов клетками является преходящей, временной – «молчащие» в норме гены интерферонов индуцируются под действием продуктов вирусного и микробного происхождения и химических индукторов.
Одним из индукторов интерферонов является препарат, содержащий тилорон (лавомакс).
Тилорон – низкомолекулярный индуктор эндогенного интерферона. Является синтетическим
соединением ароматического ряда, относится к классу флуоренонов. Стимулирует образование в организме α-, β-, γ-интерферонов. Структурами, продуцирующими интерферон в ответ на введение препарата, являются клетки эпителиякишечника,гепатоциты,T-лимфоциты и нейтрофилы [6, 8, 14]. Кроме того, тилорон обладает противовоспалительной активностью, повидимому, не связанной со стимуляцией выработки интерферона. Противовоспалительная активность тилорона может быть опосредована холинергическим противовоспалительным каскадом, поскольку показано, что тилорон является избирательным частичным агонистом α7 никотиновых ацетилхолиновых рецепторов. Как индуктор холинергического противовоспалительного каскада тилорон способен подавлять синтез провоспалительных цитокинов, играющих определяющую роль в развитии воспалительного процесса [13, 15].
После приема препарата внутрь максимум продукции интерферона определяется в последовательности кишечник-печень-кровь через 4–24 ч. Тилорон оказывает стимулирующее влияние на стволовые клетки костного мозга, усиливает антителообразование, уменьшает степень иммунодепрессии, восстанавливает соотношение T-хелперы/T-супрессоры.
В настоящее время имеется определенный опыт применения тилорона (лавомакса) в лечении пациенток с неспецифическими воспалительными заболеваниями гениталий, а также при папилломавирусной инфекции в составе комплексной и монотерапии. Исследователи отмечали, что достоинствами лавомакса являются хорошая переносимость и удобная схема применения [4, 7].
Нами было проведено исследование, целью которого явилась оценка возможности применения тилорона (лавомакса) в комплексном лечении цервицитов, обусловленных хламидийной инфекцией.
Материал и методы исследования
В исследование были включены 30 пациенток в возрасте от 18 до 45 лет (средний возраст
26,2±1,2 года) с клиническими проявлениями и подтвержденным диагнозом урогенитального
хламидиоза по данным клинико-лабораторных методов исследования.
Все пациентки были обследованы с применением клинических (анализ анамнестических данных, жалоб пациентки), гинекологических (осмотр вульвы, слизистых оболочек влагалища и шейки матки в зеркалах, бимануальное гинекологическое исследование, расширенная кольпоскопия) и лабораторных (полимеразная цепная реакция, иммуноферментный анализ) методов исследования.
Пациентки перед назначением терапии были разделены на две группы. В I группу включены 15 пациенток, которые принимали препарат лавомакс в таблетках по 0,125 г в составе комплексной терапии: первые двое суток по 125 мг, затем по 125 мг через 48 ч. Курсовая доза — 1,25 г. Во II группу включены 15 пациенток, которые получали стандартную антибактериальную терапию хламидиоза.
Результаты исследования
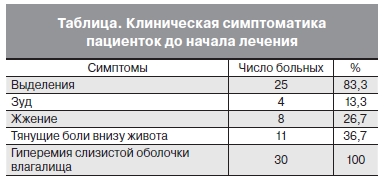
При опросе 83,3% пациенток предъявляли жалобы на обильные выделения из влагалища, тянущие
боли внизу живота отмечали 36,7% пациенток, зуд во влагалище и в области наружных половых органов – 13,3%, жжение в области наружных половых органов – 26,7%; не предъявляли жалоб при обращении 16,7% пациенток. При гинекологическом осмотре у всех пациенток отмечалась гиперемия слизистой оболочки влагалища, шейки матки и вульвы той или иной степени выраженности. При лабораторном исследовании у 100% пациенток методом полимеразной цепной реакции была выявлена хламидийная инфекция. Клинические симптомы, которые отмечались у пациенток до начала терапии, представлены в табл.
При расширенной кольпоскопии у всех пациенток были выявлены отек и гиперемия слизистой
оболочки шейки матки, расширенные субэпителиальные сосуды. При окраске раствором Люголя
отмечались признаки цервицита. При микроскопическом исследовании влагалищного отделяемого у
пациенток зарегистрированы III–IV степени чистоты влагалища.
До начала исследования в обеих группах средние значения уровня специфических IgG и IgА были практически одинаковыми и составляли соответственно 1,76±0,15 и 0,48±0,1 оп. ед. в I группе и 1,39±0,13 и 0,59±0,12 оп. ед. во II группе. Также близкими по значению были уровни ИФН-α и ИФН-γ соответственно 20,6±0,4 и 3,1±0,9 в I группе и 20,7±0,5 и 3,2±0,7 во II группе. Эти данные говорят о равнозначности двух исследуемых групп по характеру течения хламидийной инфекции.
При оценке эффективности терапии клинические симптомы, которые отмечались до начала терапии, и явления цервицита при расширенной кольпоскопии отсутствовали у 93,3% пациенток I группы и 80% пациенток II группы. У 6,7% пациенток I группы и 20% пациенток II группы отмечались незначительные клинические симптомы заболевания (слабо выраженный цервицит). Отсутствие эффекта от проведенной терапии не отмечено ни у одной из пациенток обеих групп. При двукратном контрольном исследовании соскоба из цервикального канала методом полимеразной цепной реакции у пациенток обеих групп хламидийная инфекция не обнаружена.
При микроскопическом исследовании влагалищного отделяемого у всех пациенток отмечены I–II степени чистоты влагалища. После завершения лечения уровень специфических IgG в среднем по группам изменился незначительно. Содержание IgА в крови у всех пациенток обеих групп снизилось до уровня отрицательного контроля. При контрольном исследовании после лечения у пациенток II группы уровни ИФН-α и ИФН-g существенно не изменялись. В то же время у пациенток I группы отмечено увеличение уровня ИФН-α почти в полтора раза (среднее значение до лечения – 20,6±0,4, после лечения – 29,2±1,6). Уровень ИФН-g у пациенток I группы, в среднем
повысился почти в 3 раза – до лечения среднее значение в группе было 3,1±0,9, после лечения – 8,1±0,9.
Таким образом, проведенное клинико-лабораторное исследование показало, что применение препарата лавомакс в составе комплексной терапии цервицитов, обусловленных хламидийной инфекцией, приводит к выраженному положительному клиническому эффекту и способствует более полному исчезновению клинических симптомов урогенитального хламидиоза, нежели стандартная терапия антибактериальными препаратами.



