Миома матки (ММ) является одной из наиболее распространенных доброкачественных опухолей женской половой сферы, которая возникает у каждой третьей женщины репродуктивного возраста [1–3].
Многие женщины в силу ряда причин откладывают осуществление репродуктивной функции на более поздний срок, что ведет к увеличению доли пациенток с гинекологической патологией, в том числе страдающих ММ. Поэтому должны быть расширены показания к реконструктивно-пластическим операциям [4].
Органосохраняющие операции сопряжены с возможностью рецидива заболевания, что в ряде случаев может привести к повторному оперативному вмешательству. Doridot V. и соавт. [5] определяют рецидив ММ по сумме данных: наличие миоматозного узла при ультразвуковом исследовании (УЗИ) и появление клинической картины заболевания, сходной с таковой перед оперативным вмешательством.
В большинстве исследований, посвященных проблеме рецидивирования лейомиомы, риск рецидива связывают с генетическим аспектом (ген MED12), наличием семейного анамнеза по данной нозологии, возрастом пациенток (30–40 лет), большим количеством узлов (более трех), быстрым ростом ММ до операции, большими размерами подслизистой опухоли при ее неполной резекции, а также с морфологическими и гистологическими типами опухолей [6, 7]. По мнению многих авторов, рецидивирование ММ является в основном мерилом аккуратности и квалификации хирурга в поиске и попытке удаления всех мелких миоматозных узлов, а дополнительное гормональное лечение лишь корригирует симптомы заболевания – является симптоматическим и только оттягивает время наступления беременности.
Несмотря на огромное количество исследований, посвященных различным аспектам ММ, до сих пор не до конца изучены этиология и патогенез этого заболевания, отсутствуют методы ее ранней диагностики, а также способы определения прогноза рецидивирования в дальнейшем. Изменение липидного обмена при ММ проявляется в понижении в крови уровня липопротеинов высокой плотности и повышении уровня липопротеинов и оксилипопротеинов низкой плотности [8], а также в снижении уровня малондиальдегида [9]. При таргетных исследованиях крови пациенток с ММ были обнаружены значимые различия в уровне некоторых белков. Продемонстрирована корреляция уровня диоксина в крови и риска возникновения ММ [10]. Группой J. Wong и E. Gold [11] был предложен метод оценки риска ММ или ее рецидива по уровню половых гормонов в крови.
Таким образом, представляет большой интерес разработка современных принципов ранней диагностики ММ и ее рецидивов с использованием высокоинформативных современных методов (в частности, хромато-масс-спектрометрии) с минимальной инвазией.
В настоящем исследовании проведен анализ содержания липидов в плазме крови больных ММ, взятой до проведения оперативного вмешательства, и потенциальной возможности использования липидома плазмы крови для диагностики ММ. Преимуществами использования плазмы крови для ее диагностики и рецидивов являются малоинвазивность и простота метода забора крови.
Материалы и методы
В исследование включены 35 женщин с впервые диагностированной ММ и 31 пациентка с диагнозом рецидива ММ (РММ), которые были обследованы и оперированы в гинекологическом отделении (руководитель отделения акад. РАН, проф., д.м.н. Адамян Л.В.) ФГБУ «НМИЦ АГиП им. В.И.Кулакова» (директор – акад. РАН, проф., д.м.н. Сухих Г.Т.). Группу сравнения составили 15 пациенток, оперированных по поводу бесплодия и внутриматочной перегородки. Все пациентки подписали информированное согласие на участие в исследовании, одобренное Этическим комитетом НМИЦ АГиП им. В.И.Кулакова.
ММ была диагностирована при влагалищном исследовании, УЗИ, подтверждена при лапароскопии, окончательно подтверждена при гистологическом исследовании.
Критериями включения для групп ММ и РММ были: наличие миомы матки, репродуктивный возраст пациенток (18–45 лет), заинтересованность пациентки в сохранении репродуктивной функции, отсутствие гормональной терапии в течение 6 и более месяцев до операции.
Критерии исключения: противопоказания к хирургическому лечению, наличие онкологических заболеваний, наличие инфекций, передающихся половым путем, наличие острых инфекционных заболеваний, острые воспалительные заболевания органов малого таза, системные аутоиммунные заболевания, тяжелая соматическая патология.
Основные жалобы пациенток, обратившихся для оперативного лечения: болевой синдром при половом акте, нарушения менструального цикла: болезненные, обильные, нерегулярные менструации, межменструальные выделения, нарушение функции смежных органов: запоры, учащенное мочеиспускание, бесплодие, невынашивание.
Все пациентки находились в репродуктивном возрасте. Средний возраст пациенток с ММ составил 37,9±5,5 года, а пациенток с РММ – 40,0±5,2 года. При анализе возрастного показателя выяснилось, что частота РММ выше в группе женщин старше 40 лет, в то время как первая миомэктомия выполняется в возрасте 30–40 лет.
Индекс массы тела (ИМТ) у больных ММ и РММ был 24,05 и 24,7 соответственно. Отмечено статистически значимое (р<0,05) превышение ИМТ у больных РММ по сравнению с таковым у больных ММ. При анализе группы рецидива ММ выявлено, что повторная миомэктомия понадобилась в среднем через 5,7±4,4 года.
Всем пациенткам проведено хирургическое лечение лапароскопическим доступом. Показаниями к оперативному лечению были обильные менструации, приводящие к анемии, выраженный болевой синдром, отсутствие эффекта от ранее проведенной консервативной терапии, отсутствие наступления беременности у женщин репродуктивного возраста.
В группе РММ количество удаленных миоматозных узлов было статистически значимо больше, чем в группе ММ (ММ – 3–4 узла, РММ – 5–6 узлов), но размер удаленных узлов преобладал в группе ММ (ММ – 8,1 см, РММ – 6,3 см).
Забор крови у пациенток проводился натощак накануне оперативного вмешательства. Кровь забирали в вакуумную стерильную пробирку с ЭДТА-натрий (0,5 мл 1,5% раствора на 10 мл крови) и центрифугировали в течение 10 мин при 2500 оборотах для получения плазмы. Криопробирка с плазмой крови в жидком азоте транспортировалась в биобанк, где хранилась в морозильной камере при температуре -80 С до анализа.
Экстракты липидов получали в соответствии с модифицированным методом Фолча [12]. В ходе данного исследования к 40 мл образца плазмы добавляли 480 мл смеси хлороформ-метанол (2:1), смесь подвергалась действию ультразвука на протяжении 10 минут, после чего к смеси добавляли 150 мл H2O и пропускали в течение 10 с через Vortex. Смесь центрифугировали в течение 5 мин при 15 000 об./мин при температуре окружающей среды. Отбирали органический слой, содержащий липиды, подвергали вакуумной сушке, затем повторно растворяли в смеси 100 мл изопропанола и 100 мл ацетонитрила для последующего масс-спектрометрического анализа.
Образцы анализировали на жидкостном хроматографе Dionex Ultimate 3000 (ThermoScientific, Бремен, Германия), сопряженном с масс-спектрометром Maxis Impact qTOF (Bruker Daltonics, Бремен, Германия). Экстракты липидов разделяли на колонке Zorbax SB-C18 (0,5×150 мм, сорбент 5 мкм, Agilent), объем инжектируемого образца 3 мкл, скорость потока 40 мкл/мин, температура колонки 50 °С, градиент подвижной фазы: 0– 0,5 мин, 70% А + 30% В, 20,5–30,5 мин, 1% А + 99% В, 31–33 мин, 70% А + 30% В, где А – 10 ммоль/л раствор формиата аммония и 0,1% раствор муравьиной кислоты в ацетонитрил/H2O (60/40), В – 10 ммоль/л раствор формиата аммония и 0,1% раствор муравьиной кислоты в изопропанол/ацетонитрил/H2O (90/8/2). Масс-спектры получали в режиме положительных ионов в диапазоне m/z 400–1000 со следующими настройками: напряжение на капилляре 4,1 кВ, давление распыляющего газа 0,7 бар, скорость потока осушающего газа 6 л/мин, температура осушающего газа 200 °С [13, 14].
Для предварительной обработки хромато-масс-спектрометрических данных использовались бесплатно распространяемые программы msConvert из Proteowizard 3.0.9987 для преобразования .d-файлов в MzXml-файлы и MzMine для выделения масс-хроматографических пиков, нормирования на полный ионный ток и создания таблицы, содержащей информацию о пике – массе иона, времени выхода, площади пика.
Для статистической обработки полученных численных данных использовали скрипты, написанные на языке R версии 3.3.3 [15], и программу RStudio 1.1.383 под лицензией GNU General Public License [16].
Липиды идентифицировали с использованием R-скрипта Lipid Match [17] по точной массе с помощью базы данных Lipid Maps [18] и по характерным тандемным масс-спектрам (МС/МС). Статистический анализ для определения липидов – потенциальных маркеров ММ проводили с помощью непараметрического двустороннего теста Манна–Уитни. Интенсивности пиков, относящихся к липидам, описывали в виде медианы (Me) и квартилей Q1 и Q3 в формате Me (Q1;Q3). Величину критического уровня значимости p принимали равной 0,05. Поиск потенциальных липидов-маркеров осуществлялся через анализ поставленного диагноза и уровней липидов со значимым различием в уровнях методом дискриминантного анализа с ортогональной проекцией на латентные структуры (OPLS-DA) с кросс-валидацией семикратным разбиением, позволяющим построить статистическую модель на некоторой выборке, для которой принадлежность каждого образца к той или иной группе известна, для оценки, какие именно липиды ответственны за различия в группах. К потенциальным липидам-маркерам были отнесены липиды, чья важность независимой переменной для проекции (variable importance projection, VIP) для дискриминантной модели превышала 1 [19].
Выбранные липиды (VIP>1; p<0,05) для каждой пары клинических групп и пары контрольная группа/объединенная группа: первый случай диагностированной миомы и рецидив миомы проверялись на возможность их использования в качестве диагностических маркеров путем построения многомерной логистической регрессии с использованием значений уровней липидов-маркеров в качестве предикторных переменных и диагноза как переменной отклика и кросс-валидации диагностической модели по отдельным объектам. Потенциальная диагностическая модель на основе логистической регрессии строилась на основе N-1 объекта с последующим тестом на не участвующем в построении регрессии объекте, где N – число объектов в паре клинических групп, для которых строится диагностическая модель.
Результаты и обсуждение
В последнее десятилетие для поиска маркеров различных заболеваний все чаще используются постгеномные методы анализа, среди которых лидирующие позиции занимают метаболомные и протеомные технологии, позволяющие с высокой точностью определить молекулярный состав любого биологического образца [20]. Липиды и жирные кислоты вовлечены во все процессы, протекающие в организме: являются структурным элементом мембран клеток, выполняют транспортную функцию для гидрофобных и амфифильных веществ, участвуют в регулировании клеточной пролиферации, миграции, внеклеточной и внутриклеточной передаче сигналов [21].
В данном исследовании проведен липидомный анализ крови пациенток с ММ с рецидивом и без. Группой сравнения являлись пациентки без наличия ММ как при УЗИ, так и при лапароскопии. Всего в исследовании участвовала 81 пациентка.
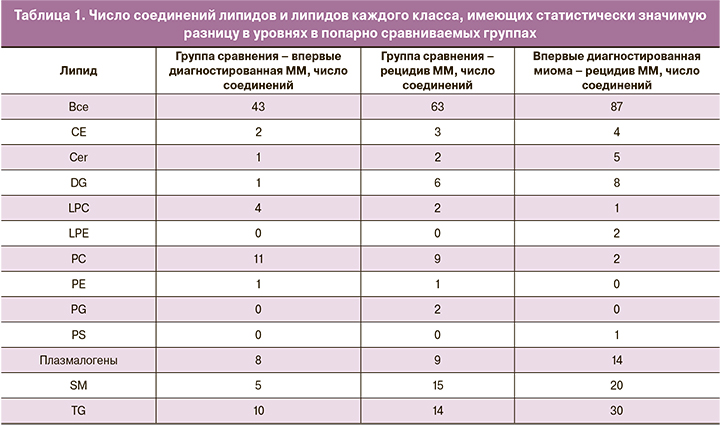
В образцах плазмы крови было идентифицировано 267 липидных соединений. Для поиска потенциальных липидов-маркеров уровни липидов были проверены на выполнение критерия Манна–Уитни в парах «контрольная группа-впервые диагностированная миома», «контрольная группа-рецидив миомы» и «впервые диагностированная миома-рецидив миомы». У 43 липидов были найдены статистически значимые различия в первом случае, у 64 – во втором и у 87 – при впервые диагностированной миоме и при рецидиве (табл. 1–2).
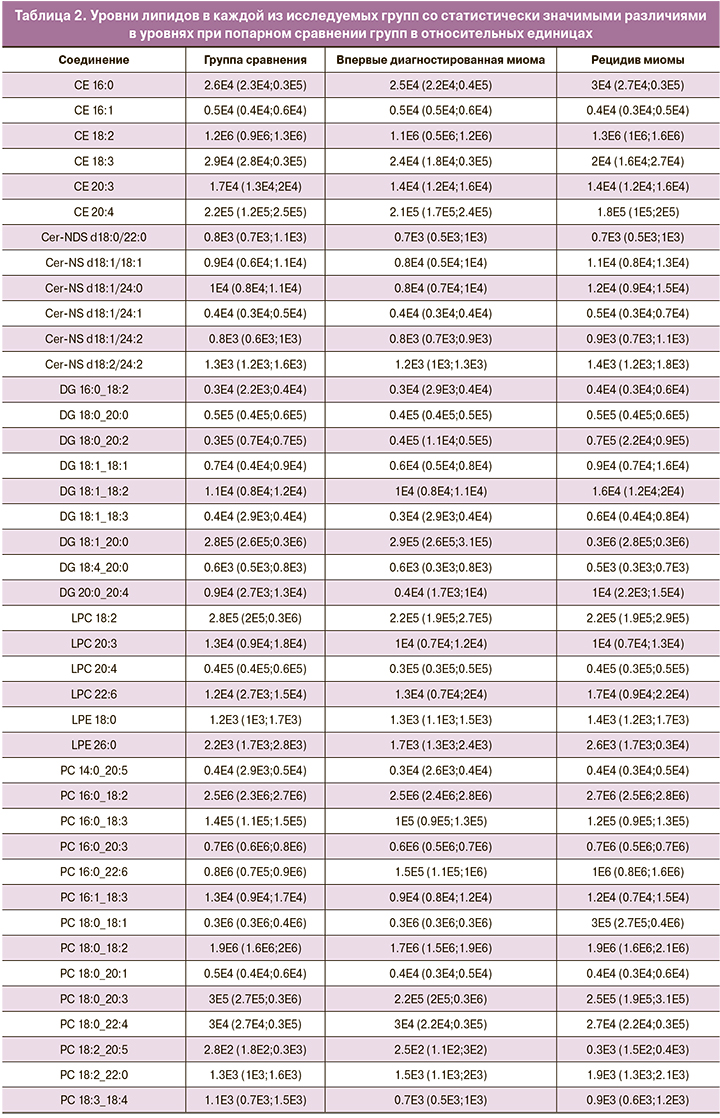

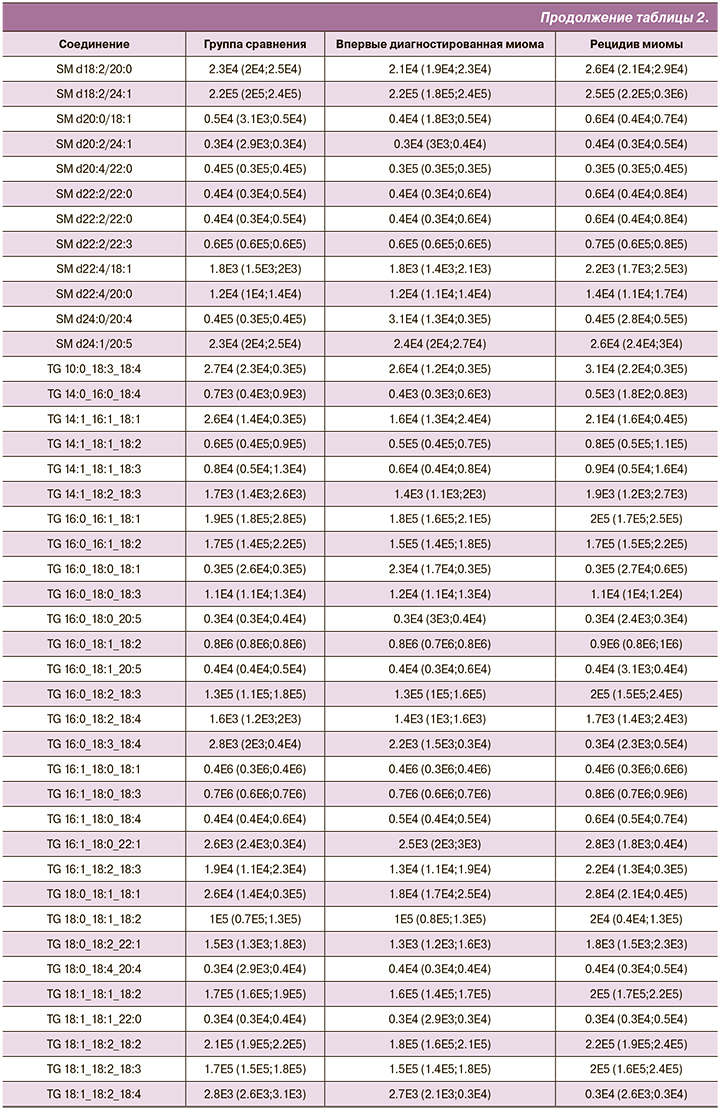
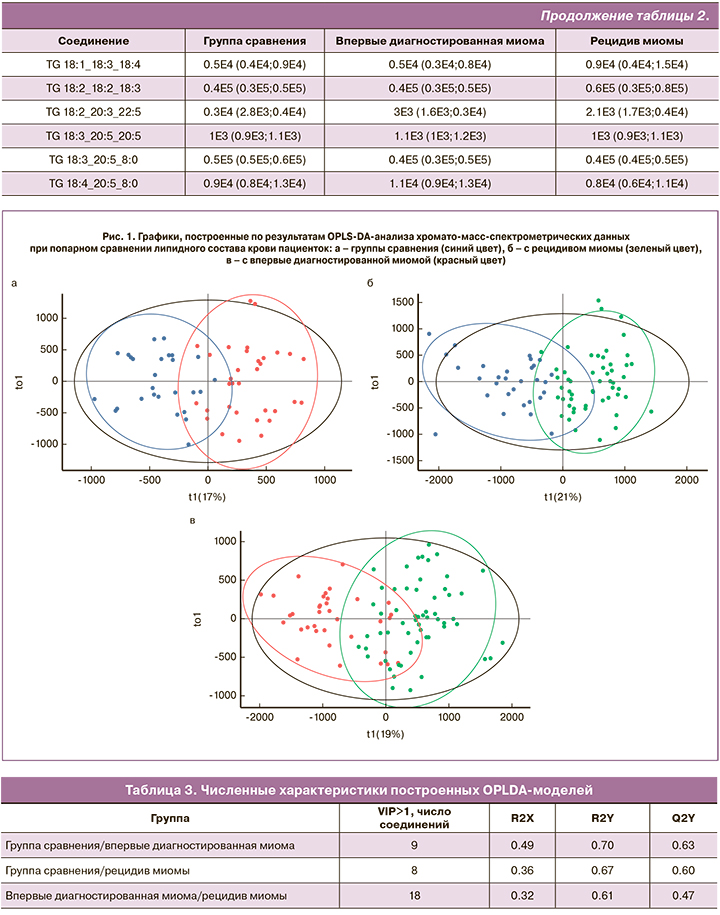
На основе данных об уровне потенциальных липидов-маркеров в плазме крови были построены OPLS-DA-модели для классификации пациенток из группы сравнения, пациенток с впервые диагностированной миомой и пациенток с рецидивом миомы (рис. 1). Для классификации группа сравнения/миома доля данных, вошедших в модель (R2Y), составила 70 и 67% при впервые возникшей миоме и рецидиве соответственно, а ожидаемая точность классификации при добавлении новых (Q2Y) при кросс-валидации составила 63 и 60%. Для классификации впервые диагностированная миома/рецидив эти значения составили 61 и 47% (табл. 3).
Наибольший вклад в модель классификации (VIP>1) контроль/миома вносили фосфатидилхолины (LPC 18:2, PC 16:0_20:3, PC 18:0_18:1, PC 18:0_20:3 в случае впервые диагностированной миомы и PC 16:0_22:6, PC 16:0_18:2, PC 16:0_20:3, PC 18:0_20:3, PC 18:0_18:1 в случае рецидива) и сфингомиелины (SM d18:1/22:0, SM d18:/22:1, SM d18:1/24:0 в случае впервые диагностированной миомы и SM d18:1/24:1, SM d18:2/24:1 в случае рецидива) (рис. 2–3). В модель классификации впервые диагностированная миома/рецидив миомы наибольший вклад вносили холестериновые эфиры (CE 18:2, CE 20:4), фосфатидилхолины (PC 18:0_18:2, PC 16:0_22:6), сфингомиелины (SM d12:0/14:1, SM d18:1/22:0, SM d18:1/22:1, SM d18:1/24:0, SM d18:1/24:1, SM d18:2/16:0, SM d18:2/24:1) и триглицериды (TG 14:1_18:1_18:2, TG 16:0_16:1_18:2, TG 16:0_18:1_18:2, TG 16:0_18:2_18:3, TG 16:1_18:0_18:1, TG 16:1_18:0_18:3, TG 18:1_18:2_18:3) (рис. 4). В ряде случаев липиды, являющиеся потенциальными маркерами для впервые возникшей миомы, не являются таковыми для рецидива, или их уровень изменяется в отличную сторону по сравнению с контрольной группой (рис. 5).
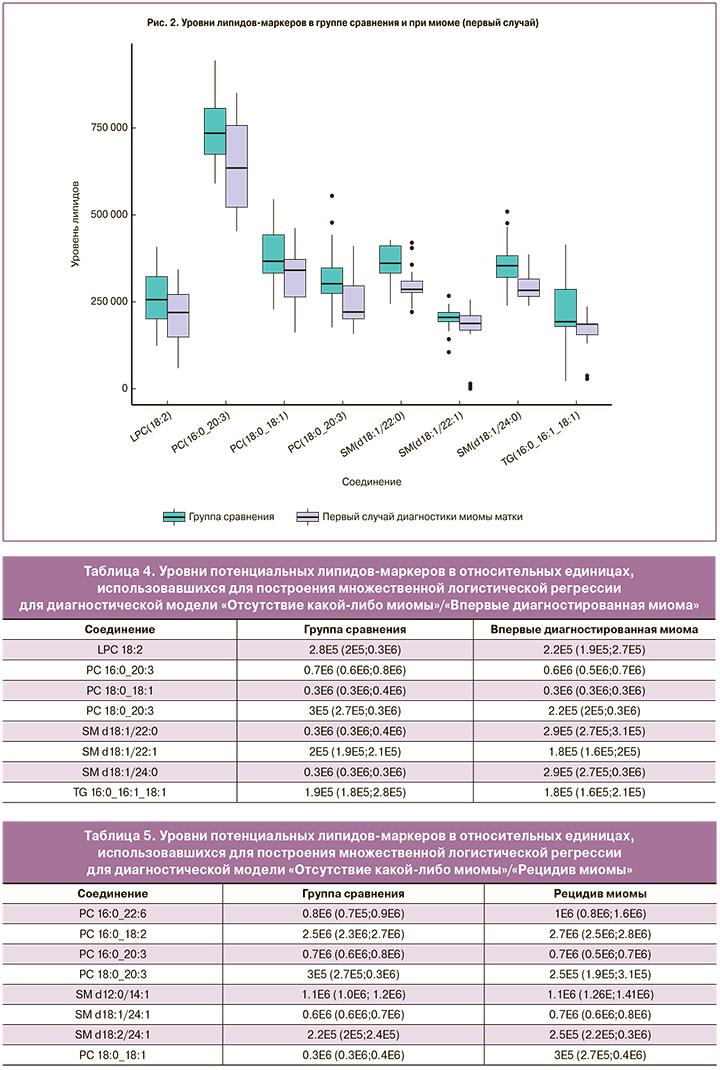
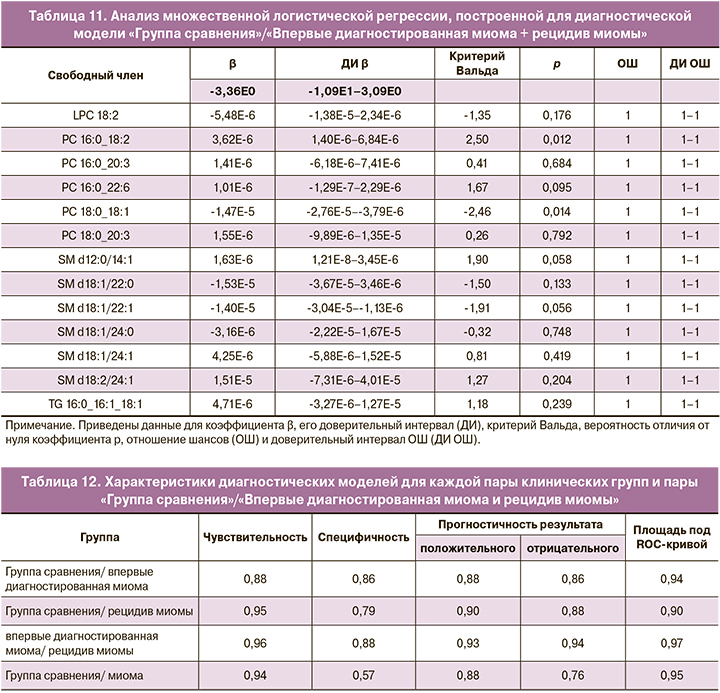
Анализ множественных логистических регрессий, использовавших в качестве предикторов относительные интенсивности липидов, ранее заявленных как потенциальные липиды маркеры (табл. 4–7), показал существование статистически значимой связи между уровнями липидов SM d18:1/22:0 (p=0,009) и SM d18:1/22:1 (p=0,049) и наличием впервые диагностированной миомы/отсутствием какой-либо миомы (табл. 8). В логистической регрессии, описывающей различия между группой сравнения и группой с рецидивом миомы, можно считать статистически значимой связь между диагнозом и уровнями фосфатидилхолинов PC 16:0_22:6 (p=0,023), PC 16:0_18:2 (p=0,020), PC 18:0_18:1 (p=0,017) и сфингомиелинов SM d12:0/14:1 (p=0,008) и SM d18:2/24:1 (p=0,046) (табл. 9). Статистически значимая связь при сравнении впервые диагностированной миомы и рецидива миомы обнаружена только у SM d18:2/24:1 (p=0,049) (табл. 10). Анализ логистической регрессии, построенной для диагностики наличия/отсутствия миомы, показал статистически значимую связь диагноза и уровней PC 16:0_18:2 (p=0,012) и PC 18:0_18:1 (p=0,014) (табл. 11) .
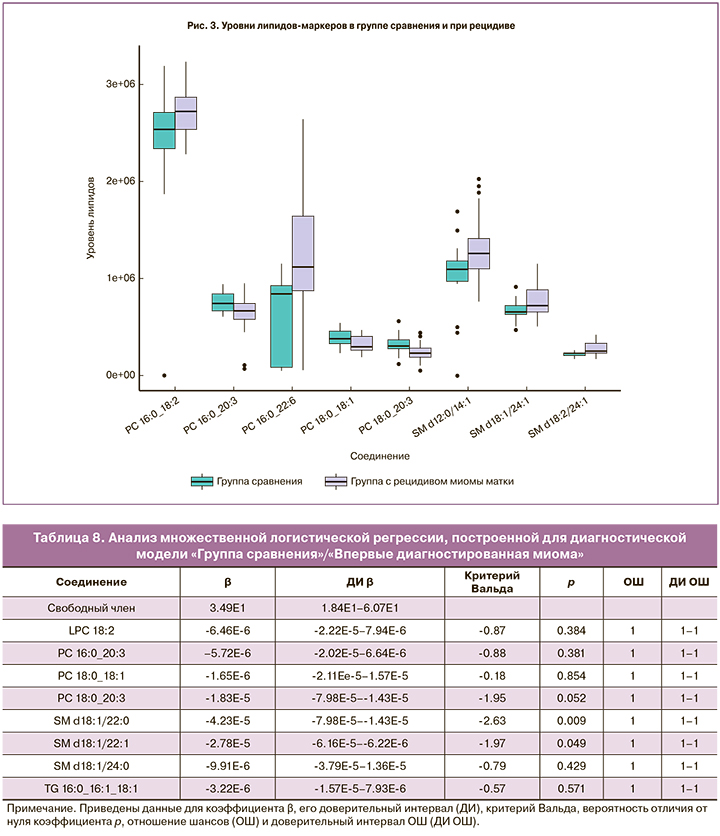
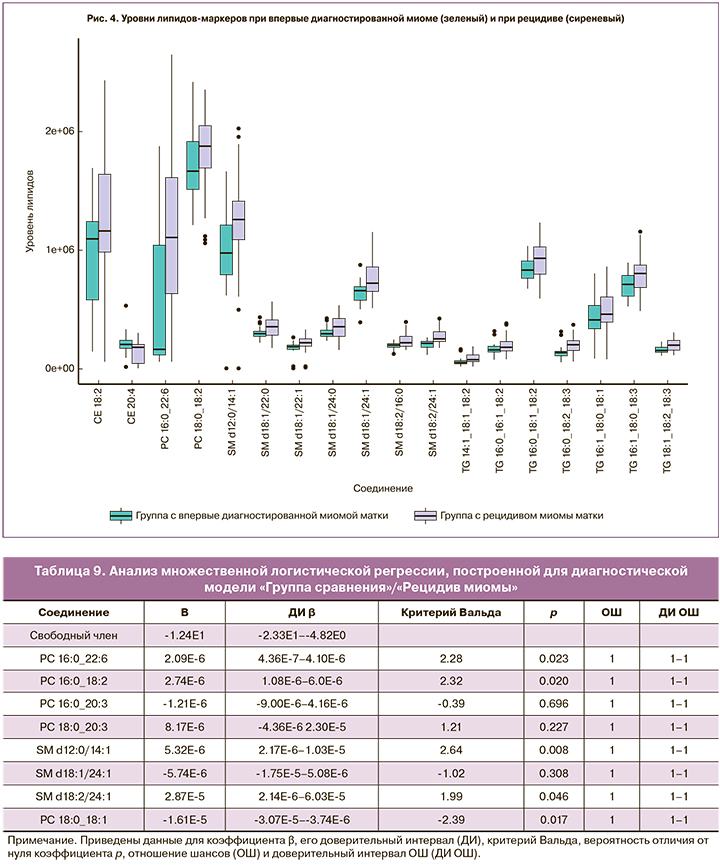
Равенство единице отношения шансов (ОШ) по отношению ко всем исследуемым предикторам во всех логистических регрессиях следует из-за того, что в принятой системе единиц единичное изменение уровня липидов является слишком незначительным при используемой нами точности.
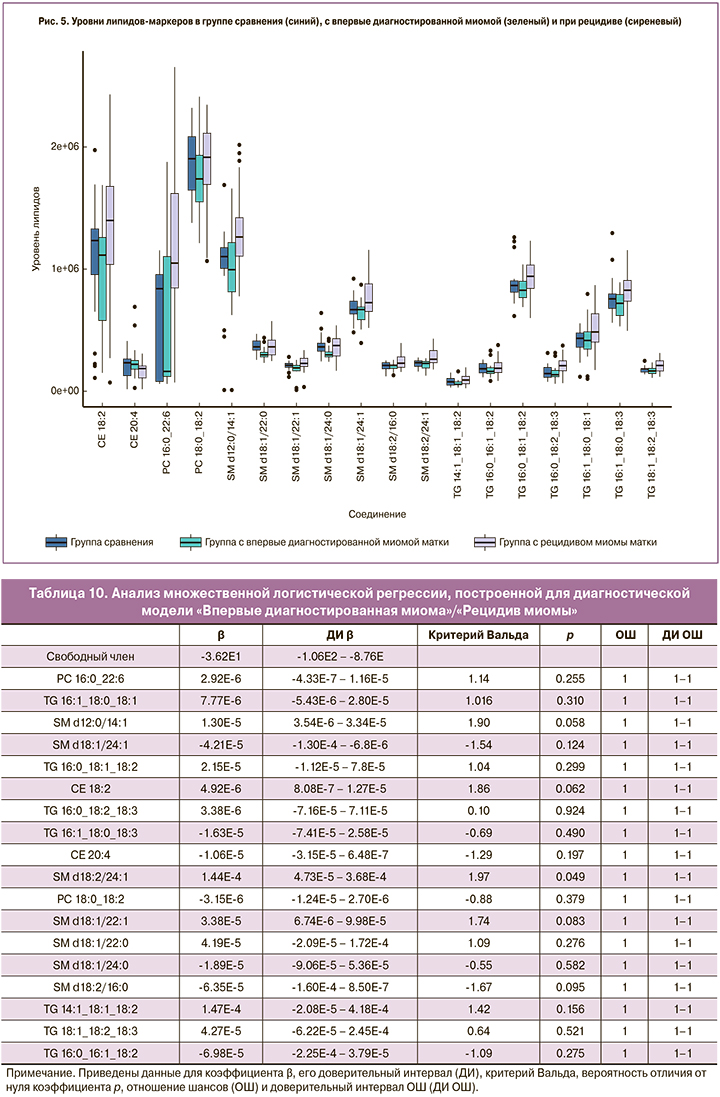
Анализ диагностических моделей, построенных с использованием логистической регрессии на основе выбранных липидов-маркеров, специфичных для каждой пары клинических групп, продемонстрировал высокие чувствительность и прогностичность положительного результата моделей (табл. 12) и значительные специфичность и прогностичность отрицательного результата, что позволяет говорить о связи между липидомом плазмы крови и развитием ММ, а также о связи липидома плазмы крови и рецидивом ММ. Высокая чувствительность диагностической модели, построенной на основе группы липидов-маркеров, составленной из групп каждой пары клинических групп, позволяет предположить потенциальную эффективность диагностики ММ по липидному профилю плазмы крови.
Анализ кривой ошибок (ROC-кривой) (рис. 6, табл. 12) для построенных моделей показывает хорошее качество диагностических моделей (площадь под кривой ≥0,9) для всех анализируемых пар.
Представлено первое исследование по проведению метаболомного профилирования плазмы крови у пациенток с ММ и рецидивом заболевания. Липиды, являющиеся потенциальными маркерами впервые возникшей ММ, не являются таковыми для рецидива заболевания. Это совершенно другие липиды.
В ФГБУ «НМИЦ АГП им. В.И. Кулакова» проводились исследования по рецидивам эндометриоза, которые позволили выявить идентичные липиды как при рецидиве эндометриоза, так и при впервые выявленном эндометриозе. В случае с ММ рецидивирование данного заболевания на молекулярном уровне представляет собой иной процесс.
Поэтому необходимы проведение дальнейших исследований по изучению патогенетических особенностей рецидивирования ММ и созданию прогностических методов, а на их основе – разработка новых критериев диагностики с применением неинвазивных или малоинвазивных методов обследования, позволяющих прогнозировать возможные рецидивы и темпы роста миомы.
Заключение
Анализ липидного состава плазмы крови у пациенток с ММ, РММ и пациенток без ММ выявил ряд фосфолипидов, сфингомиелинов, холестериновых эфиров и триглицеридов, уровни которых существенно отличаются в плазме крови у женщин с ММ, РММ и контрольной группы.
Сравнительное изучение масс-спектрометрических профилей плазмы крови позволит выявить новые молекулярные маркеры для диагностики течения заболевания. В дальнейшем результаты этих исследований могут быть использованы для определения оптимальной тактики лечения больных с миомой матки и создания новых прогностических стратегий и методов терапии.



