Система гемостаза, или система регуляции агрегатного состояния крови (РАСК), представляет собой функциональную систему, состоящую из компонентов, обеспечивающих определенный гемостатический потенциал крови, направленный на поддержание жидкого состояния или свертывания крови. Система РАСК подчинена законам положительных и отрицательных обратных связей, когда практически каждый компонент этой системы, выполнив свою функцию, переходит в состояние, обеспечивающее противоположные эффекты. По мнению Б.И. Кузника [1], «система РАСК настроена таким образом, чтобы обеспечить свертывание крови, ибо нет такого состояния, при котором организму было бы необходимо кровотечение».
В клинической практике приходится сталкиваться с ситуациями, когда различные врожденные дефекты гемостаза, угрожаемые по геморрагиям, сочетаются с теми или иными врожденными или приобретенными предикторами тромбофилии [2, 3]. При этом достигается хрупкий «патологический баланс» между гемостатическим и коагуляционным потенциалами крови, обеспечивающий нормальное функционирование РАСК. У таких пациентов, при отсутствии повреждающих воздействий какие-либо клинические и лабораторно-гемостазиологические проявления могут и не обнаруживаться [4, 5]. Одними из состояний, которые могут привести к нарушению подобного шаткого равновесия, являются беременность, роды и послеродовой период [6].
При физиологической беременности общий коагуляционный потенциал нарастает, активируется фибринолиз [7, 8]. Указанные особенности пропорциональны сроку гестации и определяются формированием маточно-плацентарного круга кровообращения. Эти изменения являются физиологической адаптацией и направлены на поддержание нормального функционирования фетоплацентарного комплекса и остановку кровотечения из плацентарной площадки после отделения плаценты. При беременности повышается активность факторов, составляющих внутренний путь свертывания – в основном VIII, IX, XII и внешний путь свертывания – II, V, VII, X. Активность факторов меняется неодинаково [9]. Существенно повышается содержание фибриногена, V, VII, VIII, X, XII. В противоположность общему увеличению факторов свертывания при беременности отмечается некоторое снижение XI фактора в конце беременности и более заметное снижение ХIII фактора (фибринстабилизирующего фактора). Остальные факторы свертывания изменяются незначительно. Физиологическая роль этих изменений пока не ясна. Одним из признаков повышения свертывающей активности крови при беременности является увеличение уровня тромбинантитромбинового комплекса (ТАТ) и фрагментов протромбина 1+2 [9].
Коагуляционный потенциал крови возрастает еще в связи с тем, что снижается уровень антитромбина III, уровень протеина С повышается в основном в послеродовом периоде, а уровень протеина S уменьшается при беременности и значительно снижается после родов. Кроме того, к концу беременности отмечается ослабление фибринолитической активности.
В послеродовом периоде в течение первых часов фибринолитическая активность возвращается к нормальному уровню, уровни фибриногена, VIII фактора уменьшаются. В течение 2–4 нед после родов уровни фибриногена, VIII фактора увеличиваются. Остальные факторы свертывания постепенно возвращаются к исходному базальному уровню в течение 3–4 нед.
Таким образом, во время беременности, в родах и послеродовом периоде система гемостаза претерпевает довольно сложные адаптационные изменения. В связи с этим существующий до беременности тромбо- геморрагический дисбаланс существенно затрудняет выбор оптимальной тактики профилактики тромбозов и кровотечений.
Клинический пример
Больная К., 31 год, обратилась в ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова с диагнозом: Беременность 33 нед. Головное предлежание. Снижение содержания XII, IX, увеличение содержания VII фактора свертывания крови. Резус-отрицательная принадлежность крови без сенсибилизации.
Из перенесенных заболеваний обращает на себя внимание умеренно выраженный геморрагический синдром, проявляющийся меноррагиями.
Первая беременность, в 2004 г. осложнилась кровотечением в I триместре. II и III триместры – без осложнений. Произошли срочные самопроизвольные роды через естественные родовые пути живым плодом женского пола массой 3550 г, длиной 52 см. На фоне физиологического течения раннего послеродового периода объем кровянистых выделений соответствовал нормативам, однако на 10-е сут внезапно возникло прогрессирующее маточное кровотечение. Производилось переливание свежезамороженной плазмы, кровотечение прекратилось. При обследовании после родов было выявлено: содержание V фактора – 81% (норма 75–125%), XI фактора 82% (норма 75–125%), VIII фактора – 86,5% (норма 75–125%). Обращало на себя внимание снижение XII фактора до 20% (норма 75–125%) и IX фактора до 50% (норма 75–125%) и увеличение содержания VII фактора до 145% (норма 75–125%). Следовательно, имелось одновременное сочетание врожденных геморрагических и тромбофилических аномалий. Вероятно, возникшее на 10-е сут отсроченное послеродовое кровотечение было связано с преобладанием гемофилических эффектов (снижением содержания IX фактора) на фоне некомпенсированного коагулянтного потенциала по внешнему (VII фактор) и внутреннему пути (XII фактор) свертывания.
Вторая беременность наступила в 2012 г., она также осложнилась кровотечением в 8 нед. Во II и III три- местрах протекала без особенностей. К концу III три- местра уровень XII фактора составил 50% (норма 100–200%), IX фактора – 95% (норма 100–150%), уровень VII фактора увеличился до 190% (норма 50–250%). Гемостазиограмма в динамике по триместрам представлена в таблице.
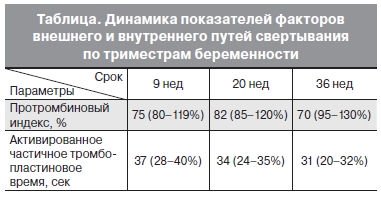
Укорочение протромбинового индекса (ПИ) на протяжении беременности было связано с повышенным содержанием VII фактора, а нормальные показатели активированного частичного тромбопластинового времени (АЧТВ) свидетельствовали о компенсаторном увеличении содержания XII фактора.
Беременность завершилась срочными самопроизвольными родами на 41-й нед. Учитывая более высокую вероятность послеродового кровотечения (дефицит IX фактора) по сравнению с тромботическими осложнениями (дефицит XII фактора и повышение уровня VII фактора), в первом периоде родов была произведена профилактическая трансфузия одногруппной свежезамороженной плазмы (СЗП) в объеме 500 мл. Применение стандартизованного объема трансфузии СЗП (10–15 мл/кг) представлялось небезопасным, учитывая высокий риск тромботических осложнений в послеродовом периоде.
Продолжительность родов составила 10 ч 40 мин, I период – 9 ч 50 мин, II период – 2 ч 15 мин, III период – 3 ч 35 мин. Безводный период – 6 ч 35 мин. Родился живой доношенный мальчик массой 3880 г, длиной 52 см, с оценкой 8–9 баллов по шкале Апгар. Последовой период осложнился частичным плотным прикреплением плаценты, по поводу чего было выполнено ручное отделение плаценты, выделение последа. Общая кровопотеря составила 350 мл. АЧТВ в родах до переливания СЗП – 38,4 с, ПИ – 81,8%. В раннем послеродовом периоде АЧТВ – 33,6 с, ПИ – 85,8%. На 4-е сут АЧТВ – 38,1 с, ПИ – 84,2%, что свидетельствовало о достижении оптимального гемостатического потенциала.
Роженица выписана домой на 5-е сут после родов в удовлетворительном состоянии. На 16-е сут после родов состояние удовлетворительное. По данным ультразвукового исследования, темпы инволюции матки соответствуют послеродовым нормативам. Полость матки сомкнута. Гемостазиограмма на 16-е сут после родов: фибриноген – 3,2 г/л (норма 4,8–7,4 г/л), ПИ – 81% (норма 90–130%), АЧТВ – 36 с (норма 20–34 с) тромбоэластограмма r+k : 17+7=24 мм (норма 13–20 мм), mа – 50 мм (норма 49–56 мм), индекс тромботического потенциала – 14,2 У.Е. (норма 15–24 У.Е.), растворимый комплекс мономеров фибрина – отрицательный (норма – слабо положительный/положительный). D-димер – 358 мкг/л (норма – до 2000 мкг/л). Указанные особенности гемостазиограммы свидетельствовали о незначитель ной хронометрической и структурной гипокоагуля ции без признаков патологического тромбинообразования и гиперфибринолиза.
Вероятно, в процессе эволюции даже при сочетании коагулопатий геморрагического и тромбофилического характера выработались адаптационные механизмы, направленные на достижение адекватного гемостатического баланса, что создает условия для прогрессирования беременности. В то же время срыв компенсации возможен как в родах, так и в раннем и позднем послеродовых периодах, что связано с десинхронизацией восстановления различных компонентов системы гемостаза.
Таким образом, дифференцированная профилактика геморрагических и тромботических осложнений в родах и послеродовом периоде должна основываться на учете анамнестических данных и динамической оценке параметров системы гемостаза во время беременности.



