На сегодняшний день одним из основных и наиболее эффективных методов лечения бесплодия является экстракорпоральное оплодотворение (ЭКО). Несмотря на усовершенствование эмбрионального этапа программы ЭКО, позволяющего выбрать для переноса в полость матки эмбрионы высокого качества, частота наступления беременности при переносе эмбрионов остается достаточно низкой, составляя, по данным Европейской ассоциации мониторинга ЭКО в 2017 г., 34,6% для ЭКО и 33,5% для интрацитоплазматической инъекции сперматозоида в ооцит (ИКСИ) [1].
Ведущую роль в процессе имплантации играет рецептивность эндометрия, которая зависит от морфофункциональных характеристик эндометрия, формируемого благодаря динамическому взаимодействию множества эндокринных и иммунологических факторов [2]. Присутствие в семенной плазме (СП) широкого спектра стероидных гормонов, нейромедиаторов, цитокинов и факторов роста свидетельствует о потенциальной роли СП в регуляции динамического ремоделирования эндометрия в течение каждого менструального цикла [3]. В многочисленных исследованиях in vitro было установлено, что СП человека активирует ряд транскрипционных регуляторных путей, лежащих в основе децидуализации – морфологических и функциональных изменений клеток эндометрия во время секреторной фазы цикла, играющих ключевую роль в имплантации эмбриона [4–7].
В связи с этим неоднократно предпринимались попытки использования СП в программах вспомогательных репродуктивных технологий (ВРТ). Однако результаты, полученные при использовании искусственного введения СП в репродуктивный тракт женщины во время процедур ЭКО/ИКСИ, противоречивы. Сообщалось как об увеличении частоты имплантации [8, 9], так и об отсутствии эффекта [10, 11]. В ряде работ выявлялась статистически недостоверная тенденция к увеличению частоты наступления беременности [12–14]. В раннем исследовании сообщалось о повышении частоты наступления беременности при половых контактах при переносе гамет в фаллопиеву трубу [15], однако подтвердить эффект половых контактов в программе ЭКО/ИКСИ не удалось [16, 17].
В Кокрейновском обзоре сделан вывод о низком уровне доказательности работ, утверждающих, что применение СП в цикле ЭКО/ИКСИ может увеличивать частоту наступления беременности [18].
Главной причиной негативных результатов трансляционных исследований может быть различный состав СП, использованной в экспериментальных работах и при клинических испытаниях. Данные о благоприятном влиянии СП на имплантацию эмбрионов были получены в исследованиях на животных [3] или при культивировании in vitro клеток эндометрия человека в присутствии СП здоровых и/или фертильных доноров [4–7]. В то же время в программах ВРТ использовалась СП пациентов, состоящих в бесплодном браке. Очевидно, что иммуногормональный профиль СП пациентов, включенных в программу ЭКО/ИКСИ, может быть изменен под воздействием стресса и других неблагоприятных факторов.
Стресс – это состояние организма, характеризующееся активацией адаптационных нейроиммуноэндокринных реакций в ответ на воздействие различных факторов (физических или психологических). Многочисленные исследования показали, что как женщины, так и их половые партнеры, участвующие в программах ВРТ, могут испытывать стресс, связанный с бесплодием и/или лечением бесплодия [19–23].
Важнейшими стресс-реализующими системами организма являются гипоталамо-гипофизарно-адренокортикальная система (ГГАКС) и симпато-адреналовая система. Стимуляция ГГАКС индуцирует секрецию стероидных гормонов: кортизола, дегидроэпиандростерона (ДГЭА) и его основного метаболита – ДГЭА-сульфата (ДГЭАС), а также прогестерона корой надпочечников [24]. Адреналовые стероиды являются широко используемыми нейроэндокринными биомаркерами, которые позволяют объективно измерять физиологическую реакцию на психосоциальные стрессоры [25]. Активация симпато-адреналовой системы при стрессе приводит к стимуляции гипоталамо-гипофизарно-гонадальной оси и увеличению выработки тестостерона в яичках [26]. Таким образом, тестостерон и прогестерон также могут квалифицироваться как «гормоны стресса».
Эффективность стрессорных реакций обеспечивается за счет тесного взаимодействия нейроэндокринной и иммунной систем [27]. Психологический стресс является индуктором асептических воспалительных реакций, сопровождающихся повышением уровня цитокинов – интерлейкина (IL)-18 [28] и IL-1β [29].
Ранее мы подтвердили, что влияние СП на эффективность ЭКО определяется уровнем маркеров стресса в СП [30, 31]. Благоприятное влияние СП на имплантацию выявлялось у пациентов с низким уровнем маркеров стресса, при этом частота наступления беременности составляла 61,2%. Высокий уровень иммуногормональных маркеров стресса в СП, выявленный у 31% пациентов, был связан с низкой частотой наступления клинической беременности (9,1%).
Мы предположили, что одним из наиболее вероятных механизмов негативного влияния СП на репродуктивный тракт женщины (РТЖ) может быть изменение морфофункциональных характеристик эндометрия под воздействием экзогенных цитокинов и стероидных гормонов, содержащихся в повышенных количествах в СП при стрессе у полового партнера.
Формирование эндометрия контролируется стероидными гормонами яичников: эстрадиолом и прогестероном и андрогенами (тестостероном, ДГЭА и ДГЭАС) а также сбалансированной динамической секрецией цитокинов иммунокомпетентными клетками [32]. Поэтому поступление избыточной концентрации экзогенных гормонов и цитокинов СП в РТЖ может создавать состояние «локальной гиперандрогении, гиперпрогестеронемии и гиперцитокинемии» и нарушать межклеточные взаимодействия, вовлеченные в репарацию эндометрия.
Недавно было убедительно продемонстрировано, что нарушения рецептивности эндометрия и неудачи имплантации эмбриона ассоциированы с дефектами формирования эндометрия в фазе пролиферации [33]. Таким образом, влияние СП на эффективность ЭКО может быть реализовано при незащищенных половых контактах во время пролиферативной фазы цикла ЭКО/ИКСИ.
Адекватная структура и толщина эндометрия как в период введения триггера овуляции, так и в период «окна имплантации» считаются одними из значимых факторов, определяющих исходы программ ВРТ [34, 35].
Поэтому целью исследования явилась оценка зависимости толщины эндометрия, сформированного на фоне половых контактов в пролиферативную фазу цикла ЭКО/ИКСИ, от содержания в СП половых партнеров иммунологических и эндокринных маркеров стресса.
Материалы и методы
В проспективное исследование были включены супружеские пары с трубно-перитонеальным фактором бесплодия (n=71), проходившие лечение в ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России. Все пациенты были обследованы в соответствии с приказом Минздрава России № 107н от 30.08.2012 «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению». Все манипуляции, связанные с реализацией протоколов ЭКО/ИКСИ, выполнялись специалистами отделения вспомогательных технологий в лечении бесплодия имени профессора Б.В. Леонова ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России согласно ранее утвержденному протоколу комиссии по этике биомедицинских исследований.
Критерии включения для женщин: возраст ≤41 года; трубно-перитонеальный фактор бесплодия; сохраненный овариальный резерв; регулярный менструальный цикл; нормальный кариотип; нормальное анатомическое строение матки; отсутствие выраженной экстрагенитальной патологии; отсутствие урогенитальных инфекций, хронических воспалительных заболеваний органов малого таза и системных аутоиммунных заболеваний; не более 2 безуспешных попыток ЭКО/ИКСИ; регулярная половая жизнь без контрацепции.
Критерии включения для мужчин: возраст ≤49 лет; нормальный кариотип; отсутствие выраженной экстрагенитальной патологии; отсутствие выраженной патозооспермии; отсутствие антиспермальных антител (ΜΑR≤10%); отсутствие приема лекарственных средств со спермотоксичным действием; отсутствие химиотерапевтического воздействия и радиоизлучения; отсутствие урогенитальных инфекций, хронических воспалительных заболеваний органов малого таза и системных аутоиммунных заболеваний; регулярная половая жизнь без контрацепции.
Критерии невключения для женщин: cоматические заболевания, являющиеся противопоказаниями для вынашивания беременности и родов; эндокринное, иммунологическое, маточное бесплодие; наличие синдрома поликистозных яичников; наружный и внутренний эндометриоз III и IV стадии; интерстициальная или субсерозная миома матки размером более 3 см; использование донорской яйцеклетки или применение суррогатного материнства. Критерии невключения для мужчин: патозооспермия III–IV степени; наличие антиспермальных антител (MAR>10%); эректильная дисфункция. Критерии исключения: толщина эндометрия в день введения триггера овуляции ≤8 мм; синдром гипеρстимуляции яичников у пациенток; содержание лейкоцитов в эякуляте >1 млн/мл у половых партнеров.
Овариальную стимуляцию выполняли по протоколу с использованием антагониста гонадотропин-рилизинг-гормона (антГнРГ). Стимуляцию функции яичников проводили рекомбинантным ФСГ и/или человеческими менопаузальными гонадотропинами. Введение антГнРГ начиналось при достижении 3 и более фолликулов диаметра 14–15 мм. При достижении лидирующими фолликулами предовуляторного размера (17–18 мм) вводили триггер овуляции хорионический гонадотропин в дозе 5000–10 000 ЕД. Трансвагинальная пункция яичников (ТВП) проводилась через 35–36 ч после введения триггера. Введение 0,5 мл СП партнера в задний свод влагалища осуществляли сразу после ТВП. В зависимости от параметров спермы оплодотворение полученных ооцитов было выполнено методом ЭКО или ИКСИ. Перенос одного эмбриона хорошего качества по классификации D. Gardner и W. Schoolcraft [36] осуществляли на 5-е сутки после ТВП. С целью поддержки лютеиновой фазы индуцированного цикла использовали препарат микронизированного прогестерона. У пациенток были незащищенные половые контакты с 4–5-го до 11–12-го дня менструального цикла с последующей отменой половых контактов до результата анализа крови на беременность. Клиническую беременность регистрировали при визуализации плодного яйца в полости матки через 21 день после переноса эмбриона. Живорождение определялось как рождение по крайней мере одного ребенка живым и прожившим более 1 месяца.
Оценку толщины эндометрия проводили с помощью трансвагинального датчика в сагиттальном сечении перпендикулярно срединной линии соприкосновения слоев эндометрия с миометрием в день назначения триггера овуляции. Все трансвагинальные ультразвуковые исследования проводились с использованием ультразвукового прибора BK Medical Flex Focus 500.
Образцы спермы получали в день ТВП с помощью мастурбации после 3–5-дневного периода сексуального воздержания. Стандартный анализ спермы выполняли в соответствии с протоколом Всемирной организации здравоохранения (ВОЗ) [37]. Для оценки содержания лейкоцитов в эякуляте использовался метод проточной цитофлуориметрии [38]. Реакцию смешанной агглютинации (mixed agglutination reaction, MAR-тест) проводили с использованием наборов SpermMar (FertiPro, Beernem, Бельгия) в соответствии с протоколом ВОЗ [37]. После центрифугирования эякулята 0,5 мл СП использовали для интравагинального введения. Оставшийся объем СП аликвотировали и затем хранили при -80°C для последующего выявления цитокинов и стероидов.
На основании исходов проспективного исследования были сформированы 2 группы пациентов с низким и высоким уровнем общего количества IL-18 в СП половых партнеров (≤1432,4 пг, n=48 и >1432,4 пг, n=23). Низкий и высокий уровень IL-18 определяли на основании точки отсечки (cut-off), определенной с помощью ROC-анализа уровня IL-18 в СП при прогнозировании наступления беременности, описанного ранее [30].
В ретроспективное исследование были включены две группы пациентов, сформированные на основании исходов ЭКО/ИКСИ, клинико-демографических и лабораторных показателей, данных о содержании в СП цитокинов IL-18 и IL-1β, стероидных гормонов, их предшественников и метаболитов, определенных в ходе проспективного исследования. В группе 1 с наступившей беременностью (n=7) уровень иммуноэндокринных маркеров стресса был выше по сравнению с группой 2 с отсутствием беременности (n=9), при этом группы были сопоставимы по клинико-демографическим и лабораторным показателям. Критерии включения для женщин: возраст ≤41 году, для мужчин: возраст ≤43 годам. Критерии включения для всех участников исследования: 18 кг/м2 ≤ индекс массы тела (ИМТ) ≤ 28 кг/м2; отсутствие вредных привычек.
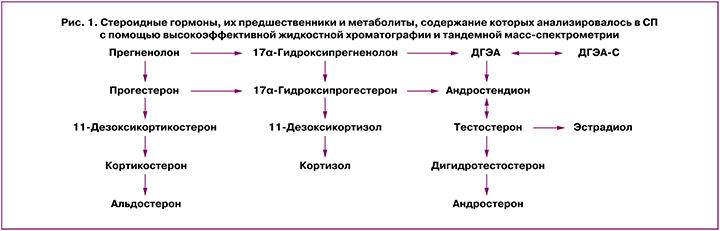
Оценку цитокинового статуса СП проводили с помощью метода проточной цитофлуориметрии и флуоресцентных микросфер с использованием технологии FlowCytomix и наборов для выявления IL-18 (Human IL-18 and IL-1β Simplex Kits, Bender MedSystems, Австрия). Использовали проточный цитофлуориметр FACSCalibur (BD Biosciences, США) и программу BD CellQuest Pro software version 5.2.1 (BD Biosciences, США) [30, 31]. Для оценки содержания в СП стероидных гормонов, их предшественников и метаболитов (рис. 1) была применена комбинация высокоэффективной жидкостной хроматографии и тандемной масс-спектрометрии [31].
Статистический анализ
Статистический анализ проводился с использованием MedCalc 19.2.5. Для проверки нормальности распределения данных, включенных в ретроспективное исследование, использовали тест Шапиро–Уилка. При анализе толщины эндометрия в проспективном и ретроспективном исследовании была подтверждена нормальность распределения в каждой из двух сравниваемых групп (P>0,20), поэтому сравнение толщины эндометрия проводили с помощью t-критерия Стьюдента. При проверке каждой из 2 групп, включенных в ретроспективное исследование, была отклонена нормальность распределения для большинства параметров, приведенных в таблицах 1, 2 и 3 (P<0,05), поэтому сравнения между группами проводились с использованием U-критерия Манна–Уитни. Для описания количественных данных, имеющих нормальное распределение, использовали среднее арифметическое (М) и стандартное отклонение (SD), в формате М (SD). Величину различий описывали в виде разности средних значений с 95% доверительным интервалом (ДИ). При распределении признаков, отличающемся от нормального, их описывали в виде медианы (Me) и интерквартильного интервала в формате Me (Q1; Q3). Количественные данные описывали в виде медианы (Me) и интерквартильного интервала в формате Me (Q1; Q3). Величину различий описывали в виде разности медиан с 95% доверительным интервалом (ДИ) с помощью оценки Ходжеса–Лемана. Различия между категориальными переменными были проанализированы с помощью χ2-критерия. Коэффициенты корреляции Пирсона (r) рассчитывали для определения корреляции между толщиной эндометрия и иммуногормональными параметрами спермы после логарифмического преобразования данных. За критерий значимости принимали Р≤0,05.
Результаты и обсуждение
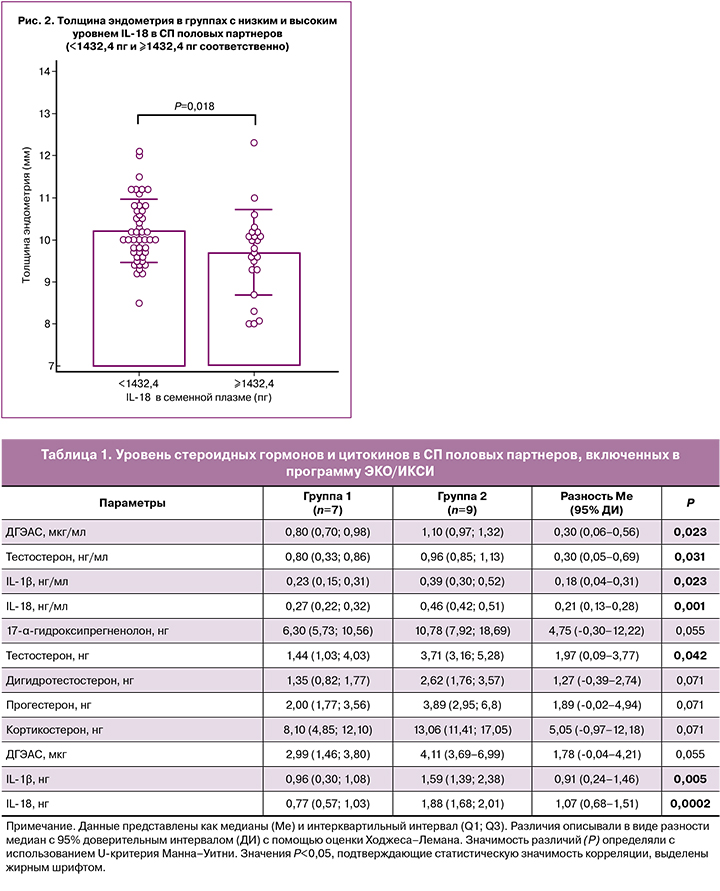
Данные проспективного исследования позволили выявить зависимость толщины эндометрия от общего содержания IL-18 в СП полового партнера (рис. 2). Толщина эндометрия у пациентов с высоким уровнем IL-18 в СП составляла 9,7 (1,0) мм и значимо отличалась от толщины эндометрия в группе с низким уровнем IL-18 (р=0,018), составлявшей 10,2 (0,7) мм. Разность средних с 95% ДИ составила -0,5 (-0,9–-0,1) мм.
Слабость различий могла быть обусловлена наличием целого ряда конфаундеров, определяющих снижение толщины эндометрия. Гетерогенность исследуемой выборки, включающей группу пациентов с отсутствием беременности и отсутствием маркеров стресса в СП (26,8%) [30], также могла ослабить выраженность зависимости толщины эндометрия от уровня иммуногормональных маркеров в СП.
Для того чтобы получить более значимое подтверждение влияния стресса у полового партнера на РТЖ, было проведено ретроспективное пилотное исследование, включающее селективно отобранные группы пациентов, сформированные в соответствии с исходами ЭКО/ИКСИ, клинико-демографическими и лабораторными показателями у половых партнеров и уровнем иммуногормональных маркеров стресса в СП. Группа пациентов с отсутствием беременности, не связанным с наличием маркеров стресса в СП, была исключена из исследования. Следует отметить, что увеличение содержания провоспалительных цитокинов в СП также может быть связано с курением [39] и ожирением [40]. По этой причине курящие пациенты и пациенты с повышенным ИМТ были исключены из настоящего исследования.
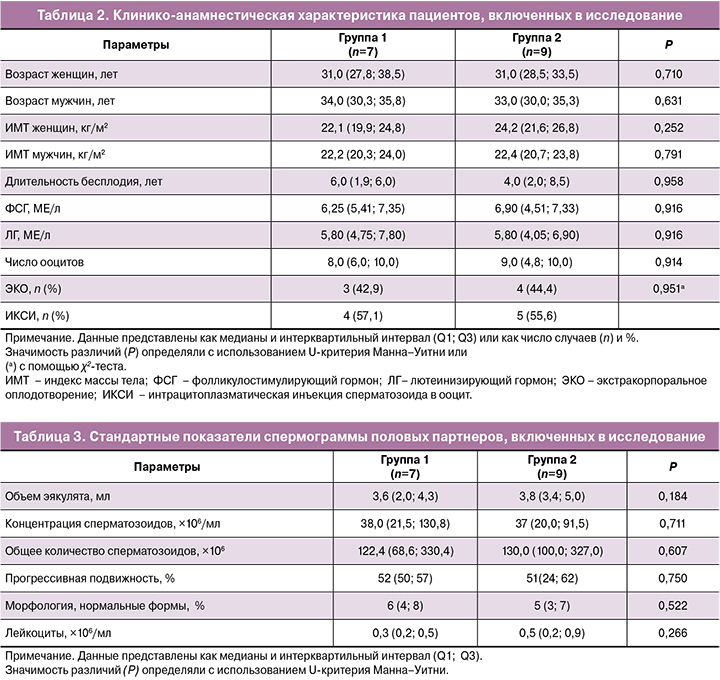
В таблице 1 представлены данные, полученные при сравнении уровня иммуноэндокринных маркеров стресса в СП половых партнеров двух групп. В группе 2 была повышена концентрация ДГЭАС, тестостерона и цитокинов IL-18 и IL-1β в СП и общее количество тестостерона и цитокинов IL-18 и IL-1β в СП. Повышение общего количества 17-α-гидроксипрегненолона, дигидротестостерона, прогестерона, кортикостерона и ДГЭАС в СП пациентов группы 2 было близко к статистической значимости (P≤0,071). Различий в содержании 17-α-гидроксипрогестерона, кортизола, ДГЭА, андростерона, 11-деоксикортикостерона и альдостерона выявлено не было (P>0,1; данные не представлены). Концентрации прегненолона, эстрадиола и 11-деоксикортизола, в СП были меньше нижнего предела количественного определения.
Отсутствовали различия между параметрами спермограммы (табл. 2) и между клиническим профилем и лабораторными показателями у половых партнеров (табл. 3). Возраст и ИМТ в двух группах не отличались как у женщин (Р=0,711 и Р=0,252 соответственно), так и у мужчин (Р=0,633 и Р=0,791 соответственно).
При этом толщина эндометрия была ниже у пациенток второй группы по сравнению с первой группой (P=0,027), составляя 9,6 (0,9) и 10,6 (0,7) мм соответственно. Разность средних с 95% ДИ составила – 1,0 (-1,9–-0,1) мм.
Различия между группами, касающиеся толщины эндометрия, были более выражены в ретроспективном исследовании по сравнению с проспективным исследованием (разница средних составляла -0,5 мм и 1,0 мм соответственно).
Таким образом, нами была сформированы группы пациентов, которые отличались исходами ЭКО/ИКСИ, уровнем маркеров стресса в СП и толщиной эндометрия при одинаковом уровне клинико-лабораторных показателей у мужчин и женщин.
Предполагая, что цитокины и гормоны, поступающие в РТЖ при половых контактах, могут влиять на формирование эндометрия, оценивали зависимость толщины эндометрия от содержания 16 стероидных гормонов и цитокинов IL-18 и IL-1β – иммуногормональных маркеров стресса в СП (табл. 4). Наблюдалась негативная корреляция между толщиной эндометрия и концентрацией в СП 17-α-гидроксипрегненолона, тестостерона, прогестерона, IL-18 и IL-1β. Негативная корреляция была выявлена также между толщиной эндометрия и общим количеством 17-α-гидроксипрегненолона и прогестерона в СП. Позитивная корреляция была выявлена между толщиной эндометрия и соотношением кортизол/ДГЭА.
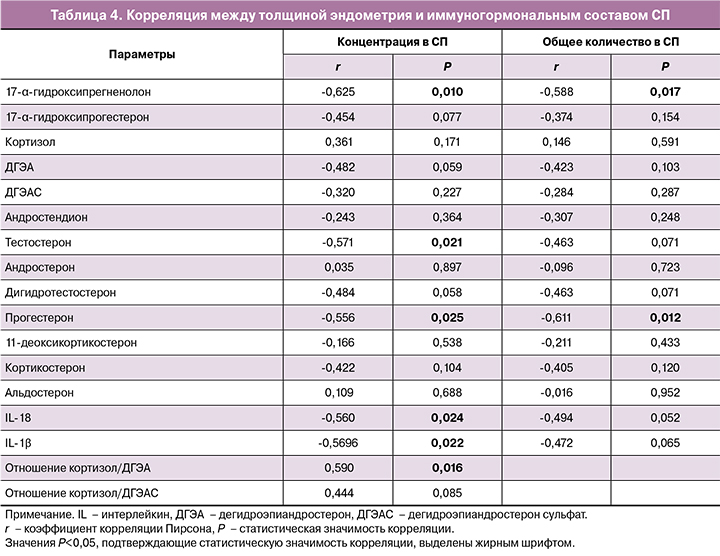
Полученные нами данные о негативной ассоциации содержания в СП тестостерона и его предшественника 17-α-гидроксипрегненолона согласуются с выявленными ранее негативными эффектами повышенной концентрации эндогенных и экзогенных андрогенов (тестостеронa, ДГЭА и ДГЭАС) на морфофункциональное состояние эндометрия.
Эндометрий человека представляет собой многоклеточную ткань-мишень для стероидов, которая подвергается динамическому ремоделированию в течение каждого менструального цикла. Основными факторами, которые лежат в основе увеличения толщины эндометрия, является пролиферация клеток эндометрия и ангиогенез, достигающие максимальной активности в среднюю пролиферативную фазу [41]. Оба эти процесса контролируются стероидными гормонами яичников: эстрадиолом и прогестероном. Андрогены и их рецепторы, которые экспрессируются в железах, поверхностном эпителии и строме эндометрия, также играют важную роль в структурно-функциональном ремоделировании эндометрия [42, 43]. Установлено, что андрогены оказывают прямое воздействие как на эпителиальные, так и на стромальные клетки эндометрия, демонстрируя антипролиферативный эффект в нормальном эндометрии [44] и сдерживая прогрессирование гиперплазии при эстрогензависимых злокачественных новообразованиях [45].
В то же время при избытке эндогенных и экзогенных андрогенов усиление их антипролиферативного действия может отражаться на состоянии эндометрия. Введение андрогенов женщинам при смене пола приводит к атрофии эндометрия [46]. Увеличение концентрации ДГЭА, ДГЭАС и тестостерона в крови у женщин является биохимическим диагностическим маркером гиперандрогении – одной из распространенных причин нарушения репродуктивной функции у женщин [47]. Выявлена тесная корреляция между биохимической формой гиперандрогении и нарушением морфологии и функций эндометрия [48].
Таким образом, выявленная в работе ассоциация повышенного содержания андрогенов в СП со снижением толщины эндометрия согласуется с установленным в многочисленных исследованиях нарушением морфологии и функций эндометрия при избытке андрогенов.
Нами была выявлена зависимость толщины эндометрия как от концентрации, так и от общего количества иммуногормональных компонентов в СП. Семенные компоненты при интравагинальном введении СП доставляются в матку с помощью уникальной системы быстрого транспорта за счет диффузии молекул из лимфатических и венозных сосудов влагалища в артериальную систему матки [49]. Этот тип доставки обеспечивает перенос в матку большей части биологически активных молекул, содержащихся в СП. Таким образом, при половой жизни в цикле ЭКО может реализовываться влияние как концентрации, так и общего содержания иммуногормональных факторов в СП на состояние эндометрия.
Так, например, было обнаружено выраженное уменьшение толщины эндометрия при повышении общего количества прогестерона в СП. Хотелось бы отметить, что в пролиферативную фазу менструального цикла прогестерон продуцируется в незначительных количествах, и его концентрация в сыворотке крови обычно не превышает 1,5 нг/мл; в то же время общее количество прогестерона, определяемое в СП пациентов группы 2, варьировало от 2,0 нг до 9,3 нг. Таким образом, весьма вероятно, что значительное усиление поступления прогестерона при половых контактах может приводить к локальному избытку прогестерона в эндометрии.
Антипролиферативные эффекты прогестерона описаны в многочисленных исследованиях. Известно, что прогестерон ограничивает пролиферацию, обусловленную эстрогенами, о чем свидетельствует снижение частоты рака эндометрия у пациенток, использующих заместительную гормональную терапию, включающую синтетические аналоги прогестерона [50]. Повышение уровня прогестерона в ранней лютеиновой фазе приводит к подавлению экспрессии рецепторов эстрогенов и ослаблению эстроген-опосредованной пролиферации эпителия эндометрия, что является необходимым условием для успешной имплантации [51]. В то же время, антипролиферативные эффекты прогестерона в фолликулярную фазу могут приводить к ингибированию регенерационных процессов и, соответственно, к снижению толщины эндометрия.
Необходимо отметить, что выраженные эффекты поступления в РТЖ гормонов могут быть обусловлены не только их повышенным содержанием в СП, но и высоким уровнем экспрессии рецепторов андрогенов и прогестерона, достигающих максимума в пролиферативную фазу [52, 53], а также усиливающем действием андрогенов на экспрессию рецепторов прогестерона в фазу пролиферации [54].
Полученные данные позволяют предположить, что повышение содержания провоспалительных цитокинов IL-18 и IL-1β в СП также может негативно влиять на состояние эндометрия, нарушая сбалансированность локальных иммунных реакций [32, 55].
Толщина эндометрия может являться маркером функционального состояния эндометрия, измененного под влиянием компонентов СП. Так, исследования на животных показали, что тестостерон является отрицательным регулятором выработки гранулоцитарно-макрофагального колониестимулирующего фактора, ключевого иммунорегулятора имплантации эмбриона, клетками эндометрия [56]. В исследованиях in vitro было установлено, что у пациентов с синдромом поликистозных яичников тестостерон ингибирует экспрессию HOXA10, фактора транскрипции, необходимого для контроля развития, дифференцировки и формирования рецептивности эндометрия [57]. Также было показано, что ДГЭА ингибирует пентозофосфатный путь метаболизма глюкозы в стромальных клетках эндометрия как человека, так и мыши, что предотвращает процесс децидуализации и имплантации [58].
При интерпретации результатов текущего исследования необходимо учитывать ряд ограничений. Первое из них – это небольшое число пациентов, что может приводить к статистической ошибке II типа. Это является следствием селективного отбора пациентов с использованием строгих критериев включения и исключения.
Ограниченное число наблюдений не позволяет провести многофакторный регрессионный анализ для оценки вклада каждого из исследуемых показателей в изучаемую взаимосвязь толщины эндометрия и состава СП.
Необходимо отметить также, что исследование не позволяет установить причинно-следственную связь между стресс-зависимыми факторами СП и толщиной эндометрия, поскольку существенным конфаундером может являться стресс у женщины, ассоциированный со стрессом у полового партнера [59]. Хотя необходимо отметить, что доказательства влияния стресса у женщин на исходы ЭКО/ИКСИ отсутствуют.
Очевидно, что выявленные закономерности, подтвержденные для уникальной группы половых партнеров, демонстрирующих высокий уровень стресса, не следует экстраполировать на всю популяцию пациентов программы ЭКО/ИКСИ. Результаты проведенного исследования подтверждают, что отсутствие какого-либо заметного влияния СП на частоту наступления беременности при лечении ЭКО/ИКСИ может быть связано с неоднородностью мужской популяции, участвующей в программах ЭКО, в отношении степени и интенсивности стрессовых реакций, определяемых генетическими и эпигенетическими факторами [60].
Заключение
Экспрессия маркеров стресса в СП может быть ключевым патогенетическим фактором нарушения имплантации эмбриона у женщин при половых контактах с партнерами, испытывающими стресс в цикле ЭКО. В то же время, контакты с партнерами, устойчивыми к стрессу, СП которых характеризуется сбалансированным составом цитокинов и гормонов, могут приводить к существенному повышению частоты наступления беременности. Если влияние семенных факторов, связанных со стрессом, на морфофункциональное состояние эндометрия будет подтверждено, персонифицированный режим половой жизни, зависящий от уровня стресса у полового партнера, потенциально может повысить частоту наступления беременности путем отмены или рекомендации незащищенных половых актов в цикле ЭКО/ИКСИ.
Очевидно, что необходимы дальнейшие исследования для подтверждения обнаруженных закономерностей и понимания физиологического механизма, лежащего в основе взаимосвязи между мужской нейроэндокринной функцией и женской репродуктивной системой.



