Работа частично поддержана Государственным контрактом Министерства образования и науки РФ №16.522.12.2009 от 29.09.2011.
В состав микрофлоры влагалища входит свыше 400 видов микроорганизмов, включая условно-патогенные [1]. В норме преобладают бактерии рода Lactobacillus. Доминирование лактобактерий в составе микробиоценоза влагалища определяется насыщенностью организма женщин эстрогенами, которые индуцируют накопление в вагинальном эпителии гликогена, являющегося идеальным субстратом для роста лактобактерий. Лактобактерии расщепляют гликоген с образованием молочной кислоты, которая поддерживает рН среды на низком уровне (3,8–4,5), что ограничивает рост условно-патогенных микроорганизмов (УПМ). Защитные механизмы лактобактерий обусловлены также выработкой бактериоцинов и перекиси водорода [2]. Исследования последних лет показали, что лактобактерии выделяют во внеклеточную среду экзополисахариды, способствующие их адгезии на слизистом эпителии, обеспечивающие стабильность мукозального слоя слизистых оболочек и резистентность к УПМ [3].
Описано около 120 видов лактобактерий, входящих в состав микробиоценозов, из них только 20 видов колонизируют слизистую влагалища [2]. При этом чаще всего основу микробиоты влагалища здоровых женщин репродуктивного возраста составляют 4 вида: Lactobacillus crispatus, L. iners, L. gasseri и L. jensenii [4]. Несмотря на то, что L. iners в норме присутствует в составе микробиоты влагалища достаточно часто, ее протективное значение остается спорным, а некоторые авторы даже полагают, что L. iners играет роль в патогенезе бактериального вагиноза (БВ) [4].
Цель настоящего исследования состояла в изучении видового и количественного состава лактобактерий у женщин с неспецифическими вагинитами (НВ) и БВ и оценка его влияния на состояние локального иммунитета влагалища.
Материал и методы исследования
Проведено клинико-лабораторное обследование 377 женщин в возрасте от 19 до 45 лет (средний возраст составил 29±5,4 года), которое включало сбор анамнестических данных, жалоб пациенток, осмотр вульвы, влагалища и шейки матки в зеркалах, бимануальное гинекологическое исследование. В качестве специальных методов исследования использовали микроскопию мазков, окрашенных по Граму, культуральное исследование, исследование микрофлоры влагалища методом количественной полимеразной цепной реакции (ПЦР) в режиме реального времени и анализ уровня экспрессии 11 генов, участвующих в иммунном ответе. Материалом для лабораторного исследования служили вагинальное отделяемое и клетки соскобов слизистой влагалища.
Пациентки были разделены на три группы:
I группа – пациентки с признаками вагинита (n=157). В I группе пациенток выявлено наличие воспалительной реакции со стороны слизистой влагалища и шейки матки, количество лейкоцитов в мазке по Граму было более 10 в поле зрения. Пациентки предъявляли жалобы на обильные выделения из половых путей (79,5%), зуд (40,4%), жжение во влагалище (32,9%), неприятный запах из половых путей (13,7%), диспареунию (9,9%), дизурические расстройства (3,7%).
II группа – женщины с БВ (n=46). Диагноз поставлен на основании трех из четырех критериев Амсела: наличие патологических выделений, рН>4,5, положительный аминный тест, а также выявление «ключевых клеток» в мазках, окрашенных по Граму (при количестве лейкоцитов в мазке менее 10 в поле зрения). Пациентки II группы предъявляли жалобы на обильные выделения (60,9%) и наличие неприятного запаха из половых путей у каждой 3-й пациентки (30,4%). Вместе с тем зуд (8,7%, р=5,8х10-5) и жжение (6,5%, р=0,0004) во влагалище встречались реже, чем в I группе пациенток. Диспареуния и дизурические расстройства отмечены в 2,2% и 0% случаев соответственно. У 30,9% БВ протекал бессимптомно.
III группа – условно здоровые женщины, которые не предъявляли жалоб (n=174). Признаков воспалительных заболеваний половых путей при гинекологическом обследовании выявлено не было. Однако по результатам лабораторного исследования у 25 пациенток данной группы имело место наличие в мазках Ureaplasma spp. в количестве более 4lg/мл, а у 29 – кандиданосительство. Эти женщины были исключены из группы условно здоровых женщин при формировании контрольной группы (n=120).
При количественной оценке биоценоза влагалища учитывали: общее количество бактерий, количество Lactobacillus spp. и 14 основных групп микроорганизмов, представляющих условно-патогенную флору, включая факультативно-анаэробные, облигатно-анаэробные микроорганизмы, а также Candida spp., Ureaplasma spp., Mycoplasma hominis (Фемофлор 16, ДНК-Технология, Россия).
Под нормоценозом понимали вариант биоценоза, при котором доля нормофлоры (Lactobacillus spp.) в его составе была более 80% по отношению к общему количеству бактерий. Относительный нормоценоз расценивали как вариант биоценоза, при котором доля нормофлоры в его составе была более 80%, но количество Ureaplasma spp., M. hominis могло быть более 104 гэ/мл. Под анаэробным и аэробным дисбиозом понимали дисбаланс биоты, обусловленный одним или несколькими УПМ соответственно в количестве более 20% по отношению к общему количеству бактерий. Смешанный дисбиоз – дисбаланс, вызванный сочетанием бактериальной биоты в сочетании с Candida spp. Количество Candida spp. более 103 гэ/мл расценивали как положительный результат: в зависимости от жалоб пациентки, результатов клинического осмотра и микроскопии мазков как вульвовагинальный кандидоз (ВВК) либо как кандиданосительство.
По структуре биоценоза в группе женщин с НВ различали несколько вариантов состояния биоценоза: ВВК (n=37), аэробный дисбиоз (n=14), облигатно-анаэробный дисбиоз (n=23), аэробно-анаэробный дисбиоз (n=12), смешанный дисбиоз (n=25) и нормоценоз (n=39). У 7 пациенток выявлена Ureaplasma spp. более 4lg/мл, которая рассматривалась как возможный этиологический агент вагинита.
В группе женщин с БВ во всех случаях выявлен облигатно-анаэробный дисбиоз. В составе микробиоценоза влагалища у всех женщин III группы доминировали лактобактерии по отношению к общей бактериальной массе.
Типирование лактобактерий проводили с помощью комплекта реагентов (ДНК-Технология, Россия). Оценивали количество 6 основных видов лактобактерий влагалища: L. crispatus, L. iners, L. jensenii, L. gasseri, L. jonsonii, L. vaginalis и 5 биотехнологических видов: L. acidiphilis, L. casei/ L. rhamnosus, L. plantarum, L. fermentum.
Профиль мРНК генов цитокинов (интерлейкинов (IL)-1В, IL-8, IL-10, IL-12А, IL-18, трансформирующего фактора роста (TGF)-β1), транскрипционного фактора GATA3, толл-подобных-рецепторов (TLR4) и других маркеров клеток иммунной системы (CD45, CD68, CD69) в вагинальных мазках исследовали методом количественной ПЦР с обратной транскрипцией. Нормировка полученных результатов осуществялась методом сравнения индикаторных циклов (метод Δ∆Cq) по трем референсным генам TBP, B2M, GUSB. Медианы значений уровней экспрессии мРНК (Ме) в контрольной группе женщин с доминированием L. crispatus были приняты за 1, а значения Ме в исследуемых группах показывало, во сколько раз уровень экспрессии гена выше или ниже по отношению к контрольной группе.
Достоверность межгрупповых различий количественных показателей определяли с помощью критерия Манна–Уитни, качественных показателей –χ2-критерия с поправкой Йетса для малых выборок.
Результаты исследования
При исследовании лактобактерий было выявлено, что основными преобладающими видами в составе лактофлоры (более 50 % по отношению к суммарному количеству лактобактерий) были только 4 вида лактобактерий: L. crispatus, L. iners, L. jensenii, L. gasseri (рис. 1 см. на вклейке). В зависимости от группы исследования доля образцов с L. crispatus в качестве основного вида в составе лактофлоры составила от 17 до 52%, L. iners – 27–48%, L. gasseri – 3–30%, L. jensenii – 0–16%, других видов – до 5%. Необходимо отметить, что в контрольной группе лактобактерии были доминирующим видом, составляющим основную часть бактериальной массы (не менее 80%). В то время как при НВ и БВ количество лактобактерий по отношению к общей бактериальной массе было сниженным (менее 80%) вплоть до полного отсутствия, а количество УПМ превышало 20%. Поэтому учитывали долю отдельных видов лактобактерий в составе лактофлоры.
 Преобладание L. crispatus в составе лактофлоры ассоциировано с нормальным состоянием микробиоты влагалища. Преобладание L. crispatus составило 50% и было статистически более значимым в контрольной группе, чем в группе женщин с НВ – 17% (OR=5 (2,9–8,6), p=2,5×10-9) и БВ – 17% (OR=4.8 (2–11), p=1,3×10-4).
Преобладание L. crispatus в составе лактофлоры ассоциировано с нормальным состоянием микробиоты влагалища. Преобладание L. crispatus составило 50% и было статистически более значимым в контрольной группе, чем в группе женщин с НВ – 17% (OR=5 (2,9–8,6), p=2,5×10-9) и БВ – 17% (OR=4.8 (2–11), p=1,3×10-4).
Напротив, доля образцов с преобладанием L. iners в составе лактофлоры была выше при дисбиотических процессах и составила 48% при НВ (OR=4,4 (1,9–9,9), p=2,2×10-4), 38% – при кандиданосительстве (OR=2,9 (1–8,5), p=0,046), 48% – при относительном нормоценозе (OR=5 (1,5–13,1), p=6,2×10-3) в сравнении с контрольной группой (27%). Аналогичная тенденция была получена и для группы женщин с БВ (р=0,09).
Кроме того, с неблагоприятным состоянием микробиоты, вероятно, ассоциировано и преобладание в составе лактофлоры L. gasseri. В группе женщин с БВ достоверно чаще отмечено наличие L. gasseri как основного вида в составе нормофлоры – 30% по сравнению с контрольной группой – 8% (OR=5,4 (2,1–13,6), p=1,3×10-4). Аналогичная тенденция получена и для группы с НВ (р=0,08). При НВ и БВ выявлены образцы без лактобактерий. Их доля составила 4% при НВ и 9% при БВ.
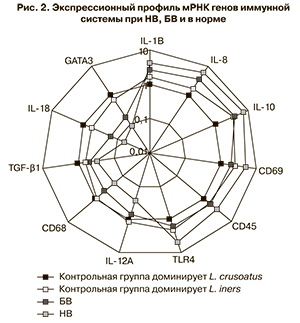
При исследовании экспрессионного профиля было установлено, что НВ сопровождается достоверным повышением уровня экспрессии мРНК IL-1В в 4,1 раза (р=1,4×10-9), IL-8 в 6,3 (р=5,8×10-10), IL-10 в 7 (р=1,9×10-14), CD69 в 4,6 (р=5×10-9), CD45 в 3 (р=7×10-9), TLR4 в 4,5 (р=1,1×10-12) и снижением IL-12А в 3,8 (р=3,3×10-8), CD68 в 4 (р=4,2×10-15), TGF-β1 в 3,1 (р=7,9×10-9), IL-18 в 15,6 (р=1,4×10-18), GATA3 в 11,5 раза (р=1,5×10-18) по сравнению с образцами контрольной группы, в которых доминирует L.crispatus (рис. 2).
Аналогичные изменения экспрессионного профиля были выявлены и при БВ: повышение уровня экспрессии мРНК IL-1В в 2,6 раза (р=0,02), IL-8 в 3,7 (р=0,002), IL-10 в 3,8 (р=10-5), CD69 в 2,1 (р=0,005), CD45 в 1,8 (р=0,017), TLR4 в 1,6 раза (р=0,032) и снижением IL-12А в 1,5 (р=0,033), CD68 в 2,2 (р=7,2×10-5), TGF-β1 в 2 (р=0,004), IL-18 в 6,5 (р=7,2×10-10), GATA3 в 5,7 раза (р=8,9×10-7) по сравнению с образцами контрольной группы, в которых доминирует L. crispatus.
При исследовании образцов контрольной группы в случаях доминирования L. iners был достоверно повышен уровень экспрессии мРНК генов IL-8 в 1,7 (p=0,026), TLR4 в 2 (p=0,033), IL-10 в 3,8 (p=0,01), CD69 в 2,5 (p=0,005), CD45 в 1,7 (p=0,049) раза и снижен IL-18 в 1,7 (p=0,005) раза по сравнению с образцами, в которых доминирует L. crispatus. Полученные данные согласуются с лучшей протекторной функцией L. crispatus.
Обсуждение
Было выявлено, что в составе нормофлоры наиболее часто встречаются только 4 вида: L. crispatus, L. iners, L. jensenii, L. gasseri. Полученные результаты о преимущественном распространении 4 видов лактобактерий согласуются с литературными данными [4].
По результатам нашего исследования частоты распространения и преимущественного количественного преобладания в составе нормофлоры различных видов лактобактерий в контрольной группе (рис. 1 см. на вклейке) приблизительно соответствуют данным Дж. Равель [5] для белой популяции женщин. Равель, исследовав около 400 образцов влагалищных мазков женщин северо-американского континента, установил, что L. crispatus доминировала в 45,4% случаев, L. iners – в 26,8%, L. gasseri – в 8,2%, L. jensenii – в 9,3% у белых женщин.
Согласно полученным результатам, преобладание L. crispatus в составе лактофлоры ассоциировано с нормальным состоянием микробиоты влагалища. Полученные результаты согласуются с результатами, приведенными в ряде публикаций. Защитная роль лактобактерий обусловлена по меньшей мере двумя факторами – выработкой молочной кислоты и перекиси водорода. В работе Дж. Равель [5] показана зависимость рН-среды от типа микробиоты. Наиболее кислая среда (рН=4,0±0,3) во влагалищном отделяемом была определена при доминировании L. crispatus, рН=4,4±0,6 – при доминировании L. iners. M.A. Antonio и соавт. отмечают, что большинство штаммов L. crispatus, выделенных из влагалища и кишечника, вырабатывают перекись водорода, в то время как большинство штаммов L. iners ее не cинтезируют [6]. Кроме того, R. Rampersaud выделил и охарактеризовал токсин инеролизин, выделяемый L. iners, аналогичный интермедилизину Streptococcus intermedius и вагинолизину Gardnerella vaginalis, роль которых в патогенезе дисбиотических процессов доказана [7].
Показано, что с неблагоприятным состоянием микробиоты, вероятно, ассоциировано и преобладание в составе нормофлоры L. gasseri. Согласно данным литературы большинство штаммов L. jensenii, L. gasseri являются хорошими продуцентами перекиси водорола [8]. Однако, по данным Дж. Равель, при доминировании L. jensenii и L. gasseri влагалищная среда менее кислая (соответственно рН=4,7±0,4 и рН=5,0±0,7), чем при доминировании L. crispatus (рН=4,0±0,3). Verstraelen и соавт. [9], описывая состав микрофлоры влагалища беременных женщин (9 и 32 недели гестации), пришли к заключению, что доминирование L. crispatus обеспечивает стабильное состояние экосистемы. Микрофлора, включающая L. jensenii, вызывает промежуточное состояние стабильности, а при доминировании L. iners и L. gasseri состояние системы наименее стабильно.
Изменения в транскрипционном профиле некоторых генов, ассоциированные с L. iners, аналогичны изменениям, характерным для НВ и БВ, хотя и существенно менее выраженные. Таким образом, преобладание в составе нормофлоры L. iners создает легкий провоспалительный фон.
Заключение
В составе нормофлоры наиболее часто встречаются 4 вида лактобактерий: L. crispatus, L. iners, L. jensenii, L. gasseri. В контрольной группе в составе лактофлоры преобладает L. crispatus. Воспалительные заболевания нижних отделов репродуктивной системы женщин и БВ сопровождаются повышением доли L. iners и L. gasseri в составе лактофлоры. В контрольной группе увеличение доли L. iners в составе лактофлоры оказывает влияние на локальный иммунитет и сопровождается достоверным повышением IL-8, TLR4, IL-10, CD69, CD45 и снижением IL-18 по сравнению с образцами, в которых основным видом лактобактерий является L. crispatus. Повышенную долю L. crispatus в составе лактофлоры можно расценивать как благоприятный прогностический признак при оценке состояния микробиоценоза влагалища. Повышенное количество L. iners и L. gasseri в составе лактофлоры ассоциировано с вагинитами различной этиологии и БВ.



