Эндометриоз является хроническим, эстроген-зависимым, прогрессирующим заболеванием и характеризуется наличием эндометриоидной ткани, желез и стромы вне полости матки [1]. Чаще всего поражаются яичники, маточные трубы и тазовая брюшина. Это заболевание связано с имплантацией эндометриоидно-подобных клеток, сопровождающейся их повышенной пролиферацией и миграцией. Эндометриоз – одна из ведущих причин заболеваемости женщин в фертильном возрасте и во время пременопаузы [2]; оно может привести к самопроизвольному прерыванию беременности и бесплодию в 50% случаев [3]. Золотым стандартом диагностики эндометриоза являются лапароскопия и гистологическое исследование хирургического образца [4]. Наиболее распространенными причинами эндометриоза являются ретроградная менструация, генетическая предрасположенность, лимфогенное распространение, иммунная дисфункция, метаплазия, а также экологические причины. Помимо значительных отрицательных эффектов, касающихся здоровья и благополучия женщин, нельзя игнорировать риск развития эндометриоз-ассоциированного рака яичников [5, 6].
Длинные некодирующие РНК (днРНК) являются большой группой некодирующих РНК длиной более 200 нуклеотидов [7]. ДнРНК, как факторы регуляции, играют важную роль в сложных клеточных процессах: апоптозе, росте, дифференцировке, пролиферации и т.д. Циркулирующие днРНК представляют собой перспективные биомаркеры при различных заболеваниях, включая эндометриоз [8]. Накапливающиеся данные показывают, что днРНК связаны с инициацией и развитием многих типов рака и могут функционировать как онкогены или супрессоры опухолей [9, 10]. По этой причине количество некоторых днРНК сильно изменено в клетках опухолей по сравнению с нормальными тканями.
Ранее было показано, что при эндометриозе яичников наблюдается повышенный уровень аутофагии; этот процесс регулируется днРНК MALAT1 (metastasis associated lung adenocarcinoma transcript 1) и может способствовать выживанию эндометриоидных клеток в эктопических участках и поддержанию поражения эндометрия [11]. Изучение роли днРНК при эндометриозе открывает путь для создания новых диагностических тестов и определения новых терапевтических мишеней [12].
Длинная некодирующая РНК ROR (regulator of reprogramming), по литературным данным, влияет на возникновение и развитие опухолей человека, включая рак груди, колоректальный рак, рак поджелудочной железы, гепатоцеллюлярную карциному и другие [9, 13]. Нарушение регуляции lncROR тесно связано с клинико-патологическими факторами, указывающими на неблагоприятный прогноз.
Важно отметить, что основным патологическим механизмом возникновения таких заболеваний, как эндометриоз, является эпителиально-мезенхимальный переход (ЭМП), для которого показана связь с изменением экспрессии днРНК MALAT1 и ROR [9, 14]. Таким образом, выяснение роли днРНК в нормальных и патологических клетках крайне важно.
Цель исследования: оценить уровень экспрессии длинных некодирующих РНК ROR и MALAT1 в биоптатах ткани яичников, пораженной эндометриозом, относительно группы контроля.
Материалы и методы
В исследовании принимали участие 20 пациенток, которые были разделены на 4 группы: 1-я группа – пациентки с эндометриоидными кистами яичников и гиперплазией эндометрия (n=5); 2-я группа – пациентки с изолированными эндометриоидными кистами яичников (n=5); 3-я группа – пациентки с сочетанием эндометриоидных кист яичников и аденомиоза/миомы матки (n=5); 4-я группа – контрольная (n=5). Критерии включения в исследование для 1-й группы: общие требования – женщины репродуктивного возраста (от 18 до 45 лет); для 2-й группы – пациентки с установленным диагнозом эндометриоза яичников; для 3-й группы – пациентки с установленным диагнозом эндометриоза яичников в сочетании с аденомиозом и/или миомой матки.
К критериям невключения относили: ювенильный, перименопаузальный и постменопаузальный возрастные периоды (младше 18 лет и старше 45 лет), острые воспалительные заболевания, тяжелая экстрагенитальная патология, аутоиммунные заболевания, онкологические заболевания.
В ходе исследования все пациентки предоставляли данные возраста, роста, массы тела. На основании последних двух рассчитывался индекс массы тела (ИМТ) (табл. 1). Исследование было одобрено этическим комитетом ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России, выписка из протокола №33-20, от 25.11.2020.
На первом этапе молекулярно-генетического исследования проводили оперативное лечение лапароскопическим доступом и удаляли эндометриоидную кисту/кисты яичников. При заборе материала от основного препарата отделяли небольшой участок кисты (0,3–0,5 см) и погружали в стерильную пробирку. В каждый образец добавляли 1 мл тризола с целью ингибирования работы РНКаз, затем гомогенизировали и быстро замораживали при температуре -80˚С. Выделение тотальной мРНК проводилось реагентом ExtractRNA BC032 фирмы «Евроген» по методике производителя, синтез первой цепи кДНК – по протоколу набор MMLV RT SK021 фирмы «Евроген». Уровень экспрессии lncROR и MALAT1 определяли методом полимеразной цепной реакции (ПЦР) с обратной транскрипцией в реальном времени с помощью амплификатора LightCycler 96 Real-Time PCR System (Roche) с использованием праймеров, специфичных для 18S, lncROR и MALAT1 (табл. 2). ПЦР проводили при следующих условиях: предварительная инкубация – 150 с при 95°C; трехшаговая амплификация – 20 с при 95°C, 20 с при 60°C, 20 с при 72°C – 45 циклов; детекция температуры плавления продуктов реакции.
Нормирование образцов кДНК проводилось по контрольному гену рибосомальной 18S РНК. Относительные уровни экспрессии генов lncROR и MALAT1 рассчитывали методом 2-ΔΔCT [15]. Отсутствие побочных продуктов ПЦР определяли по кривой плавления. Для каждой пары праймеров во всех образцах наблюдали одинаковые пики плавления. ПЦР каждого образца в 3 повторах. Полученные значения Ct (cycle threshold) для каждого образца не превышали 35.
Результаты и обсуждение
При анализе транскриптома человека в базе данных TCGA (The Cancer Genome Atlas) для эндометриоза был выявлен увеличенный уровень экспрессии днРНК MALAT1 [11]. В ходе нашей работы методом ПЦР в реальном времени мы также показали повышение уровня экспрессии MALAT1 в группах патологий с эндометриоидными кистами яичников (рис. 1).
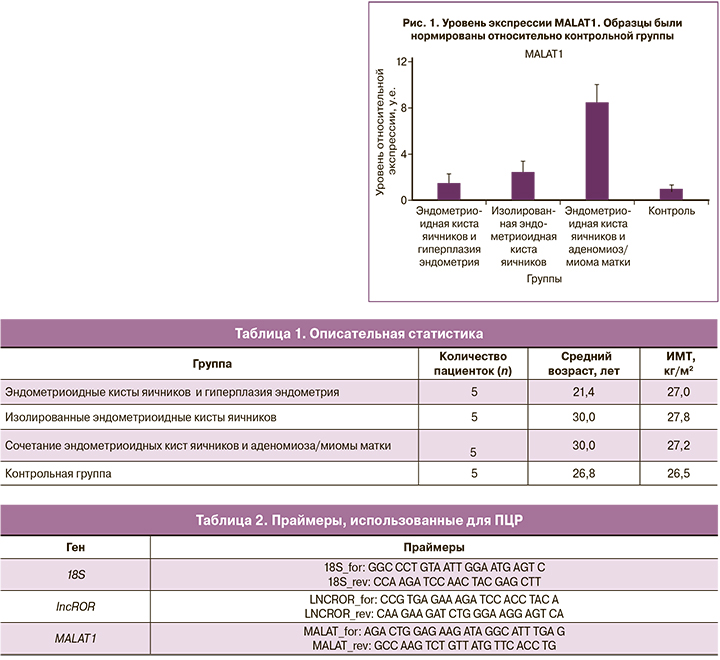
Важно отметить, что, по нашим результатам, уровень экспрессии MALAT1 различается в паталогических подгруппах, и самый высокий уровень экспрессии наблюдается в группе с сочетанными патологиями эндометриоидной кисты яичника и аденомиоза/миомы матки, возникновение которых тесно связано с ЭМП.
Следующим шагом мы определили уровень экспрессии lncROR (regulator of reprogramming). В отличие от MALAT1, lncROR не полиаденилирована, в связи с чем эта днРНК не детектируется при наиболее частом методе пробоподготовки для РНК секвенирования и, таким образом, отсутствует в базах данных, таких как TCGA. Полученные нами результаты показывают, что экспрессия lncROR более чем в 10 раз понижена во всех исследованных патологиях по сравнению с контрольными образцами. Самый низкий уровень экспрессии lncROR наблюдается в изолированных кистах яичников без сочетанных патологий. В группе с гиперплазией эндометрия уровень экспрессии lncROR выше, а наиболее высокий уровень характерен для группы с сочетанием эндометриоидной кисты яичников и аденомиоза или миомы матки (рис. 2). Таким образом, выбранные нами группы значительно отличаются по представленности данной днРНК.
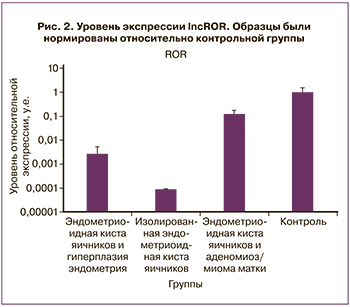 Разница между патологическими группами позволяет сделать вывод, что существует механизм регуляции, ответственный за снижение днРНК ROR в клетках доброкачественных новообразований. Известно, что повышенный уровень экспрессии lncROR связан с выживанием в условиях гипоксии и может подавляться miR-145 в опухолевых клетках. Кроме того, было описано участие lncROR в межклеточном взаимодействии благодаря секреции данной днРНК внутри везикул [16, 17].
Разница между патологическими группами позволяет сделать вывод, что существует механизм регуляции, ответственный за снижение днРНК ROR в клетках доброкачественных новообразований. Известно, что повышенный уровень экспрессии lncROR связан с выживанием в условиях гипоксии и может подавляться miR-145 в опухолевых клетках. Кроме того, было описано участие lncROR в межклеточном взаимодействии благодаря секреции данной днРНК внутри везикул [16, 17].
В работе Chen Yang et al. описана роль днРНК ROR в процессе онкогенеза. LncROR рассматривается как онкоген, влияющий на прогрессирование опухоли, а также как предвестник плохого прогноза для больных раковыми заболеваниями [9]. Таким образом, можно предположить, что заболевания, работа с которыми велась в нашем исследовании, остаются доброкачественными по причине низкого уровня lncROR, а при его повышении возможен переход в злокачественные формы. В соответствии с этим было показано, что уровень экспрессии lncROR повышен при раке яичников [18]. Данное предположение требует дальнейшего изучения и может открыть новые возможности для лечения эндометриоза и предотвращения его развития.
Заключение
В ходе исследования нами было выявлено понижение уровня экспрессии lncROR и повышение уровня экспрессии MALAT1 в образцах ткани с эндометриозом яичников. Полученные результаты свидетельствуют о возможной роли длинных некодирующих РНК в развитии эндометриоза и хорошо совпадают с данными, полученными нами при изучении уровня экспрессии этих днРНК в образцах от пациентов с миомой матки. Таким образом, определение экспрессии длинных некодирующих РНК может играть значимую роль в диагностике эндометриоза яичников. Важно отметить, что, насколько нам известно, уровни lncROR и MALAT1 ранее не сравнивались в группах с сочетанными патологиями, изученными в нашей работе. Требуется проведение дальнейших научных исследований в данном направлении с целью разработки новых прогностических маркеров эндометрий-ассоциированного рака яичников и поиска дополнительных терапевтических мишеней.



