В настоящее время не вызывает сомнения, что тромбозы являются основной причиной летальных исходов в мире. По обобщенным данным мировой литературы, на каждые 1000 родов приходится 2–5 случаев тромботических осложнений. До 50% венозных тромбозов возникают у женщин до 40 лет, и, как правило, они связаны с беременностью [10, 14].
В России смертность от тромбоэмболических осложнений колеблется от 1,5 до 2,7 на 10 000 родов
и в структуре материнской смертности составляет от 2,8 до 18,3%. Риск тромбозов после гинекологических операций достигает 18 –22 %. Он весьма высок при гормональной терапии и контрацепции, при злокачественных новообразованиях и септических состояниях [5, 7].
Связь акушерских осложнений с различными нарушениями в системе гемостаза давно привлекает к себе внимание клиницистов. Наиболее частой причиной таких нарушений, в 35–42% случаев, является антифосфолипидный синдром (АФС), приводящий не только к таким акушерским осложнеиям, как привычное невынашивание беременности, антенатальная гибель плода, синдром задержки внутриутробного развития плода, преэклампсия, но и к рецидивирующим тромбозам различной локализации [5, 7, 11, 12].
Вместе с тем АФС – далеко не единственный вид нарушений гемостаза, провоцирующий акушерские осложнения. В последние годы в связи с открытием ряда генетически обусловленных дефектов гемостаза (мутация фактора V Leiden, мутация протромбина и др.) стало возможным объяснение ранее непонятных случаев тромботических осложнений [3, 4, 9, 15].
Наличие у пациента генетических мутаций приводит к формированию наследственной тромбофилии и обусловливает предрасположенность к развитию тромбозов. Подобное состояние может долгое время, иногда в течение всей жизни, не осложняться тромботическими проявлениями. Однако в результате «провоцирующего» воздействия, одним из которых является беременность, риск развития тромбоза у этой категории больных существенно возрастает.
Более того, манифестация тромбоэмболических осложнений нередко происходит именно во время
беременности, так как тенденция к стазу крови в сочетании с физиологической гиперкоагуляцией
во время беременности создают дополнительные благоприятные условия для развития тромбоза [4,
14, 16].
Диагностика наследственных тромбофилий стала возможной благодаря использованию технологии полимеразной цепной реакции, позволяющей с высокой степенью достоверности определить генетический дефект [13, 15].
Несмотря на большой интерес к проблеме патогенеза и профилактики нарушений свертывающей
системы крови в акушерской практике, недостаточно изучен механизм развития тромбофилий
во время беременности у пациенток с дефектами гемостаза, не установлены ранние маркеры надвигающейся катастрофы.
Кроме того, опыт клинического обследования и лечения подобных больных указывает на необходимость определения совокупных изменений в системе гемостаза, характеризующих степень
риска тромбообразования у пациентов с наследственными и приобретенными тромбофилиями,
что позволит своевременно прогнозировать перинатальные осложнения, проводить адекватную
противотромботическую терапию и контролировать эффективность лечения.
В 1998 г. в нашем институте был разработан и внедрен в практику оригинальный тромбоэластографический способ диагностики волчаночного антикоагулянта (ВА), являющегося одним
из основных лабораторных маркеров АФС (патент № 2104552 от 10. 02. 98). При ВА<1 риск тромбозов
определяется как низкий, при ВА≥1 риск тромбозов высокий. Чувствительность метода составляет
88%, специфичность – 76%, эффективность –82%.
При обследовании пациенток с различными формами тромбофилий ВА обнаружен в 100% случаев, в сочетании с генетической гипергомоцистеинемией (MTHFR-C677) у 14,5% больных, мутацией в гене фибриногена (FGB-455) у 11,6 %, мутацией в гене ингибитора активатора плазминогена (PAI-1) в 9,3% случаев, мутацией фактора V Leiden в 1,2%, мутацией протромбина (F2–20210) в 5,5%, мутацией в гене ITGB3 (рецептора мембраны тромбоцитов) в 4,6%.
АФС был диагностирован в 26,4% случаев. Диагноз ставили при выявлении у пациенток ВА в сочетании с антителами к β2-гликопротеину и/или к аннексину V. Сочетанные формы тромбофилий (генетические и АФС) выявлены у 27% пациенток.
Полученные результаты, а также отсутствие до настоящего времени четких представлений об антигенном субстрате к антителам, называемым ВА, и невозможность его определения с помощью стандартных методик обнаружения антител (иммуноферментный анализ) позволили нам сделать заключение, что ВА является интегральным показателем коагуляции (ИПК), отражающим суммарные коагулопатические изменения у пациенток с тромбофилией, свидетельствующие о повышении общего свертывающего потенциала крови во всех звеньях системы гемостаза.
С практической точки зрения этот показатель позволяет не только получить достоверную информацию о состоянии системы гемостаза у пациенток с тромбофилией на этапе диагностики,
но также планировать и контролировать лечебные мероприятия.
В последующем, изучая течение беременности у пациенток с тромбофилией, мы убедились, что отсутствие четких представлений о нарушениях гомеостаза, предшествующих развитию тромбозов, снижает эффективность терапевтических мероприятий. Этот факт побудил нас к углубленному изучению патогенетических механизмов, лежащих в основе формирования тромбофилических состояний.
Целью исследования явилось изучение роли синдрома эндогенной интоксикации (СЭИ) в патогенезе формирования тромбофилических осложнений при беременности и обоснование включения в комплекс противотромботической терапии метода карбогемосорбции (КГС).
Š „ ‰
Материал и методы исследования
Из 457 женщин, включенных в исследование, были сформированы 2 группы: в основную (n=345)
вошли пациентки с диагностированной тромбофилией, в контрольную (n=112) – условно здоровые женщины. Каждая группа была разделена на 2 подгруппы на основании акушерского статуса пациенток: 1-я основная подгруппа – 96 человек, обследованных на этапе планирования беременности; 2-я основная подгруппа – 249 человек, обследованных при беременности, по мере обращения (II–III триместр); 1-я контрольная подгруппа – 34 пациентки, обследованные вне беременности; 2-я контрольная подгруппа – 78 пациенток, обследованных во время беременности
(II–III триместр).
В качестве лабораторных критериев СЭИ исследовали оптическую плотность безбелковых экстрактов плазмы крови и эритроцитов с целью косвенного определения молекул низкой и средней массы (МНМ и МСМ) по методу М. Я.Малаховой, на спектрофотометре DU-7500 фирмы «Beckman» (США). МНМ и МСМ, по современным данным, считаются основными биохимическими маркерами СЭИ. Существенная особенность МНМ и МСМ заключается в их отчетливо выраженной высокой биологической активности. Накопление МНМ и МСМ не только является маркером эндогенной интоксикации, в дальнейшем они усугубляют течение патологического процесса, приобретая роль вторичных токсинов, оказывая влияние на жизнедеятельность всех систем и органов.
Эти вещества могут взаимодействовать с компонентами систем гемостаза. Считается, что МНМ и МСМ могут проникать через плацентарный барьер, оказывая непосредственное токсическое влияние на плод, вызывая полиорганные нарушения разного характера [6, 8, 13, 17].
О содержании средне- и низкомолекулярных пептидов можно судить на основании прямой спектрометрии депротеинизированного супернатанта, полученного после осаждения белков раствором трихлоруксусной кислоты (ТХУ) при длинах волн (λ) 254 и 280 нм. Суммарное содержание
МНМ и МСМ необходимо оценивать по площади под спектральной кривой оптического поглощения пробы в области 254–280 нм [6].
Исследование функционального состояния эндотелия проводилось на основании определения количества циркулирующих эндотелиоцитов по методике Н.Н. Петрищева, адгезивной активности тромбоцитов по методике З.Д. Федорова, агрегационной функции тромбоцитов на агрегометре «Solar» (Белоруссия). В качестве индуктора агрегации использовали аденозиндифосфат (АДФ) («Технология-стандарт», Барнаул).
Статистическую обработку материала проводили с помощью пакета прикладных программ Microsoft Excel.
†‹ ‰
Результаты исследования и обсуждение Œ
У пациенток с различными формами тромбофилий выявлены значимые различия показателей эндотоксикограммы по сравнению с таковыми в контрольной группе, свидетельствующие о наличии разной степени выраженности СЭИ, как вне беременности, так и при ее прогрессировании (табл. 1).
Таблица 1. Появление СЭИ у пациенток с тромбофилией.
При анализе результатов исследования отмечено существенное увеличение содержания низко и среднемолекулярных пептидов на мембране эритроцитов у небеременных пациенток с тромбофилией, что соответствует повышению оптической плотности ТХУ-экстрактов эритроцитов, регистрируемому как при λ 280 нм (до 0,33±0,005 против 0,27±0,001 усл. ед. в контроле; р<0,01), так и при при λ 254 нм (до 0,73±0,01 против 0,70±0,001 усл. ед.; р<0,01). Оптическая плотность ТХУ-экстрактов плазмы увеличивается незначительно и регистрируется только при λ 254 нм: до 0,10±0,01 против 0,06±0,001 усл. ед. (р<0,01). Это состояние соответствует фазе напряжения или субкомпенсации СЭИ.
При беременности у пациенток с тромбофилией концентрация МНМ и МСМ на мембране эритроцитов достигает максимального уровня и начинает снижаться: оптическая плотность ТХУ-экстрактов эритроцитов при λ 280 нм соответствует 0,29±0,004 против 0,28±0,001 усл. ед. в контроле (при р<0,05), что характеризует фазу полного насыщения.
В плазме крови уровень эндотоксинов у этой категории больных при беременности значительно повышается, увеличивая оптическую плотность ТХУ-экстрактов плазмы до 0,12±0,01 усл. ед. при λ 254 нм против 0,07±0,001 усл. ед. в контроле (р<0,001) и до 0,28±0,01 усл. ед. при λ 280 нм против 0,26±0,001 усл. ед. в контроле (р<0,05). Такие показатели соответствуют стадии обратимой декомпенсации СЭИ.
Дальнейшие исследования показали, что СЭИ приводит к развитию эндотелиальной дисфункции, сопровождающейся повышением количества циркулирующих эндотелиоцитов в периферической крови у пациенток основной группы до 16,46±0,37 против 7,9±0,9 ед/л в группе контроля и изменением функциональной активности тромбоцитов: повышением скорости (до 78,61±3,02 против 56,23±2,93%) и степени (до 93,44±1,69 против 75,2±1,72%) агрегации при незначительном компенсаторном снижении их адгезивной активности (до 18,68±0,37% при норме в контроле 28±1,32%; р<0,001).
Таким образом, результаты исследования позволяют предположить, что отправной точкой патогенеза тромбофилий является СЭИ, прогрессирование которого вызывает поражение эндотелия сосудов с нарушением его тромборезистентных свойств, играющих ключевую роль в регуляции гемостаза.
Ведущая роль СЭИ в патогенезе тромбофилий обосновывает целесообразность включения в комплекс противотромботической терапии экстракорпоральных методов детоксикации, наименее агрессивным из которых, особенно на фоне беременности, является КГС [1, 2].
У 76 пациенток 2-й основной подгруппы применяли КГС в курсовом режиме в сочетании с антикоагулянтной терапией. На курс проводили 2 сеанса КГС с интервалом 1 сут, с сорбцией не менее
1 объема циркулирующей крови. Процедура длится в среднем 60–90 мин.
Процедуру проводили в автоматическом режиме с помощью аппарата для гемосорбции «Гемос–ПФ»
( разработчик, изготовитель и поставщик НПП «БИОТЕХ-М», Россия, регистрационное удостоверение Минздрава РФ № 29/26020695/1042–00) В качестве сорбента использовался ВНИИТУ-1 (углеродный гемосорбент).
Показанием для проведения КГС являлось формирование субкомпенсированной плацентарной недостаточности с нарушением кровообращения в системе мать–плацента–плод, несмотря на применение антикоагулянтной терапии.
Показатели оптической плотности ТХУ-экстрактов плазмы и эритроцитов у этих пациенток соответствовали стадии обратимой декомпенсации. Лабораторную оценку эффективности эфферентной терапии проводили на основании изучения динамики ИПК, степени выраженности СЭИ
и проявлений эндотелиальной дисфункции до и после лечения. Состояние кровообращения в системе мать–плацента–плод оценивали на основании допплерометрии. Критерием клинической эффективности считалась нормализация кровотоков в системе мать–плацента–плод.
Результаты исследования представлены в табл. 2.
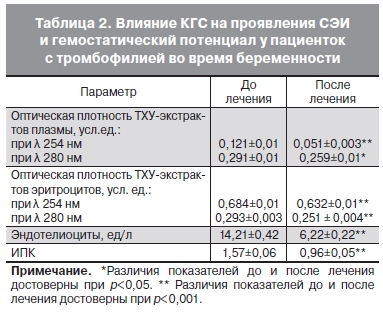
После КГС зарегистрировано выраженное снижение МНМ и МСМ как в плазме крови ( оптическая
плотность ТХУ-экстрактов плазмы при λ 254 нм снижалась с 0,121±0,01 до 0,051±0,003 усл. ед.
при р<0,001 и при λ 280 нм – с 0,291±0,01 до 0,259±0,01 усл. ед. при р<0,05), так и на эритроцитах (оптическая плотность ТХУ-экстрактов эритроцитов при λ 254 нм снижалась с 0,684±0,01 до 0,632±0,01 усл. ед. и при λ 280 нм – с 0,293±0,003 до 0,251±0,004 усл. ед. при p<0,001).
Количество циркулирующих эндотелиоцитов уменьшилось с 14,21±0,42 ед/л перед проведением процедуры до 6,22±0,22 ед/л после лечения, что свидетельствует о значительном улучшении их тромборезистентных свойств.
Кроме того, при оценке результатов лечения выявлено значимое снижение ИПК после курса КГС – с 1,57±0,06 в среднем до 0,96±0,05 (p<0,001).
Уровень ИПК менее 1 был достигнут у 42 (55%) пациенток.
Нормализация кровотока в маточно-плацентарном и плодово-плацентарном русле достигнута у 56 (76,4%) женщин.
Таким образом, метод КГС целесообразно включать в комплекс противотромботической терапии беременным с различными формами тромбофилий, так как он, обеспечивая эффективную детоксикацию, возвращает антикоагулянтные свойства эндотелию, что приводит к снижению общего
коагуляционного потенциала и в свою очередь улучшает кровообращение в маточно-плацентарно-плодовом русле.
Кроме того, при проведении КГС не требуется выведения плазмы крови и последующего плазмовозмещения, что немаловажно во время беременности, осложненной тромбофилией.
При анализе исходов беременностей в исследуемой группе отмечен высокий процент срочных
родов (53,9) за счет снижения удельного веса преждевременных (46,1%).
Таким образом, выявление объективных лабораторных критериев СЭИ и ранних признаков системного эндотелиоза, особенно на доклиническом этапе, у беременных с тромбофилиями может служить важным диагностическим и прогностическим критерием в комплексной оценке состояния матери и плода, способствовать выбору оптимальной противотромботической терапии с включением патогенетически обоснованных простых и безопасных эфферентных методов. Метод КГС, обладая высокой эффективностью воздействия на основные звенья патогенеза формирования тромбозов у таких пациентов, значительно улучшает функционирование фетоплацентарного комплекса, что в свою очередь приводит к увеличению благоприятных перинатальных исходов.



