В настоящее время мир столкнулся с эпидемией ожирения, которая затронула и популяцию беременных женщин [1]. Наряду с увеличением частоты патологии беременности и родов, непосредственно ассоциированной с ожирением, показано, что ожирение матери имеет значительные негативные долговременные последствия для ребенка [2]. К числу их относится увеличение рисков развития артериальной гипертензии, метаболического синдрома и диабета второго типа в последующей жизни [2, 3]. Существует представление о том, что увеличение доставки питательных ресурсов к плоду при ожирении матери может стимулировать в дальнейшем рост жировой ткани у ребенка [4]. Однако в настоящее время накопилась информация о том, что ожирение и связанные с ним заболевания часто развиваются у детей, родившихся с малой массой тела [5]. Эти факты легли в основу современной теории внутриутробного программирования заболеваний детей и взрослых [5, 6].
Суть этой теории заключается в том, что в условиях ограничения питания плода в его организме включаются определенные компенсаторные механизмы, обеспечивающие выживание плода, его рождение и одновременно способствующие раннему развитию артериальной гипертензии, ожирения и диабета 2-го типа в последующей жизни [5, 6].
Известно, что аминокислоты используются плодом как для синтеза белков, так и для производства энергии [7]. Таким образом, аминокислоты, наряду с глюкозой, лактатом и жирными кислотами представляют собой основные питательные вещества, получаемые плодом в процессе внутриутробного развития [7]. При этом синтез белков существенно зависит как от поступления к плоду аминокислот, так и от потока к нему энергии. При положительном энергетическом балансе, когда поступление глюкозы, лактата и жирных кислот превышает расходы плодом энергии, основная масса аминокислот используется для синтеза белка. При отрицательном балансе аминокислоты начинают участвовать в энергопродукции. Таким образом, метаболизм аминокислот и энергетических субстратов сбалансированы по принципу реципрокности [7].
Активный транспорт через плаценту незаменимых аминокислот, а также синтез в плаценте ряда заменимых аминокислот приводит к тому, что концентрация их в плазме плода выше, чем в материнском организме [8].
Ранее были проведены исследования, показавшие увеличение концентрации аминокислот в плазме крови женщин с преэклампсией и диабетом первого типа [9]. При этом были обнаружены значительные изменения содержания аминокислот в плазме крови плодов [9]. Однако до сих пор не проводились систематические исследования содержания аминокислот у матери и плода при ожирении беременных.
Целью настоящей работы было изучение концентрации холестерина и липопротеинов в крови матери и концентрации аминокислот в крови матери и плода при двух видах ожирения матери: когда матери сами родились с нормальным весом и когда их вес при рождении был мал. Второй вид ожирения развивался у беременных, когда они сами находились в условиях ограничения поступления питательных веществ во внутриутробном периоде.

Материал и методы исследования
В исследование были включены 118 беременных женщин, подписавших информированное согласие для участия в проекте изучения влияния ожирения матери, проводившегося в Уральском НИИ ОММ и утвержденного этическим комитетом института.
28 женщин с физиологически развивающейся беременностью и нормальным индексом массы тела (ИМТ <25 2="" 46="">30 кг/м2) и нормальным весом при рождении вошли в 1-ю основную группу. 44 беременных женщин с ожирением (ИМТ >30 кг/м2), которые сами родились с низким весом вошли во 2-ю основную группу. Женщины всех групп не курили. Информация о весе женщин при рождении была предоставлена родителями и документально подтверждена. К группе с низким весом при рождении были отнесены те женщины, чей вес был менее 10 перцентиля с учетом гестационного срока и пола. Критериями исключения для всех женщин была артериальная гипертензия более 140/90 мм рт. ст. и протеинурия более 300 мг белка в сутки.
Образцы крови были получены из локтевой вены женщин и пупочной вены новорожденных в момент рождения. Кровь набирали в пробирки, содержащие 0,1 мг/мл Na2EDTA. Затем после одного часа отстаивания при комнатной температуре, кровь центрифугировали при 2000g в течение 20 мин и замораживали при -80С0 до момента проведения анализа. Затем образцы размораживали и подвергали обработке согласно инструкции производителя анализатора. Концентрацию аминокислот определяли при помощи автоматического анализатора аминокислот ААА-Т339М (Mikrotechna Praha, Czech Republic). Плодово-материнский градиент концентраций аминокислот определяли как отношение концентраций соответствующих аминокислот в крови плода к такому значению в крови матери. Концентрации глюкозы, холестерина, липопротеинов в крови матери определяли автоматическим клиническим анализатором Sapphire 400 (Tokyo Boeki Ltd, Japan).
Статистический анализ проведен с использованием программного пакета Statistica 10.0 (Stat Soft). После подтверждения нормальности распределения результатов вычисляли средние значения и стандартные ошибки. Для сравнения средних использовали t-тест. Уровень значимости принят как p<0.05.
Результаты
Клинические характеристики женщин и новорожденных детей исследованных групп приведены в табл. 1.
Женщины всех групп достоверно не различались по возрасту. Отмечено значимое отличие по ИМТ между женщинами контрольной и двух основных групп. Средний вес при рождении женщин 2-й группы был значимо меньше соответствующего значения для женщин контрольной и 1-й групп. Также новорожденные 2-й группы имели существенно меньшую массу при рождении, чем дети контрольной и 1-й групп. Не обнаружено значимых различий по весу плаценты и отношению вес новорожденного/вес плаценты между исследованными группами.
Холестерин и липопротеины в крови женщин
Концентрации холестерина и триглицеридов в крови женщин 2-й группы были значимо выше, чем у женщин 1-й и контрольной групп (табл. 2).
Концентрация липопротеинов высокой плотности в крови женщин 1-й и 2-й групп была меньше, чем в крови женщин контрольной группы. Концентрация аполипопротеина А1 была существенно увеличена в плазме крови женщин 2-й группы, чем в контрольной. Это отношение было также увеличено (в 1,3 раза) в 1-й группе по сравнению с контрольной группой. Не показаны значительные различия между группами женщин по концентрации глюкозы в крови.
Аминокислоты в плазме крови матерей
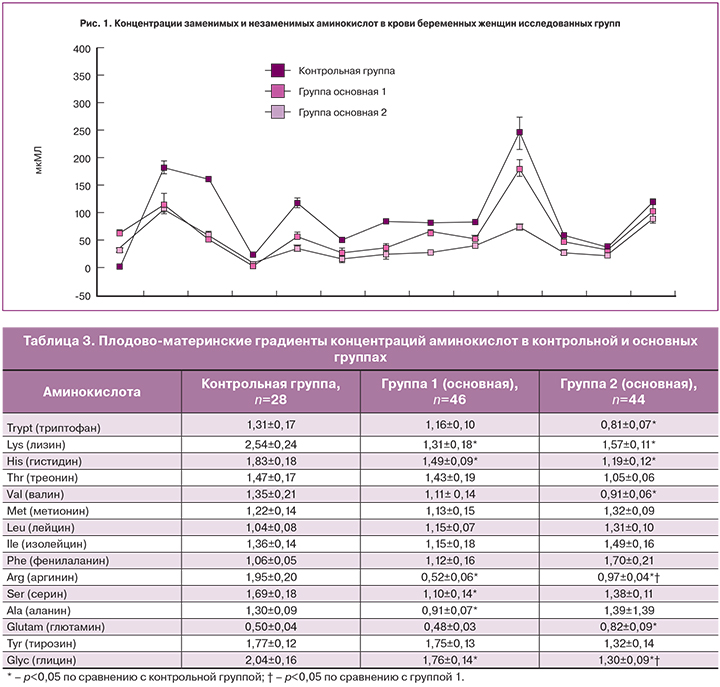
Средние концентрации основных заменимых и незаменимых аминокислот существенно снижены в крови женщин обеих групп с ожирением по сравнению с контрольной группой (рис. 1).
Это уменьшение концентрации аминокислот было более выражено у женщин 2-й группы. Так, концентрация лизина во 2-й группе была в 2 раза меньше, чем в крови женщин контрольной группы. При этом в крови женщин 1-й группы такое снижение составило 1,4 раза. Общая концентрация аминокислот во 2-й группе (525,1±64,0 µM/l) была значимо ниже по сравнению с женщинами 1-й группы (845,6±83,8 µM/l, p<0,05) и контрольной группы (1547,2±120,3 µM/l, p<0,05).
Также имелось существенное различие в общей концентрации аминокислот между 1-й и контрольной группами.
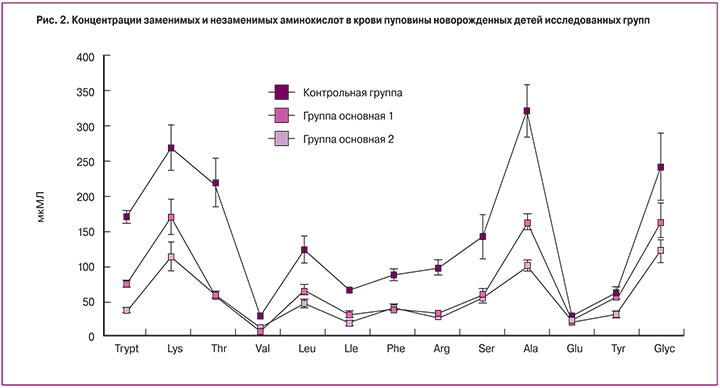
Концентрация аминокислот в пуповинной крови
Концентрации аминокислот в пуповинной крови новорожденных 1-й и 2-й групп существенно ниже, чем в крови новорожденных контрольной группы (рис. 2).
При нормальной беременности концентрация аминокислот в пуповинной крови была существенно больше, чем в крови матерей, что соответствовало достаточно большому значению плодово-материнского градиента (табл. 3). Наименьшие значения плодово-материнского градиента были во 2-й группе, однако для некоторых аминокислот (метионин, лейцин, изолейцин, фенилаланин) эти градиенты во 2-й группе были больше.
Обсуждение
В настоящем исследовании показано значительное увеличение концентрации холестерина и липопротеинов в крови женщин с ожирением, родившихся с малым весом (2-я основная группа). Несмотря на то, что при физиологической беременности концентрации холестерина и липопротеинов существенно увеличиваются [10], концентрации липидов в крови женщин 2-й основной группы настолько высоки, что если бы эти женщины не были беременны, то их можно было бы рассматривать как группу риска по развитию сердечно-сосудистых заболеваний. Механизм, который лежит в основе гиперхолестеринемии при беременности, не вполне изучен. Была показана положительная корреляция между изменениями концентрации липидов и уровнем гормонов беременности (эстрадиол, прогестерон, плацентарный лактоген) [11].
Существует мнение, что увеличение концентрации липидов в крови беременной женщины является отражением того, что липиды и жирные кислоты используются как один из важнейших энергетических субстратов, необходимых плоду [11].
В нашей работе показано, что концентрация холестерина и липопротеинов в крови женщин 2-й группы была значительно выше, чем в крови не только женщин контрольной, но и 1-й группы. Таким образом, очевидно, что женщины 2-й группы находятся в зоне риска по атерогенности. Это значит, что подобный уровень липидов в крови может определять долговременные риски развития сердечно-сосудистых заболеваний в этой группе женщин [12]. Так, ранее было показано, что женщины, родившиеся сами с низким весом находятся в группе риска по развитию артериальной гипертензии во время беременности [13]. Однако гиперхолестеролемия матери также сопровождается значительными изменениями метаболизма жиров и депонированием липидов в стенку сосудов у плодов. Так, у плодов беременных крыс с гиперхолестеролемией были показаны зоны аккумуляции липидов и отложения их в области интимы аорты [14].
Таким образом, результаты наших исследований согласуются с основными положениями теории внутриутробного программирования заболеваний, согласно которой ухудшение питания и замедление роста плода значительно увеличивает риск развития сердечно-сосудистых заболеваний и дислипидемии у потомства [15].
Известно, что аминокислоты вместе с глюкозой, лактатом и жирными кислотами представляют собой основные нутриенты, используемые плодом, как для синтеза белков, так и для окислительного фосфорилирования [7]. Известно, что концентрация аминокислот в плазме плода выше, чем в плазме крови матери [16]. Несомненно, основную роль в таком перераспределении играет плацента, не только обеспечивающая транспорт аминокислот к плоду, но и участвующая в синтезе довольно значительного количества заменимых аминокислот [16].
Для транспорта аминокислот из крови матери в кровь плода используется большое количество переносчиков, локализованных в мембране синцитиотрофобласта [17]. Часть переносчиков обеспечивают активный транспорт аминокислот, с использованием энергии АТФ, против концентрационного градиента, другие работают, совмещая ко-транспорт внеклеточных ионов натрия [17]. В настоящее время продемонстрирован ряд факторов способных регулировать трансплацентарный транспорт аминокислот – уровень оксигенации, концентрация инсулина, лептин [18]. Показано, что рост плода является результатом баланса и взаимодействия между процессами транспорта нутриентов от матери к плоду и генетически детерминированным потенциалом роста плода [7]. В свою очередь, трансплацентарный поток питательных веществ зависит от питания матери, маточно-плацентарной циркуляции и собственно производительности трансплацентарного транспорта нутриентов [19]. В нашем исследовании показано, что женщины 2-й группы родили маловесных детей. Показано, что концентрация аминокислот в плазме крови этих детей существенно меньше, чем у детей контрольной и даже 1-й группы. Ранее было показано значительное снижение концентрации аминокислот в плазме крови плодов с синдромом задержки развития у женщин с плацентарной недостаточностью и преэклампсией [20]. Следует отметить, что несмотря на столь значительное снижение концентрации аминокислот в крови плодов, у матерей с преэклампсией имеет место увеличение уровня аминокислот [20].
В нашем исследовании показано существенное уменьшение плодово-материнского градиента аминокислот в группе женщин с ожирением, родившихся с малым весом. Это может быть указанием на снижение концентрационно-синтетической функции плаценты у женщин этой группы. Однако для ряда аминокислот, таких как метионин, лейцин, изолейцин и фенилаланин плодово-материнский градиент во 2-й группе выше, чем в контрольной и 1-й группах. Вероятно, это может быть результатом изменения баланса между различными транспортными системами плаценты [7]. Показано, что каждая система транспорта аминокислот обладает высокой стереоспецифичностью. В то же время, по ряду аминокислот имеется взаимное перекрытие между различными транспортными системами с компенсацией дефектов этого транспорта для определенных аминокислот [7].
Метаболизм и рост плода – это адаптивные процессы, которые в значительной мере программируются общей концентрацией питательных веществ в организме матери и условиями окружающей среды. Более того, ранее высказывалось предположение, что плацента может играть роль своего рода сенсора нутриентов [21]. Если плацента получает информацию о замедлении роста плода, то она может увеличить поток питательных веществ к плоду для компенсации дефекта его роста. С другой стороны, если имеется снижение концентрации нутриентов в материнском организме, плацента способна снизить транспортную активность с целью снижения запросов плода и перевода его на более экономичный режим метаболизма [20].
Показанное в нашем исследовании уменьшение плодово-материнского градиента для большинства аминокислот во 2-й группе позволяет предположить снижение транспортной и синтетической функции плаценты. Более того, материнская гиперхолестеролемия, показанная во 2-й группе, также может влиять на транспорт аминокислот в результате продемонстрированного ранее реципрокного взаимоотношения между транспортом аминокислот, с одной стороны, и энергоснабжения в виде транспорта жирных кислот и глюкозы с другой стороны [7].
Заключение
Таким образом, в работе показано значительное снижение аминокислотной транспортно-концентрационной функции плаценты у женщин с ожирением, в особенности у тех, кто сам родился с низкой массой тела, что согласуется с теорией внутриутробно программируемых заболеваний.



