В половине случаев бесплодного брака имеет место мужской фактор – изолированно (30%) или в сочетании с женским бесплодием (20%) [1–3]. Нарушение мужской фертильности часто сопровождается изменениями показателей эякулята – снижением концентрации, подвижности и доли нормальных форм сперматозоидов – олигозооспермией, астенозооспермией и тератозооспермией соответственно. Но мужчины, у которых показатели спермы ниже референсных, не обязательно бесплодны [4]. И наоборот, мужское бесплодие может иметь место при формальной «нормозооспермии» в случае различных функциональных нарушений сперматозоидов: рецепторных взаимодействий, в т.ч. акросомной реакции, повреждения хроматина и иных эпигенетических нарушений, аутоиммунных реакций против сперматозоидов [3, 5–7]. Кроме того, эксперты ВОЗ отмечают, что существуют региональные различия в показателях эякулята фертильных мужчин и рекомендуют лабораториям внедрять свой собственный диапазон референсных значений, рассчитанных с помощью методик, описанных в «Руководстве ВОЗ по исследованию спермы» [4]. Нерешенные вопросы дифференциальной диагностики мужского бесплодия порождают трудности в лечении, поскольку эффективное лечение на основе только формальных спермиологических диагнозов невозможно. Необходимы специальные лабораторные исследования, направленные на выяснение этиопатогенетических механизмов снижения фертильности. Но четких алгоритмов ведения мужчин из бесплодных пар, связывающих диагностику и лечение, по-прежнему нет [1–3, 7–10].
Цель исследования: установить структуру нарушений качества спермы у мужчин из бесплодных пар с учетом региональных особенностей и на этой основе разработать алгоритм ведения пациентов в специализированных медицинских учреждениях.
Материалы и методы
Тип исследования – аналитическое одномоментное многоцентровое. Проанализированы электронные истории болезни 4088 мужчин 18–50 лет, которые в период 2011–2020 гг. обратились в специализированные клиники третьего уровня, где работают авторы, по поводу отсутствия желанной беременности в браке более 1 года. Временной интервал для включения в исследование обусловлен тем, что в 2010 г. в клиническую практику была внедрена новая редакция «Руководства ВОЗ по исследованию спермы…» [4], что в определенной мере изменило работу специалистов лабораторной диагностики при микроскопических исследованиях. Условием включения в исследование являлись: отсутствие установленных женских причин бесплодия (аномалии половых органов, непроходимость маточных труб, ановуляция, выраженный эндометриоз, возраст старше 35 лет), а также регулярная половая жизнь не реже 1 раза в неделю. Другие клинико-анамнестические факторы не учитывались. Обследованные пациенты из бесплодных пар считались предположительно субфертильными, независимо от результатов выполненного исследования спермы, и сформировали группу «бесплодных» (группа Б). Группу сравнения сформировали 365 фертильных мужчин, обратившихся по различным поводам (диспансеризация, сексуальные проблемы, симптомы нижних мочевых путей и др.), от которых в течение 3 месяцев, предшествовавших обращению, наступила спонтанная беременность без какого-либо специфического лечения (группа Ф); исход наступившей беременности при этом не учитывался.
Исследование эякулята включало оценку стандартных показателей (объем, концентрация, подвижность, морфология сперматозоидов и др.), а также специальные тесты на антиспермальные антитела (АСАТ), оксидативный стресс (ОС), фрагментацию ДНК, акросомную реакцию (АР), конденсацию хроматина. При оценке морфологии сперматозоидов применяли «строгие критерии». АСАТ определяли методом MAR (mixed agglutination reaction) (Ferti Pro N.V., Бельгия) [4]: «умеренными нарушениями» считали MAR-IgG 10–49%, «значительными нарушениями» – MAR-IgG >50%. При а-, крипто-, грубой олиго- и астенозооспермии АСАТ определяли непрямым методом. Оценку ОС проводили путем измерения продукции активных форм кислорода (АФК) методом люминолзависимой хемилюминесценции [4, 11] с использованием люминометра LKB-Wallac 1256 (Финляндия) и хемилюминометра-003 «УГАТУ» (Россия); нормой считали хемилюминесценцию не более 0,44 мВ/с [12]. Для оценки спонтанной и индуцированной ионофором А23187 АР применяли способ двойного флуоресцентного окрашивания сперматозоидов с использованием флуоресцеин-изотиоцианат-меченного лектина P. sativum (Sigma, США) и тетраметилродамин-флуоресцеин-изотиоцианат-меченного лектина A. hypogaea (Sigma, США) [13]; нормой считали спонтанную АР менее чем у 15% сперматозоидов, индуцированную – не менее чем у 15% сперматозоидов [4]. Апоптоз сперматозоидов характеризовали по фрагментации ДНК, оцениваемой методом дисперсии хроматина (Halosperm® Halotech DNA, SL, Spain) в геле инертной агарозы с визуальной оценкой под микроскопом образования ореола после кислотной денатурации ДНК и лизирования протеинов ядра [14]; нормой считали индекс фрагментации не более 15%, фрагментацию больше 30% считали «значительными нарушениями». Конденсацию хроматина характеризовали по количеству сперматозоидов с высоким содержанием гистонов [15]. Применяли окраску анилиновым синим и эозином, позволяющую выявлять основные ядерные белки с высоким содержанием лизина, характерные для незрелых сперматозоидов. В препарате при увеличении ×1000 оценивали процент неокрашенных клеток (G0), сперматозоидов со слабой (G1) и интенсивной (G2) окраской, вычисляли индекс нарушения протаминации (G0×0+G1×1+ G2×2); нарушением считали более 30% гистон-позитивных сперматозоидов и индекс нарушения протаминации больше 40 [15].
 Статистический анализ
Статистический анализ
Статистический анализ данных проводили с применением пакета Statistica (StatSoft, США). Анализ соответствия вида распределения признака закону нормального распределения проводили по критерию Шапиро–Уилка (W). Средние значения по группам представляли в виде медианы, 25–75% и 5–95% процентилей, диапазона «невыпадающих значений». «Выпадающими» являлись значения, которые находятся далеко от центра распределения и не являются характерными для него (возможно, являются результатами ошибок наблюдения, или выбросами). «Выпадающие значения» определялись следующим образом: с помощью программы Statistica для каждой группы переменных строили «коробочный» график (англ. box-and-whiskers diagram or plot, box plot), на котором диапазон «выпадающих значений» указан в «легенде» диаграммы. В нашем случае «выпадающими» являлись значения, рассчитанные в соответствии с алгоритмом, настроенным в статистическом пакете Statistica по умолчанию: «контуры» – значения больше, чем интерквартильный размах с коэффициентом ×1,5; «пределы» – с коэффициентом ×2. Использование 5–95% процентилей и диапазона «невыпадающих значений» обусловлено необходимостью не только охарактеризовать средние тенденции распределения значений, но и определить референсные границы для оцениваемых параметров. Значимость различий между группами проверяли с помощью непараметрических критериев Манна–Уитни (M–W), знаков, χ2; различия считали значимыми при p<0,05.
Результаты
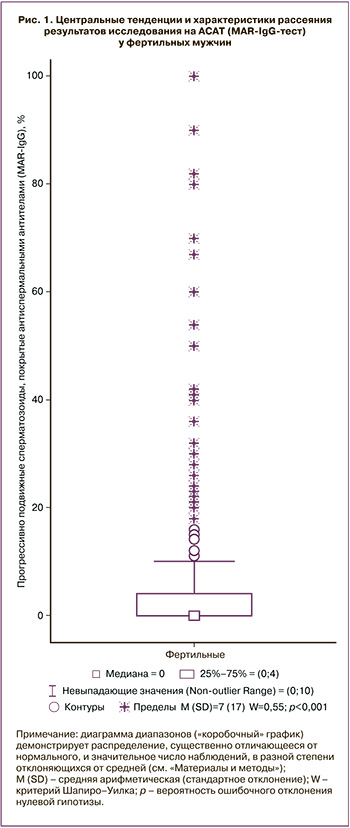
Анализ распределения значений всех оцениваемых параметров эякулята показал, что оно отличается от нормального: W для объема эякулята равен 0,96 (р<0,001), концентрации сперматозоидов – 0,79 (р<0,001), доли прогрессивно подвижных сперматозоидов – 0,99 (р<0,001); наиболее выраженные отклонения от нормального распределения были в концентрации спермальных лейкоцитов (W=0,23; р<0,001) и доле АСАТ-позитивных сперматозоидов (W=0,55; р<0,001; рис. 1). Поэтому для характеристики центральных тенденций и вариабельности каждого параметра мы опирались на величины медианы и процентилей.
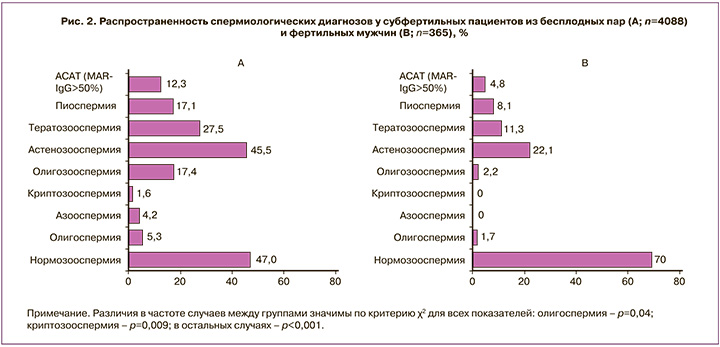
Различные нарушения качества спермы у мужчин из бесплодных пар (группа Б) имели место существенно чаще, чем у фертильных мужчин (группа Ф) (рис. 2): азооспермия – 4,2% и 0% случаев (р<0,001), криптозооспермия – 1,6% и 0% (p=0,009), олигозооспермия – 17,4% и 2,2% (р<0,001), астенозооспермия – 45,5% и 22,1% (р<0,001), тератозооспермия – 27,5% и 11,3% (р<0,001), олигоспермия – 5,3% и 1,7% (p=0,04), АСАТ (MAR-IgG>50%) – 12,3% и 4,8% (р<0,001), пиоспермия – 17,1% и 8,1% (р<0,001).
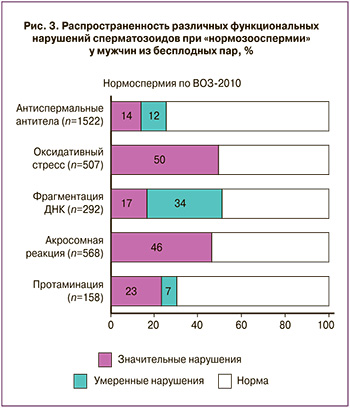
Почти у половины (47,0%) пациентов группы Б концентрация, подвижность и морфология сперматозоидов были в границах референсных значений, т.е. соответствовали диагнозу «нормозооспермия». Но при этом у каждого второго такого мужчины имели место те или иные функциональные нарушения сперматозоидов (рис. 3): повышена фрагментация ДНК (51%), ОС (50% случаев), нарушена АР (46%) и протаминация (30%); часто такие нарушения были сочетанными. У 26% мужчин АСАТ покрывали больше 10% подвижных сперматозоидов, в т.ч. у 14% АСАТ-позитивными были не меньше 50% сперматозоидов.
 Средние значения и различия рангов всех параметров спермограммы (таблица) в группе Б существенно хуже, чем в группе Ф (р<0,001), кроме объема и процента аномальных форм (p>0,05).
Средние значения и различия рангов всех параметров спермограммы (таблица) в группе Б существенно хуже, чем в группе Ф (р<0,001), кроме объема и процента аномальных форм (p>0,05).
У фертильных мужчин, чьи половые партнерши забеременели в течение трех последних месяцев (группа Ф), нижний 5-й процентиль для объема составил 1,8 мл, концентрации – 20 млн/мл, доли прогрессивно подвижных сперматозоидов – 23%. Для других важных параметров эякулята, где значение имеет, наоборот, превышение над нормативом, 95-й процентиль для спермальных лейкоцитов составил 1,7 млн/мл, для АСАТ (MAR-IgG) – 42%, патологических форм сперматозоидов – 98%. Использование критерия «невыпадающие значения» показало несколько иные результаты: для концентрации спермальных лейкоцитов «выпадающими» являлись значения больше 1 млн/мл, для MAR-IgG – больше 10%, для морфологии – 100%.
Обсуждение
Установленный факт, что средние значения концентрации, подвижности, морфологии и других показателей эякулята у мужчин из бесплодных пар хуже, чем у фертильных, а распространенность азооспермии, криптозооспермии, олигозооспермии, астенозооспермии, тератозооспермии, пиоспермии больше, чем у фертильных, вполне предсказуем. Но из представленных нами данных видно, что уменьшение количества сперматозоидов (азооспермия, криптозооспермия, олигозооспермия) в анализируемой выборке субфертильных мужчин (n=4088) суммарно составляет около 25%; еще примерно в 5% случаев имеет место олигоспермия. Чаще наблюдается снижение качества сперматозоидов: уменьшение доли прогрессивно подвижных (46%) и увеличение процента патологических форм (по «строгим критериям» 28%). В 47% случаев имеет место нормозооспермия – т.е. мужчины должны были быть фертильными. Но при этом в данной подгруппе диагностированы различные функциональные нарушения сперматозоидов: увеличена продукция сперматозоидами АФК, что является признаком ОС сперматозоидов (50% случаев), повышена фрагментация ДНК (51% случаев), в т.ч. за счет нарушения протаминации (30%), нарушена их АР (46%). Такие нарушения могут приводить не только к отсутствию беременности, но и к замершим беременностям и аномалиям развития, в т.ч. при использовании методов вспомогательных репродуктивных технологий [1, 16–18]. Скорее всего, эти нарушения являются взаимосвязанными, поскольку ОС сегодня рассматривают в качестве ведущего патогенетического механизма повреждения сперматозоидов при многих клинических состояниях: варикоцеле, инфекционно-воспалительных процессах, токсических воздействиях, аутоиммунных реакциях против сперматозоидов и других [1, 19–21]. При идиопатических формах патозооспермии ОС имел место до 80% случаев, при бесплодии неясного генеза, т.е. функциональных нарушениях, не диагностируемых при стандартном спермиологическом исследовании, – в 30–40% [22, 23]. По нашим данным, при бесплодии неясного генеза ОС имел место даже чаще – в 50% случаев. Установление факта наличия таких функциональных нарушений позволяет не только лучше понять природу бездетного брака (бесплодие перестает казаться идиопатическим), но и сделать лечение таких пациентов патогенетически обоснованным. Недавно большим авторским коллективом из 91 человека опубликована статья, в которой предложено ввести новый диагноз: «идиопатическое бесплодие, обусловленное ОС» (Male Oxidative Stress Infertility/MOSI) [24]. Обоснованность такого подхода подтверждают результаты выполненного нами недавно исследования, в котором было показано, что терапия олигозоо-, астенозоо- и/или тератозооспермии с помощью комплекса нутриентов-антиоксидантов, широко применяемых для лечения идиопатического мужского бесплодия [25], эффективна при умеренно повышенных уровнях АФК, менее эффективна при значительно увеличенных уровнях и не дает никакого эффекта при нормальных уровнях АФК [26]. Это объясняет, почему данные об эффективности применения нутриентов-антиоксидантов при эмпирическом лечении идиопатического бесплодия весьма противоречивы, и их назначение исключено в качестве рекомендуемой опции в последнем Руководстве EAU [1].
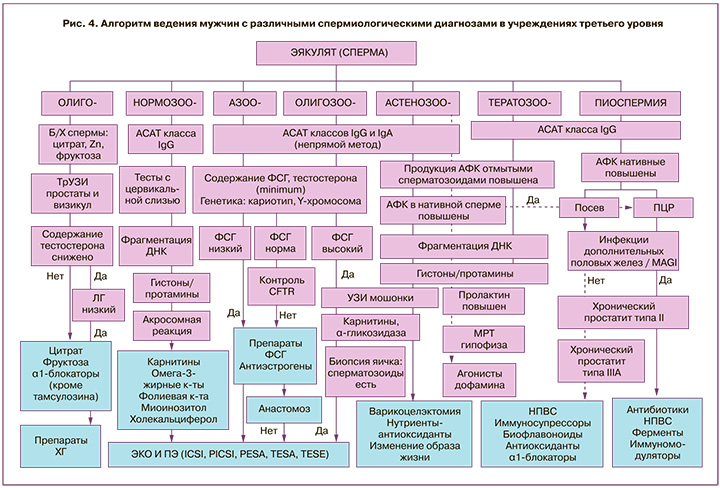
Учитывая, что мы не можем однозначно исключить женский фактор бесплодия (трубный фактор, олигоменорея, эндометриоз и возраст старше 35 лет не являются исключительными причинами женского бесплодия), мы не вправе утверждать, что все мужчины в группе Б были бесплодными. Но в то же время представленные данные дают достаточное основание считать, что охарактеризованные выше функциональные нарушения сперматозоидов являются весьма распространенным патогенетическим механизмом мужского бесплодия как при олиго-, астено- и тератозооспермии (данные в этой статье не представлены), так и при нормозооспермии. Поэтому лабораторные исследования, позволяющие обнаружить такие функциональные нарушения, должны как можно шире применяться при обследовании бесплодных пар и пар с невынашиванием беременности. Следует пересмотреть отношение к данным методам как к «научным», о чем пишут в некоторых руководствах [1, 4], и шире внедрять их в практическое здравоохранение. Мы уже обсуждали вопрос, какие методы обследования мужчин из бесплодных пар должны применяться в лечебно-профилактическом учреждении первого, второго и третьего уровня [7]. Поскольку выполнение исследований ОС, структуры хроматина, АР подразумевает применение достаточно сложных специальных методов, оборудования и квалификации специалистов, их использование сегодня, по нашему мнению, следует осуществлять в специализированных медицинских учреждениях третьего уровня.
На рис. 4 представлен рекомендуемый нами алгоритм ведения мужчин из вынужденно бездетных пар, учитывающий как традиционные спермиологические диагнозы (олиго-, астено- и тератозооспермия, пиоспермия), так и различные функциональные нарушения. Следование такому алгоритму, по нашему мнению, позволит применять различное возможное лечение – гонадотропины, антиэстрогены, нутриенты-антиоксиданты, антибиотики и др. [1, 8, 25, 27] – не эмпирически, а патогенетически обоснованно.
У фертильных мужчин в нашей выборке эякулят соответствует диагнозу «нормозооспермия» по ВОЗ-2010 [4] только в 70% случаев. Поскольку обследованная группа фертильных мужчин достаточно велика – 365 человек, и то, что мы учитывали беременности, наступившие за последние 3 месяца, по нашему мнению, полученные результаты позволяет ставить вопрос о внедрении региональных референсных значений для характеристики спермы фертильных мужчин российской популяции. О существовании региональных различий в показателях эякулята фертильных мужчин пишут составители «Руководства ВОЗ по исследованию спермы» и рекомендуют лабораториям внедрять свой собственный диапазон референсных значений, рассчитанных с помощью методик, описанных в этом руководстве [4]. В частности, из представленных в статье данных следует, что нормальной концентрацией для российской популяции следует считать диапазон 20–188 млн/мл, а значения меньше 5 млн/мл являются «выпадающими», т.е. нехарактерными для фертильных мужчин. Для прогрессивно подвижных сперматозоидов нормальным следует считать диапазон 23–66%, а «выпадающим» – менее 13%. Для результата MAR-IgG-теста картина выглядит несколько иначе: верхний 95% процентиль составляет 42%, а «выпадающими» являются все значения больше 10%. Имеются определенные отличия, по сравнению с референсными значениями Руководства ВОЗ [4], и для других показателей эякулята.
Необходимо отметить, что наиболее дискутабельной на сегодняшний день представляется оценка морфологии сперматозоидов, на которую влияют не только методы исследования (окраска, количество подсчитанных полей зрения, квалификация персонала), но и использование той или иной классификации, в частности, работа по «строгим» или «либеральным» критериям [28, 29]. Наши данные подтверждают точку зрения тех авторов [29], которые считают, что оценка морфологии сперматозоидов при стандартной окраске не позволяет дифференцировать образцы на фертильные и стерильные. По нашим данным, значимые различия в проценте патологических форм между группой фертильных и субфертильных мужчин отсутствуют, а диапазон «невыпадающих значений» в фертильной группе, как и у субфертильных, достигает 100%. Очевидно, снижение фертильности связано не с внешними дефектами строения сперматозоидов, а с их функциональными нарушениями, которые могут иметь место как при тератозооспермии, так и при нормальной морфологии.
Возможно, для клинической практики удобно не распределение результатов на строго «нормальные» и «патологические», но еще и введение понятия «серой зоны», которая характеризует субфебрильных пациентов [28]. Мы предлагаем выход за границы диапазона 5–95% процентилей считать значимым фактором риска снижения фертильности и определять термином «субфертильность», за границу «выпадающих» значений – термином «мужское бесплодие». Уточнение таких региональных критериев требует продолжения крупномасштабных многоцентровых исследований в данном направлении с внутренним и внешним контролем качества выполнения лабораторных исследований.
Следует также иметь в виду, что понятие «фертильный мужчина», т.е. мужчина, от которого наступила беременность, не тождественно понятию «здоровый мужчина» в репродуктивном смысле, поскольку до 40% беременностей прерываются на ранних сроках из-за низкого качества сперматозоидов и связанного с этим нарушения развития зародыша [16–18].
Заключение
Более чем в 2/3 случаев снижение фертильности мужчин обусловлено не малым числом сперматозоидов, а их функциональными нарушениями: ОС, повреждением хроматина, нарушением АР, АСАТ. Получены данные о региональных особенностях диапазона референсных значений фертильных мужчин. Предложены лабораторные критерии для использования терминов «субфертильность» и «мужское бесплодие». Предложен алгоритм ведения пациентов при различных спермиологических диагнозах в специализированных учреждениях третьего уровня (рис. 4).



