Бесплодие определяется как невозможность зачать ребенка в течение 12 месяцев регулярной половой жизни без использования контрацепции. Примерно у 85% бесплодных пар есть идентифицируемые причины бесплодия, к которым относятся непроходимость или отсутствие маточных труб, овуляторная дисфункция и нарушения сперматогенеза. В остальных случаях диагностируется бесплодие неуточненного генеза [1–3]. В настоящее время примерно 50% случаев бесплодия составляет мужской фактор [4, 5]. При этом надо отметить, что около 25 лет назад мужской фактор составлял только 40%, то есть наблюдается тенденция к ухудшению мужского здоровья и росту мужского бесплодия.
Одним из факторов мужского бесплодия различной этиологии, в частности идиопатического бесплодия, является оксидативный стресс [6–8]. Оксидативный стресс возникает вследствие дисбаланса между активными формами кислорода (АФК) и антиоксидантной системой организма, которая ответственна за удаление избытка свободных радикалов [2]. Существуют как внешние, так и внутренние факторы, влияющие на появление оксидативного стресса в значительной степени. К внешним факторам относятся токсичная среда, стресс, а также употребление алкоголя и курение. Внутренними факторами, вызывающими оксидативный стресс, являются варикоцеле, воспалительные процессы в мочеполовых путях, инфекция или определенные системные заболевания, например, сахарный диабет, атеросклероз и другие [9].
Влияние АФК на функцию и структуру сперматозоидов является предметом давних дискуссий в фундаментальной науке [10]. Еще в 1946 г. в научном журнале Nature сообщалось о том, что зрелые сперматозоиды являются одними из первых клеток, производящих большое количество АФК, что обусловлено их высокой скоростью метаболизма для поддержания подвижности [11].
Cчитается, что основными источниками, продуцирующими АФК в сперме, являются лейкоциты и незрелые сперматозоиды [12]. Уровни АФК положительно коррелируют с концентрацией лейкоцитов в сперме. Незрелые сперматозоиды – это половые клетки с избытком цитоплазмы. Сохранившаяся цитоплазма активирует никотинамидадениндинуклеотид-фосфат (НАДФН)-систему, которая через каскад реакций инициирует образование АФК [13]. При этом доказано, что небольшие концентрации АФК необходимы для нормального функционирования сперматозоидов, их гиперактивации и акросомальной реакции [4].
Известно, что избыток АФК вызывает повреждение различных компонентов клеточной стенки и органелл сперматозоида, а также ядерной и митохондриальной ДНК. В результате происходит апоптоз сперматозоидов, снижается их подвижность и оплодотворяющая способность. К наиболее значимым негативным эффектам взаимодействия АФК с половыми клетками относят перекисное окисление липидов (ПОЛ) и фрагментацию ДНК [14]. В отличие от соматических клеток, гаметы более уязвимы к ПОЛ в связи с отсутствием необходимой системы репарации цитоплазматических ферментов. Кроме того, в цитоплазматической мембране имеется большое количество полиненасыщенных жирных кислот и мембраносвязанной НАДФН-оксидазы-5, что делает половые клетки восприимчивыми к АФК [15, 16].
Таким образом, производимые в сперме АФК должны быть постоянно инактивированы, чтобы концентрация АФК постоянно оставалась достаточно низкой для нормальной работы сперматозоидов [17]. Поддержание низкого уровня АФК осуществляется многокомпонентной системой регуляции процессов активации кислорода – антиоксидантной системой организма. Антиоксидантами называются вещества животного и растительного происхождения, способные ингибировать развитие процессов свободнорадикального окисления [18]. Эякулят мужчин содержит группу ферментативных и неферментативных антиоксидантов. К ферментативным антиоксидантам, которые отвечают за защиту сперматозоидов от оксидативного стресса, относят супероксиддисмутазу, каталазу, глутатионредуктазу и пероксидазу. Функция неферментативных антиоксидантов, таких как таурин, пируват и др., которые поступают в организм извне, заключается в связывании свободных радикалов. Эти две системы антиоксидантной защиты предотвращают окислительное повреждение клеточных структур, только функционируя вместе [19, 20]. Различные исследования показывают, что эякулят фертильных мужчин обладает более высокой антиоксидантной способностью, чем у бесплодных мужчин [21, 22]. Это позволяет использовать уровень антиоксидантов в эякуляте в диагностических целях и для контроля качества лечения мужского бесплодия. В различных исследованиях в эякуляте изучались как отдельные антиоксиданты, так и общая антиоксидантная способность (ОАС). Учитывая, что снижение одного антиоксиданта может быть компенсировано увеличением другого, измерение ОАС дает более ценную информацию, чем отдельные измерения [23].
Качество эякулята определяет результат оплодотворения яйцеклетки, однако исследований, связывающих ОАС или уровень окислительного стресса эякулята с исходами программ вспомогательных репродуктивных технологий (ВРТ), не проводилось.
Целью настоящей работы являлась оценка влияния ОАС в нативном эякуляте на эмбриологический этап программ ВРТ у супружеских пар с различными типами бесплодия.
Материалы и методы
В исследование включены 50 супружеских пар с верифицированным диагнозом бесплодия, обратившихся в отделение вспомогательных технологий в лечении бесплодия им. проф. Б.В. Леонова ФГБУ «НМИЦ АГП им. академика В.И. Кулакова» Минздрава России. Перед началом программы от каждой пары было получено письменное добровольное информированное согласие на участие в исследовании. Все пациенты прошли полное обследование перед проведением программы ВРТ, которое включало сбор анамнестических данных, клинико-лабораторные и функциональные методы исследования в соответствии с Приказом Минздрава России № 803н от 31 июля 2020 г. «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению» [24]. Настоящее исследование было одобрено на заседании Этического комитета ФГБУ «НМИЦ АГП им. Академика В.И. Кулакова» Минздрава России.
Стимуляция функции яичников проводилась на 2–5-й день менструального цикла по стандартному протоколу в зависимости от овариального резерва пациенток с использованием препаратов гонадотропинов и антагοнистов гонадοтропин-рилизинг-гормοна. Триггер дозревания ооцитов вводился за 35–36 ч до проведения трансвагинальной пункции при наличии в яичниках фолликулов диаметром ≥17 мм. В качестве триггера овуляции назначали препарат человеческого хорионического гонадотропина (ΧГЧ) в стандартной дозе 10 000 МЕ. При риске развития синдрома гиперстимуляции яичников в качестве триггера финального созревания ооцитов назначался препарат агониста гонадοтропин-рилизинг- гормοна в дозе 0,2 мг. В день трансвагинальной пункции у супругов пациенток производился забор нативного эякулята. Образцы эякулята были получены путем мастурбации после полового воздержания в течение 3–5 дней. Стандартное сперматологическое исследование выполняли в соответствии с руководством Всемирной организации здравоохранения (2010) [25]. Оплодотворение всем пациентам производили методом интрацитоплазматической инъекции сперматозоида (ИКСИ). Культивирование эмбрионов выполняли до 5-х суток в средах G-TL (VitroLife, Швеция) в настольных инкубаторах COOK (Ирландия) при пониженном содержании кислорода (5% О2). Всем пациенткам был произведен перенос эмбриона лучшего качества в полость матки на 5-е сутки культивирования. Оценка эмбрионов по морфологическим признакам производилась в соответствии с критериями, представленными в таблице 1. На 12–14-й день после переноса эмбриона все пациентки для подтверждения беременности сдавали кровь на β-субъединицу хорионического гонадотропина человека (β-ХГЧ).
Для оценки ОАС нативного эякулята использовали прибор FORM 3000 (Callegari, Italy) в соответствии с рекомендациями производителя. Измерение в эякуляте ОАС проводили в пересчете на эквивалентную активность витамина Е (ммоль/л экв. тролокса) с использованием набора FORD. Для этого брали 1 мкл эякулята, разведенного в 49 мкл водного раствора хлорида натрия с массовой долей 0,9%. Данные представлены в виде относительных единиц.
Метод FORD основан на использовании предварительно образованных свободных радикалов и снижении абсорбции, которое пропорционально концентрации антиоксидантов в эякуляте в присутствии кислого буфера (pH=5,2) и подходящего оксиданта (FeCl3), аминопроизводное (хромоген) образует стабильный окрашенный продукт, катион, определяемый фотометрически при длине волны 505 нм. Антиоксиданты, присутствующие в образцах, снижают содержание катионов, что приводит в конечном итоге к обесцвечиванию раствора пропорционально количеству антиоксидантов в образце. В крови значение уровня антиоксидантов у здоровых людей, определенное с помощью анализа FORD, находится в диапазоне тролокса 1,07–1,53 ммоль/л [26].
Для выявления различий в средних значениях основных клинических и эмбриологических показателей все пациентки были разделены на две группы в зависимости от исхода программы ВРТ (наступление или ненаступление беременности). У 21 супружеской пары из 50 диагностировали беременность, в то время как у 29 был отрицательный результат β-ХГЧ в крови.
Статистический анализ
Для статистического анализа данных использовались следующие программы: IBM SPSS Statistics 22, Microsoft Excel 15.0.
Так как полученные в ходе исследования данные являются непараметрическими, для их анализа использовались коэффициент корреляции Спирмена (Rs) и ранговый U-критерий Манна–Уитни для сравнения средних показателей в двух группах.
Результаты
Описательная статистика участников исследования представлена в таблице 2. Поскольку полученные данные не являются параметрическими, для их характеристики используются медиана (Me) и интерквартильный интервал (Q1;Q3). При интерпретации результатов статистического анализа уровень значимости p=0,05 был принят за критический.
Концентрация и подвижность сперматозоидов у исследуемой группы были в пределах нормальных значений. Оценка морфологии сперматозоидов показала, что доля сперматозоидов идеальной формы в исследуемой группе составила 2 (1;3)%, что меньше референсного значения (4%).
Для выявления возможной связи ОАС эякулята с основными клиническими и эмбриологическими показателями программ ВРТ был проведен корреляционный анализ Спирмена. Результаты представлены в таблице 3.
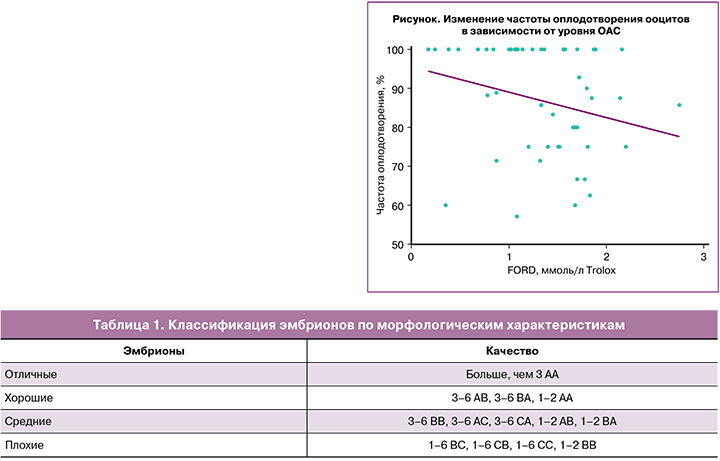
По данным корреляционного анализа была выявлена отрицательная корреляция ОАС эякулята с уровнем оплодотворения ооцитов (r=-0,288; р=0,042), то есть при увеличении ОАС частота оплодотворения снижалась (рисунок).
Также наблюдалась тенденция к наличию положительной корреляционной связи между числом криоконсервированных эмбрионов отличного качества 6-х суток развития и ОАС (r=0,241; р=0,092). Чем выше антиоксидантная способность в эякуляте, тем вероятнее получение эмбрионов отличного качества.
Кроме того, была выявлена тенденция к наличию положительной корреляционной связи со степенью экспансии (формирования полости) бластоцисты, переносимой в полость матки, и ОАС (r=0,275; р=0,058).
Чтобы оценить роль исследуемых факторов в исходах программы ЭКО, было проведено сравнение средних значений в двух группах (пациентки, у которых беременность наступила и не наступила) по U-критерию Манна–Уитни. Результаты анализа представлены в таблице 4.
Было установлено, что среднее число эмбрионов отличного качества (5-й день) в группе женщин с наступившей беременностью – 1,71, тогда как в группе женщин с ненаступившей беременностью – 0,69 (U=128,5; p<0,001). Также в группе женщин с наступившей беременностью среднее количество эмбрионов неудовлетворительного качества на 6-й день – 38,67, а в другой группе – 64,24 (U=180,5; p=0,015). Было проведено сравнение показателей эякулята мужчин в 2 группах. Значимые отличия (U=119,5; p<0,001) были получены при сравнении средних показателей морфологии сперматозоидов. В группе с наступившей беременностью она составила в среднем 2,57%, в группе с ненаступившей – 1,17%.
Не было обнаружено связи между ОАС в эякуляте и исходами программ ВРТ. У пациенток с наступившей беременностью средний уровень ОАС составил 0,57, у пациенток с ненаступившей беременностью – 0,45 (U=285; p=0,627). Связь между ОАС в эякуляте и получением эмбрионов отличного качества не была обнаружена.
Обсуждение
Частота мужского бесплодия остается высокой, следовательно, исследование его причин является обязательным. Оксидативный стресс рассматривают как одну из таких причин [27, 28]. Есть ряд исследований, доказывающих важность правильного функционирования антиоксидантной системы в эякуляте у мужчин. Показано, что при необструктивной форме азооспермии в семенной плазме и сыворотке крови усиливаются процессы ПОЛ, снижаются концентрация восстановленного глутатиона и активность ферментов глутатионовой антиоксидантной системы (глутатионпероксидазы и глутатионтрансферазы) [29].
Sharma et al. установили, что дисбаланс между выработкой АФК и ОАС в семенной жидкости указывает на окислительный стресс и коррелирует с мужским бесплодием. Составной показатель АФК/ОАС может быть более сильно коррелирован с бесплодием, чем только АФК или ОАС [30].
При этом исследования Mahfouz et al. показывают, что ОАС семенной плазмы, измеряемая с помощью колориметрического анализа, является надежным и простым тестом для диагностики и лечения мужского бесплодия [31]. Результаты экспериментальных работ на моделях животных показали, что снижение антиоксидантной способности и повышение перекисного окисления белков в семенной плазме у собак ассоциировано с плохим качеством спермы, а также с бесплодием [32].
В нашем исследовании не было цели связать уровень ОАС с мужским бесплодием, так как эта тема хорошо изучена. Мы акцентировали свое внимание на влиянии уровня ОАС в эякуляте на особенности эмбриологического этапа программ лечения бесплодия методами ВРТ. В работе показано значимое снижение частоты оплодотворения ооцитов при повышении ОАС в эякуляте. В исследованиях зарубежных авторов показано, что одним из главных патофизиологических эффектов свободных радикалов является повреждение клеточной мембраны сперматозоида и ооцита путем ПОЛ [33]. Сперматозоиды особенно восприимчивы к окислительному стрессу из-за высокого содержания омега-3 полиненасыщенных жирных кислот в мембране и достаточно ограниченной способности к защите от окисления в их цитоплазме. При оплодотворении изменение физиологических свойств мембраны мужских половых клеток может вызывать нарушение процессов капацитации, акросомальной реакции и слияния гамет. При экстракорпоральном оплодотворении методом ИКСИ в ооцит помещают сперматозоид с мембраной, что действительно может приводить к нарушению процесса высвобождения мужского генетического материала и формирования пронуклеусов. Измененные свойства мембраны мужских половых клеток, особенно это касается текучести липидов, могут приводить к блоку формирования пронуклеусов и, как следствие, отсутствию/снижению частоты оплодотворения. В настоящей работе анализ показателей эмбриологического этапа программы лечения бесплодия методами ВРТ выявил это. Открытым остался вопрос изменения липидного состава мембраны сперматозоида под действием окислительного стресса. Планируется изучить его в следующих научных проектах.
Заключение
Стандартные параметры анализа спермы, такие как морфология, количество и подвижность сперматозоидов, важны для прогнозирования фертильности больших популяций, но их недостаточно для полного определения способности сперматозоидов мужчины оплодотворять яйцеклетку. Эякулят также содержит компоненты, которые могут влиять на оплодотворяющую способность сперматозоидов и которые до сих пор остаются малоизученными. Определение параметров прооксидантно-антиоксидантного баланса, таких как ОАС и АФК, в эякуляте у мужчин позволит назначать терапию с целью улучшения исходов программ лечения бесплодия методами ВРТ. Терапия в рамках прегравидарной подготовки супружеских пар к ЭКО в настоящий момент активно обсуждается среди специалистов.



