Образования яичников (ОЯ) представляют собой гетерогенную группу заболеваний с полиморфной гистологической структурой. Рак яичников (РЯ) занимает 7-е место в структуре всех злокачественных новообразований и 3-е место среди гинекологических новообразований [1]. ОЯ диагностируются у 1 из 10 женщин, при этом около 2% ОЯ являются злокачественными или пограничными [2, 3]. Злокачественные ОЯ имеют наиболее высокие показатели летальности среди всех гинекологических злокачественных новообразований. По данным American Cancer Society (ACS), рак яичников занимает 5-е место в структуре смертности от всех злокачественных новообразований у женщин [4]. Высокие показатели смертности от РЯ обусловлены выявлением заболевания на поздних стадиях (III–IV), что связано с трудностями ранней диагностики и отсутствием патогномоничного симптомокомплекса на ранних этапах развития болезни [5, 6]. Зачастую жалобы пациенток при РЯ неспецифичны и обусловлены распространенностью опухолевого процесса. Среди жалоб наиболее частыми являются: повышенная утомляемость, слабость, боль и ощущения вздутия в животе, увеличение его в объемах, запоры, нарушения мочеиспускания, боли в спине [6, 7].
У большинства пациенток (≤75%) РЯ диагностируется на III–IV стадиях [8], когда имеется выраженное распространение опухолевого процесса (преимущественно по брюшине) и отдаленное метастазирование. В 70% случаев летальность и рецидив приходятся на первые 5 лет жизни после установления диагноза. Таким образом, лишь в 30% и менее диагноз устанавливают на ранних стадиях, когда потенциально может быть положительный прогноз, что позволяет повысить выживаемость среди больных РЯ [5]. Раннее выявление РЯ позволяет увеличить процент пятилетней выживаемости до 93%, однако до настоящего времени эффективных скрининговых программ не разработано [9].
Согласно исследованию Freddie Br. и соавт., в 2018 г. в мире было диагностировано 295 414 новых случаев РЯ и зафиксировано 184 799 летальных случаев в течение первого года от момента установки диагноза [10]. В структуре онкологической заболеваемости РЯ занимает лидирующие позиции среди причин смертности у женщин во всем мире.
В России на 2019 г. заболеваемость РЯ составила 78,7 случаев на 100 000 женщин, при этом летальность в течение первого года после установления диагноза достигала 19,4%. Высокие показатели смертности при РЯ обусловлены поздней диагностикой. Так, удельный вес РЯ, диагностированного на III и IV cтадиях, из числа впервые выявленных злокачественных новообразований в России в 2019 г. составил 38,4% и 20,0% соответственно [11].
Несмотря на активное развитие диагностических возможностей, проблема раннего выявления ОЯ и дифференциальной диагностики является крайне актуальной. Отсутствие детальной характеристики структуры, распространенности процесса, в ряде случаев – корректной органопринадлежности образования на этапе неинвазивной диагностики ограничивает возможности и эффективность лечения. Определяющим фактором при выборе тактики ведения пациенток является комплекс уточняющей диагностики выявленных изменений яичников. Выбор консервативного подхода в случае функциональных и доброкачественных изменений, малоинвазивной хирургии с функциональным и органосохраняющим подходом у женщин репродуктивного возраста при доброкачественных и пограничных опухолях, максимально радикальный объем в объеме экстирпации матки с придатками и резекцией большого сальника основываются на данных дифференциальной диагностики [7, 12].
Учитывая тенденцию к «омоложению» РЯ и повышение частоты пограничных опухолей у молодых пациенток активного репродуктивного возраста, требуется четкая стратификация рисков при определении или исключении признаков злокачественности, определяющая возможность проведения органосохраняющего лечения либо необходимость комбинированного лечения в сочетании неоадъювантной и/или адъювантной химиотерапии с дополнительными возможностями криоконсервации ткани яичника при необходимости [6, 7].
Скрининг
На сегодняшний день не существует скрининга РЯ на ранних стадиях с эффективной доказательной базой. Henderson J.T. и соавт. в своей статье рассматривают два крупных исследования в США – US Preventive Services Task Force (USPSTF) и Великобритании – UK Collaborative Trial of Ovarian Cancer Screening (UKCTOCS), в которых была изучена эффективность скрининга РЯ, у женщин в менопаузальном периоде, в возрасте 50–75 лет, при отсутствии клинических проявлений. Предложенная программа скрининга РЯ основывалась на измерении уровня маркера СА-125 в сыворотке крови и трансвагинальном УЗИ органов малого таза [12–14]. По результатам этих исследований было доказано, что данные подходы имеют низкую положительную прогностическую ценность, неэффективны в снижении смертности от РЯ и приводят к повышенной морбидности, связанной с увеличением числа оперативных вмешательств у пациенток с ложноположительными результатами. Представленные исследования продемонстрировали отсутствие корреляции между проведением скрининга и снижением процента смертности от РЯ [12].
В связи с этим авторы исследования USPSTF не рекомендует проводить скрининг бессимптомным пациенткам (уровень убедительности рекомендаций D), поскольку «вред» скрининга, скорее, превышает «пользу», т.е. затраты на проведениескрининга не оправданы и не приводят к снижению смертности от данной патологии. USPSTF имеет достаточную доказательную базу для того, чтобы утверждать, что данная скрининговая программа может привести к серьезным негативным последствиям, так как проведение скрининга бессимптомным пациенткам продемонстрировало большое количество ложноположительных результатов, а в дальнейшем нецелесообразные хирургические вмешательства. В зависимости от типа используемого скрининга количество негативных последствий варьируется от умеренных до значительных [12–14].
Таким образом, на сегодняшний день не существует эффективных программ скрининга, повышающих процент ранней диагностики в сочетании с последующим снижением показателей смертности от РЯ.
Диагностика
Помимо отсутствия эффективного скрининга РЯ, весьма актуальной остается проблема разработки комплексного высокоинформативного алгоритма дифференциальной диагностики ОЯ. На ранних стадиях РЯ характеризуется отсутствием либо проявлением незначительной неспецифической симптоматики, которую пациентки зачастую игнорируют. В связи с этим раннее клиническое выявление заболевания затруднительно или невозможно вовсе [15].
В рутинной клинической практике на первом этапе диагностического поиска выполняют гинекологический осмотр, полное физикальное обследование, а также определяют уровень маркера CA-125. Однако в многочисленных исследованиях была доказана низкая результативность данного диагностического теста, в особенности для ранних стадий РЯ. Изменение уровня маркера СА-125 у больных РЯ при I стадии встречается лишь в 23–50% случаев. При этом повышение уровня СА-125 не является патогномоничным признаком для РЯ и может встречаться при других физиологических или патологических состояниях (менструация, беременность, эндометриоз, заболевания органов малого таза, кисты яичников, опухоли других локализаций, особенно при поражениях брюшины) [16].
Методом выбора при визуализации ОЯ является ультразвуковое исследование (УЗИ) как наиболее доступный и экономически выгодный метод диагностики [17, 18]. УЗИ характеризуется высокой диагностической информативностью в выявлении и дифференциальной диагностике ОЯ.
На сегодняшний день разработано множество различных систем оценок ОЯ, основанных на клинических, биохимических (уровень онкомаркера CA-125 или белка 4 эпидермиса человека, НЕ4) и ультразвуковых критериях (ROMA, RMI и др.) [16, 19, 20].
В 2000 г. Timmerman D. и соавт. в рамках Международной группы анализа опухолей (International Tumor Analysis Group, IOTA) предложили единую терминологию для описания ОЯ в клинической практике и в последующих исследованиях. Однако в 18–31% случаев при ОЯ УЗИ не позволяет дифференцировать доброкачественные изменения от злокачественных даже при использовании разработанных систем оценок, в т.ч. критериев международной группы по анализу ОЯ IOTA (англ. International Ovarian Tumor Analysis) [21, 22].
В дальнейшем с целью дифференциации доброкачественных ОЯ от злокачественных были созданы аналитические модели «Простые правила» («Simple Rules») и Assessment of Different Neoplasias in the adnexa (ADNEX) [22–24].
В 2009 г. Amor F. и соавт. [25] предложили внести в «Систему отчетов и данных гинекологической визуализации» (Gynecologic Imaging Reporting and Data System, GI-RADS) для оценки и стратификации рисков злокачественности новообразований ОЯ использование трансвагинального УЗИ. Основным недостатком системы GI-RADS, в отличие от моделей IOTA, является отсутствие объективных критериев для оценки ОЯ, повышающее операторозависимость исследования [25, 26].
Система оценки O-RADS
В связи с недостаточной эффективностью систем оценки ОЯ, предложенных ранее, в 2015 г. под руководством американского колледжа радиологии (англ. American College of Radiology, ACR) был создан комитет по вопросам формирования системы отчетности и анализа полученных данных при исследовании яичников (англ. Ovarian-Adnexal Reporting and Data System, O-RADS), целью которого стала стандартизация терминологии и разработка шкалы оценки результатов УЗИ для описания ОЯ [27].
Помимо стандартизации полученных данных, полученных при УЗИ, основными целями O-RADS также явилось улучшение междисциплинарных взаимодействий специалистов и повышение точности диагностики [27].
В этой связи в 2018 г. ACR опубликовали утвержденную стандартизированную шкалу оценки результатов УЗИ – O-RADS, включающую в себя общие морфологические дескрипторы, позволяющие охарактеризовать ОЯ. На сегодняшний день алгоритм O-RADS максимально подробно описывает УЗ-характеристики и на основе большого количества проведенных исследований и экспертной оценки продемонстрировал высокую эффективность в клинической практике [27].
Однако ограничения информативности УЗИ в дифференциальной диагностике ОЯ и риски диссеминации опухолевого процесса при биопсии кистозных ОЯ требуют расширения диагностического алгоритма у больных с подозрением на злокачественные новообразования яичников. Поэтому эксперты Европейского общества урогенитальной радиологии (European Society of Urogenital Radiology, ESUR) пациенткам с ОЯ неясной этиологии или подозрении на злокачественный опухолевый процесс с целью уточняющей диагностики рекомендуют выполнение магнитно-резонансной томографии (МРТ) [27–29].
На сегодняшний день МРТ обладает наибольшей точностью и является золотым стандартом при уточняющей и дифференциальной диагностике ОЯ [25]. Однако несмотря на более высокие показатели специфичности МРТ (85,5–92% и 63,9–78,4%, МРТ и УЗИ соответственно) в оценке характера ОЯ [25, 28], интерпретация результатов и корректная стратификация рисков злокачественности ОЯ сохраняют ряд ограничений. До настоящего времени в клиническую практику не внедрены унифицированные системы оценки МРТ при ОЯ, позволяющие нивелировать процент диагностических ошибок и повысить междисциплинарную коммуникацию с гинекологами и онкологами. Кроме того, в различных учреждениях используются различные протоколы проведения МРТ при патологии яичников. Все это приводит к значительной вариабельности при интерпретации результатов МРТ не только на международном уровне, но и среди медицинских учреждений внутри страны [27, 28].
Использование стандартизированных подходов и унифицированной системы интерпретации МРТ при оценке состояния яичников позволит стратифицировать риски злокачественных новообразований, что отразится на тактике введения пациенток с ОЯ и выборе лечебной стратегии, включая вид и объем лечения.
В 2013 г. группой авторов была разработана первая система МР-оценки ОЯ – ADNEX MR (англ. Adnexal lesions magnetic resonance imaging scoring system (AMRSS)). На протяжении 7 лет данная система претерпевала обновления с целью улучшения диагностических данных [29, 30].
В 2020 г. AMRSS была интегрирована в стандартизированный протокол оценки результатов и стратификации рисков злокачественности ОЯ в качестве O-RADS MRI (Ovarian-Adnexal Reporting and Data System Magnetic Resonance Imaging) [30].
С целью подтверждения эффективности данного алгоритма Thomassin-Naggara и соавт. (2013–2015 гг.) провели большое проспективное многоцентровое исследование, основной задачей которого было проверить достоверность 5-балльной оценки системы отчетности яичников O-RADS MRI для стратификации рисков злокачественности ОЯ на основе полученных изображений МРТ [29, 31].
В данное многоцентровое когортное исследование были включены 1340 женщин в возрастной категории от 18 до 96 лет (средний возраст 49 лет) с недифференцированными ОЯ по данным УЗИ. Критериями исключения были беременность или любое противопоказание к МРТ. Всем пациенткам было проведено МРТ органов малого таза (с использованием высокопольных систем, с напряженностью магнитного поля от 1,5 до 3Т). Протокол МРТ включал следующие импульсные последовательности: Т1- и Т2-взвешенные изображения (ВИ), с подавлением сигнала от жира и без, динамическая Т1 с внутривенным введением гадолиний-содержащих контрастных препаратов (КП), а также диффузионно-взвешенные последовательности (DWI). В случае если на Т1-ВИ и Т2-ВИ не было выявлено ОЯ, DWI и МРТ с внутривенным контрастированием были не обязательны. Помимо данных МРТ, в исследовании анализировались: клиническая симптоматика, результаты УЗИ и показатели CA-125 при наличии. По результатам исследования чувствительность алгоритма составила 0,93 и специфичность – 0,91 [31].

В таблице приведены основные МР-характеристики ОЯ и баллы системы оценки O-RADS MRI.
O-RADS MRI включает в себя пять категорий, определяющих вероятность риска злокачественности определяемых изменений (таблица). Алгоритм O-RADS MRI основан на характеристиках полученных изображений, используемых с целью дифференциации характера новообразований с неопределенной степенью злокачественности по результатам УЗИ.
 В соответствии с системой O-RADS MRI первая категория присваивается при отсутствии изменений в яичниках или патологических состояний, имитирующих ОЯ. Наиболее часто дифференциальный диагноз проводится с новообразованиями матки, в первую очередь лейомиомами, которые могут иметь крайне вариабельные МР-характеристики (клеточные миомы с кистозной трансформацией, выраженными дегенеративно-дистрофическими изменениями). При МР-оценке для лейомиом характерен «симптом клешни» – нормальная ткань миометрия охватывает плотное образование, в ряде случаев могут иметь межсвязочную локализацию или связана с маткой ножкой, содержащей питающие сосуды (рис. 1).
В соответствии с системой O-RADS MRI первая категория присваивается при отсутствии изменений в яичниках или патологических состояний, имитирующих ОЯ. Наиболее часто дифференциальный диагноз проводится с новообразованиями матки, в первую очередь лейомиомами, которые могут иметь крайне вариабельные МР-характеристики (клеточные миомы с кистозной трансформацией, выраженными дегенеративно-дистрофическими изменениями). При МР-оценке для лейомиом характерен «симптом клешни» – нормальная ткань миометрия охватывает плотное образование, в ряде случаев могут иметь межсвязочную локализацию или связана с маткой ножкой, содержащей питающие сосуды (рис. 1).
Все выявленные образования подвергаются оценке и стратификации рисков малигнизации, которые оценивают по следующим критериям:
- оценка размеров и структуры на нативных изображениях (гладкие или неоднородные перегородки, утолщения перегородок, папиллярные разрастания, мягкотканные компоненты, преимущественно кистозная, солидная или смешанная структура);
- характеристика содержимого кистозного компонента (жир, простая жидкость, жидкость с высоким содержанием белка, кровь);
- характеристика солидного компонента на Т2-ВИ, наличие ограничения свободной диффузии в солидном компоненте/папиллярных разрастаниях при высоких значениях b-фактора (800–1000);
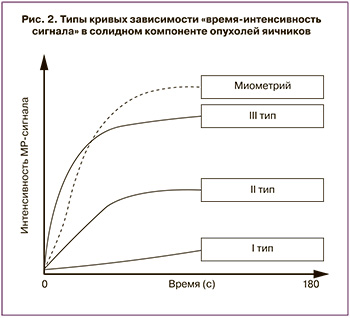
- определение типа кривой «время-интенсивность сигнала» солидного компонента ОЯ – как наиболее доступный/широко распространенный способ постпроцессинговой оценки динамического контрастирования (рис. 2).
 Образования второй категории имеют низкий потенциал злокачественности (около 2–5%), к ним относят простые однокамерные кистозные структуры без солидных компонентов и эндометриомы [13, 16, 21]. Кистозные структуры, заполненные серозной жидкостью (содержимое однородное, гипоинтенсивные на Т1-ВИ, гиперинтенсивные на Т2-ВИ), без солидных компонентов чаще всего являются фолликулярными кистами или серозными цистаденомами. В большинстве наблюдений (до 80%) полностью регрессируют при динамическом исследовании через 3 месяца (рис. 3). Функциональные кисты с кровоизлиянием – геморрагические – как правило, имеют гиперинтенсивный сигнал и на Т1-ВИ, и на Т2-ВИ в содержимом. Кисты с высокобелковым содержимым без утолщения стенки, как правило, представляют собой муцинозные цистаденомы, реже – регрессирующие геморрагические кисты.
Образования второй категории имеют низкий потенциал злокачественности (около 2–5%), к ним относят простые однокамерные кистозные структуры без солидных компонентов и эндометриомы [13, 16, 21]. Кистозные структуры, заполненные серозной жидкостью (содержимое однородное, гипоинтенсивные на Т1-ВИ, гиперинтенсивные на Т2-ВИ), без солидных компонентов чаще всего являются фолликулярными кистами или серозными цистаденомами. В большинстве наблюдений (до 80%) полностью регрессируют при динамическом исследовании через 3 месяца (рис. 3). Функциональные кисты с кровоизлиянием – геморрагические – как правило, имеют гиперинтенсивный сигнал и на Т1-ВИ, и на Т2-ВИ в содержимом. Кисты с высокобелковым содержимым без утолщения стенки, как правило, представляют собой муцинозные цистаденомы, реже – регрессирующие геморрагические кисты.
Эндометриоидные кисты характеризуются наличием утолщенной стенки с неоднородным геморрагическим содержимым, без солидных компонентов (важно дифференцировать наличие пристеночных тромбов – не накапливают контрастный препарат). Из-за геморрагического компонента на Т1-ВИ эндометриоидные кисты имеют преимущественно высокую интенсивность сигнала, на Т2-ВИ, в отличие от геморрагических кист, низкую, не исчезают при последующем наблюдении (рис. 4) [1]. В редких случаях, менее 1%, могут подвергаться малигнизации [7, 8, 32].

Кистозные тератомы без убедительных признаков наличия солидного компонента также относятся ко 2 категории. За счет наличия жирового компонента для них характерен гиперинтенсивный сигнал на Т1-ВИ и Т2-ВИ, с его характерным снижением в режиме с жироподавлением (FatSat). В них могут обнаруживаться волосы, кальцификаты (рис. 5).
Во вторую категорию также входят солидные/предоминантно солидные опухоли, имеющие характерный паттерн, так называемый «темный-темный» («dark-dark») – гипоинтенсивный сигнал на Т2-ВИ и DWI. Такие сигнальные характеристики типичны для доброкачественных опухолей: аденофибромы, фибромы, фибротекомы, доброкачественных вариантов опухоли Бреннера. При динамическом контрастировании, как правило, слабо и медленно накапливают контрастный препарат, имеют кривую перфузии первого типа (рис. 1, 6) [33].
У новообразований 3 категории группы вероятность злокачественности (PPV) составляет 4,3%. В эту группу относят все кистозные образования с солидными компонентами, кисты с геморрагическим или белковым содержимым, у которых выявлено повышенное накопление контрастного вещества в капсуле, но не в структурах, многокамерные кисты без солидных компонентов. Кистозные образования с солидным компонентом, имеющим повышенный сигнал на DWI с высоким значением b-фактора, при этом обязательное условие определения в третью категорию – характер накопления контрастного препарата с кривой 1 типа. При исследовании геморрагических и белковых кист рекомендовано применение субтракции, так как такие образования гиперинтенсивны на Т1-ВИ. К этой категории также относят кистозно-солидные образования с жировым компонентом, имеющие неоднородный солидный компонент (дермоидный бугорок) с 1 типом кривой накопления контрастного препарата.

Многокамерные кисты могут быть физиологическими, доброкачественными или злокачественными кистозными опухолями. Отсутствие в многокамерной кисте солидных элементов говорит в пользу ее доброкачественности. Ключевым этапом оценки является характеристика содержимого, поскольку в ряде случаев функциональные геморрагические кисты, эндометриомы, кисты желтого тела, образования воспалительной природы (абсцессы) могут иметь вариабельные, в т.ч. неоднородно утолщенные перегородки – при этом солидных компонентов не присутствует (рис. 7, 8).
Новообразования, относящиеся к 4 категории, с высокой долей вероятности являются злокачественными: PPV 69% [34]. Это образования, содержащие солидный компонент, в котором имеет место выраженное ограничение свободной диффузии – гиперинтенсивный сигнал от солидного компонента на DWI при высоком значении b-фактора (подтвержденное на ИКД-картах), при введении контрастного препарата солидный компонент накапливает контрастный препарат по 2 типу кривой (рис. 9). Несмотря на то что вероятность злокачественности образований этой категории высока, некоторые доброкачественные новообразования могут иметь аналогичные МР-характеристики (например, текомы) (рис. 10).

В 5 категорию относят образования с высокой вероятностью злокачественности: PPV – 97,6% [31, 33]. Как и образования 4 категории, солидные компоненты имеют признаки ограничения диффузии (гиперинтенсивный сигнал на DWI), раннего активного накопления и выделения контрастного препарата, образования характеризуются МР-признаками инвазивного роста – инфильтрацией прилежащих органов, распространением по париетальной и висцеральной брюшине, метастатическим поражением лимфоузлов (рис. 11).
При этом следует учитывать, что в очень редких случаях доброкачественные новообразования могут иметь кривую перфузии третьего типа, например, struma ovarii – редкая форма тератомы, состоящая преимущественно из тканей щитовидной железы [14].
Данная система показала хорошие результаты на практике [30, 34–37]. Так, в 2016 г. Ruiz M. и соавт. опубликовали результаты внешней оценки, где продемонстрировали следующие показатели: чувствительность составила 91,7% (95% ДИ 73–99%), специфичность 92,7% (95% ДИ 86,7–96,6%) [35].
В 2018 г. Pereira P.N. и соавт. отобразили в своей публикации также высокие показатели: 94,9% (95% ДИ 87,5–98,6%) чувствительность и 97,5% (95% ДИ 93,6–99,3%) специфичность [30].
Вслед за ними Sasaguri K. и соавт. (2019) представили показатели своих исследований: чувствительность 85,6% (95% ДИ 79,8–90,3%), специфичность 91,7% (95% ДИ 89,2–93,8%) у 1-й группы исследователей и 84,6% (95% ДИ 78,6–89,4%), специфичность 91,9% (95% ДИ 89,4–93,9%) у 2-й [34].
Согласно данным, полученным при внешней валидации, проведенной в ФГБУ «НМИЦ АГиП им. акад. В.И. Кулакова» МЗ РФ (118 пациенток, 2019 г.), система O-RADS MRI продемонстрировала высокую информативность: чувствительность 91,3% (95% ДИ 86,1–94,8%) и специфичность 96,7% (95% ДИ 92,3–98,6%) в прогнозировании злокачественности. При этом наибольшие трудности в оценке образований возникали при характеристике пограничных муцинозных опухолей эпителиальной группы и неэпителиальных с низкой степенью злокачественности [36].
Заключение
Неинвазивная визуализационная диагностика образований яичников в большинстве случаев проводится с использованием УЗИ, что позволяет проанализировать структуру, органопринадлежность и риски злокачественности у большинства пациенток. При этом в определенных случаях, связанных с крупными размерами образования, наличием выраженных спаечных процессов, нарушением анатомических соотношений после повторного оперативного лечения, а также сложной внутренней структурой образований, требуется проведение уточняющей диагностики.
Поскольку МРТ обладает высокой специфичностью, в соответствии с актуальными рекомендациями, в том числе экспертов ESUR и ACR, метод рекомендован пациенткам с пограничным риском злокачественности в качестве золотого стандарта.
С целью стандартизации полученных данных и формирования единой терминологии в рамках междисциплинарного подхода был разработан алгоритм O-RADS MRI, который позволяет повысить информативность дифференциальной диагностики ОЯ. Система оценки O-RADS MRI обладает важными характеристиками: простота использования, четкие критерии оценки, воспроизводимость и высокая информативность.
При этом необходимы дальнейшие масштабные исследования с детальной разработкой маршрутизации пациенток на основе полученных данных, поскольку система O-RADS MRI представляет важную информацию для определения стратегии лечения, позволяя учитывать риски малигнизации, что в сочетании с анализом преимуществ ожидаемого консервативного/хирургического лечения в каждом конкретном случае позволяет выработать оптимальную тактику ведения пациентки.



