Расширение представлений о гетерогенной природе преэклампсии (ПЭ) позволило выделить два клинических фенотипа (ПЭ с ранним началом – манифестация до 34 недель и ПЭ с поздним началом – после 34 недель беременности), которые имеют разную патофизиологию и тяжесть течения заболевания и, соответственно, разные исходы беременности [1]. Для обоих клинических фенотипов также характерны различные патофизиологические изменения сердечно-сосудистой системы (ССС) матери, поскольку нарушенный морфогенез плаценты и плацентарная ишемия вызывают изменения кровотока в фетоплацентарной системе, а также нарушение регуляции системного артериального давления (АД). Эти последствия реализуются в дезадаптации материнской гемодинамики и гемодинамики фетоплацентарной системы [2–4].
Гемодинамический профиль матери оценивается в настоящее время по данным суточного мониторирования артериального давления (СМАД) с определением ограниченного набора показателей, отражающих суточный профиль АД и ригидность артерий по индексу аугментации (AIx) [5–7]. Однако для анализа функционального состояния ССС беременной и отдаленного прогноза осложнений необходима комплексная оценка, учитывающая как базовые, так и ряд дополнительных параметров гемодинамики. В частности, один из вариантов методики СМАД, выполняемый с помощью портативного регистратора суточного монитора BPLab, данные которого анализируются с использованием технологии Vasotens, позволяет оценить расширенный спектр показателей не только ригидности артерий, но и функционирования миокарда [8]. Эти параметры могут быть информативны для понимания и прогноза ухудшения состояния беременной в динамике, однако в клинической практике в настоящее время не используются.
Не менее значимой проблемой является отсутствие эффективной гипотензивной терапии при ПЭ: лечение является симптоматическим и не обеспечивает стойкого клинического эффекта, особенно при ПЭ с ранним началом. Однокомпонентная – метилдопа (Допегит) и комбинированная двухкомпонентная – Допегит в сочетании с нифедипином (Кордафлекс) терапия не всегда эффективна, и их воздействие на гемодинамический профиль матери не оценено в должной степени. Допегит и Кордафлекс относятся к группе гипотензивных лекарственных средств и имеют разный механизм действия [9]. Полученные нами ранее данные свидетельствуют о различном воздействии обоих препаратов на ключевую стадию эндотелиальной дисфункции – деструкцию поверхностного слоя эндотелиальных клеток – эндотелиального гликокаликса (эГК), которая является одним из ведущих патогенетических факторов ПЭ обоих клинических фенотипов [10–12]. Однако не установлен эффект этих препаратов на гемодинамический профиль матери с учетом расширенного спектра показателей.
Целью данного исследования явилась оценка влияния одно- и двухкомпонентной гипотензивной терапии на гемодинамический профиль матери и выявление связи между гемодинамическими параметрами, характеризующими изменения материнской гемодинамики, и параметрами гемодинамического профиля в системе мать-плацента-плод, а также показателями деструкции эГК при ПЭ с ранним и поздним началом.
Материалы и методы
В данное интервенционное продольное исследование были включены 82 пациентки во II и III триместрах беременности, из которых в группу сравнения вошли 30 женщин с неосложненной беременностью (группа 1А – пациентки II триместра (n=15), группа 1Б – пациентки III триместра (n=15)); в основную группу – 52 пациентки с ПЭ (группа 2А – пациентки с ранней ПЭ (n=12), получавшие монотерапию; группа 2Б – пациентки с ранней ПЭ, получавшие двухкомпонентную терапию (n=12); группа 3А – пациентки с поздней ПЭ на монотерапии (n=16); группа 3Б – пациентки с поздней ПЭ, получавшие двухкомпонентную терапию (n=12)). Исследование проводилось на базе ФГБУ «НМИЦ АГП им. академика В.И. Кулакова Минздрава России» (далее – Центр) с января 2021 г. по май 2022 г. и было организовано в соответствии с принципами Хельсинкской декларации Всемирной медицинской ассоциации с изменениями на 64-й генеральной Ассамблее ВМА (Форталеза, Бразилия, 2013 г.). План исследования был представлен и одобрен на локальном этическом комитете Центра (протокол №5 от 27 мая 2021 г.). Ранняя ПЭ регистрировалась при манифестации симптоматики до 34 недель беременности, поздняя – соответственно после 34 недель. Критериями включения в исследование для всех групп были: спонтанная одноплодная беременность, возраст 18–42 лет, подписанное информированное согласие на участие в исследовании. Критерии включения в основную группу: диагноз ПЭ, установленный по критериям, согласно клиническим рекомендациям Минздрава России [13]; в группу сравнения: физиологическая беременность. Критерии невключения: беременность, наступившая в результате применения вспомогательных репродуктивных технологий, тяжелая экстрагенитальная патология, наличие трансплантированных органов, онкологические заболевания, системные ревматологические и аутоиммунные заболевания. Критерии исключения: HELLP-синдром, хромосомные аномалии у плода, пороки развития плода, инфекционные и вирусные заболевания в стадии обострения. Пациенты включались в исследование методом подбора пар на основании возраста, индекса массы тела и срока беременности.
Всем пациенткам основной группы проводились стандартное обследование и лечение в условиях стационара. Пациентки группы сравнения медикаментозную терапию не получали. Базисная терапия 1-й линии была представлена гипотензивным средством центрального действия «Допегит», дозировка которого определялась степенью тяжести гипертензии. Средняя суточная доза препарата составляла 1500 мг. При наличии стойкой гипертензии, несмотря на прием Допегита в максимальной суточной дозировке (2000 мг), пациентке дополнительно назначался блокатор кальциевых каналов пролонгированного действия «Кордафлекс». Его средняя суточная дозировка составляла 40 мг. Показанием для старта гипотензивной терапии являлась регистрация стойкого повышения АД≥140/90 мм рт. ст. Эффективность проводимой терапии оценивалась по данным записей в истории болезни (контроль АД осуществлялся 4–6 раз в сутки самой пациенткой и медицинским персоналом). Средняя длительность терапии составила в группе 2А – 14,83 (3,5); в группе 2Б – 43,33 (15,7); в группе 3А – 11,81 (8,62); в группе 3Б – 52,55 (8,46) дня. Поскольку в основную группу также были включены пациентки с хронической артериальной гипертензией, они, как правило, получали гипотензивную терапию еще до манифестации ПЭ. Однако развитие у них ПЭ требовало оптимизации терапии.
Гипотензивная терапия, согласно клиническим рекомендациям [13], назначалась при АД≥140/90 мм рт. ст. С целью коррекции терапии у всех пациенток проводилось СМАД с помощью прибора BPLab («Петр Телегин», Нижний Новгород, Россия), который рекомендован к использованию у беременных [14]. Был использован монитор АД BPLab МнСДП-2 (суточный монитор с регистрацией давления в манжете (осциллограммы) для повышения достоверности мониторинга АД) с дополнительным аускультативным каналом, но без ЭКГ-датчика. Интервалы между измерениями составляли 30 минут в дневное и 60 минут в ночное время. Осциллограммы анализировали с помощью программного обеспечения Vasotens (Россия), определяли ряд гемодинамических показателей. Для характеристики изменения центрального давления в аорте, оценки артериальной ригидности и внутрисердечной гемодинамики использовали следующие показатели: максимальное аортальное диастолическое АД (макс ДАДао); максимальное аортальное систолическое АД (макс САДао); минимальное аортальное диастолическое АД (мин ДАДао); минимальное аортальное систолическое АД (мин САДао); среднее аортальное диастолическое АД (ср ДАДао); среднее аортальное систолическое АД (ср САДао); время распространения отраженной волны по участку аорты (Reflected Wave Transit Time, RWTT); оценочная скорость пульсовой волны в аорте (Aortic Pulse Wave Velocity, PWVao); AIx; индекс ригидности артерий (Ambulatory Arterial Stiffness Index, АASI) – вычисляется как АASI=1-(наклон ДАД-САД); максимальная скорость нарастания давления (maximal rate of rise of arterial pressure, (dP/dt)max); амплификация пульсового давления (Pulse Pressure Amplification, PPA), длительность периода изгнания (Ejection Duration, ED); индекс эффективности субэндокардиального кровотока (Subendocardial Viability Ratio, SEVR) [8].
Исследование компонентов эГК в крови проводилось методом иммуноферментного анализа. Использовались коммерческие тест-системы производства Cloud-Clone Corp., США: CEA182Ge (определение гиалуронана – минимально детектируемые количества 1,77 нг/мл); SEB966Hu (определение синдекана-1 – минимально детектируемые количества 0,61 нг/мл); SEC463Hu (определение эндокана 1 – минимально детектируемые количества 0,065 нг/мл).
Конечными точками исследования были: средние показатели, характеризующие центральное давление в аорте, артериальную ригидность, внутрисердечную гемодинамику и содержание структурных компонентов эГК в крови; корреляционные связи между содержанием протеогликанов и показателями, характеризующими материнскую гемодинамику, а также гемодинамику фето-плацентарной системы.
Критериями оценки служили: отличия средних значений показателей в группах с однокомпонентной и двухкомпонентной гипотензивной терапией от средних значений показателей в группе с нормальной беременностью; наличие корреляционной связи между показателями.
Статистический анализ
Для статистического анализа и графического представления данных была использована программа MedCalc версия 16.4 (MedCalc, Бельгия). Нормальность распределения количественных показателей оценивали по критерию Шапиро–Уилка. При нормальном распределении был использован критерий Стьюдента. Данные описаны как среднее арифметическое (М) и стандартное отклонение (SD). При распределении данных, отличном от нормального, для выявления достоверности различий между двумя независимыми группами количественных признаков был использован непараметрический U-критерий Манна–Уитни. Данные представлены в виде медианы (Ме) и межквартильного диапазона, характеризующего верхний и нижний квартили [Q25; Q75]. Корреляционный анализ проводился с помощью коэффициента ранговой корреляции Спирмена. Нулевая гипотеза отвергалась при значении p-критерия менее 0,050.
Результаты
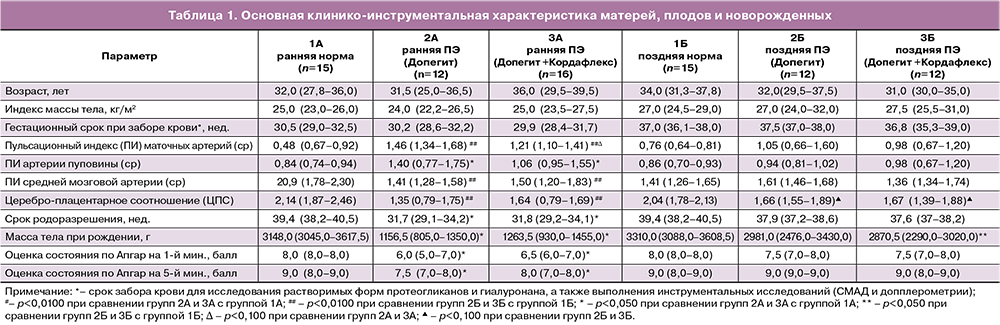
Формирование групп пациенток для исследования проводилось методом подбора пар, вследствие чего по возрасту, массо-ростовым показателям, гестационному сроку при заборе крови на исследование пациентки были сопоставимы. Анализ перинатальных исходов в очередной раз продемонстрировал, что у пациенток с ранним началом ПЭ перинатальные исходы были хуже в сравнении с пациентками с поздней ПЭ. Так, все пациентки данной группы были родоразрешены в значительно более ранние сроки; соответственно, масса новорожденного и оценка по шкале Апгар у них были значимо ниже. При этом вид гипотензивной терапии не повлиял на перинатальные исходы (табл. 1). Срок родоразрешения пациенток с поздней ПЭ был сопоставим с группой сравнения; в то же время средняя масса новорожденных, рожденных от матерей с поздней ПЭ, была значимо ниже, чем в группе сравнения; при этом оценка состояния по шкале Апгар значимо не различалась между данными группами. Важно отметить, что указанные исходы не зависели от проводимой гипотензивной терапии (табл. 1).
Результаты СМАД на фоне применения одно- и двухкомпонентной гипотензивной терапии (рис. 1) демонстрируют, что значения максимального, минимального и суточного центрального АД у пациенток с ПЭ как с ранним, так и с поздним началом значимо выше, чем в группах сравнения в соответствующие гестационные сроки. Значимых различий в значениях АД у пациенток с ПЭ, принимающих одно- и двухкомпонентную гипотензивную терапию, не было выявлено. Однако наблюдается тренд, свидетельствующий, что при ПЭ с ранним началом медианы значений как САД, так и ДАД выше у пациенток, принимающих двухкомпонентную терапию во всех вариантах сравнений. У пациенток с поздним началом ПЭ медианы значений САД и ДАД сопоставимы в большинстве вариантов при обеих схемах терапии (рис. 1).
Совместное использование амбулаторного СМАД с монитором BPLab и технологией Vasotens позволило оценить не только центральное давление в аорте, но и ригидность артерий и ряд показателей функционирования миокарда, что обеспечивает расширенную функциональную диагностику ССС матери (табл. 2 и 3). Установлено, что при ПЭ с ранним началом на фоне монотерапии отмечается компенсация основных гемодинамических параметров, свидетельствующих об эффективном влиянии препарата «Допегит» на ригидность артерий. Однако у этих пациенток выявлено значимое повышение по сравнению с пациентками с физиологической беременностью параметра (dP/dt)max, который является максимальной производной давления в артерии по времени и косвенно отражает сократимость миокарда, суммарную жесткость магистральных артерий и динамическую нагрузку на стенки сосудов во время прохождения пульсовой волны. Значения параметра (dP/dt)max также значимо повышены у пациенток, получающих двухкомпонентную антигипертензивную терапию. При этом действие комбинации препаратов «Допегит» и «Кордафлекс» на ССС матери менее выражено: на фоне их применения установлены более высокие AIx и показатель RWTT (табл. 2).

У пациенток с поздним началом ПЭ при приеме комбинированной двухкомпонентной терапии показатели, оценивающие ригидность артерий и функцию миокарда, были в пределах референсных значений. Напротив, при монотерапии было выявлено значимое повышение значений показателей (dP/dt)max и ED. Показатель ED отражает промежуток времени от начала пульсации до момента закрытия аортального клапана и позволяет косвенно судить о систолической функции миокарда. Погранично значимое повышение AIx также выявлялось у этих пациенток (табл. 3).
Анализ результатов содержания протеогликанов и гиалуронана в крови здоровых пациенток и пациенток с ПЭ, получающих разные схемы гипотензивной терапии, свидетельствует, что у пациенток, получающих монотерапию Допегитом, выявлено значимое повышение уровня синдекана-1 в крови по сравнению с нормальной беременностью в сопоставимые сроки (рис. 2А). На фоне применения двухкомпонентной гипотензивной терапии выявлено значимое снижение уровня гиалуронана и погранично значимое повышение уровня синдекана-1 по сравнению со здоровыми беременными на ранних сроках (рис. 2А, В). У пациенток с поздним началом ПЭ на фоне применения обеих схем гипотензивной терапии значимых различий в содержании свободно циркулирующих протеогликанов и гиалуронана не выявлено, что свидетельствует об отсутствии проявлений дисфункции эГК. Содержание эндокана в крови всех беременных было низким. У части беременных детектируемый уровень эндокана лежал за пределами чувствительности набора, вследствие чего при корреляционном анализе данные содержания эндокана в крови не учитывались.

Для оценки связей между клинико-лабораторными и инструментальными параметрами был проведен корреляционный анализ, учитывающий содержание протеогликанов и гиалуронана в крови матери, усредненные скоростные показатели кровотока в сосудах матки, пуповины и мозговой артерии плода, а также данные комплексного гемодинамического исследования ССС матери. Установлены различные корреляционные профили между исследуемыми показателями в группах исследования как на ранних, так и на поздних сроках беременности (табл. 4, 5).

Обсуждение
Как известно, АД определяется двумя основными факторами: сердечным выбросом и общим периферическим сосудистым сопротивлением. Гемодинамические исследования свидетельствуют о значимых изменениях сердечного выброса и других параметров по мере прогрессирования нормальной беременности, что является компенсаторным механизмом, позволяющим адаптировать ССС матери к нагрузке вследствие увеличенного объема крови [15]. Однако беременность, протекающая на фоне предшествующей гипертензии или впервые развившейся при беременности, характеризуется измененным гемодинамическим профилем [16]. В частности, известно, что основные гемодинамические показатели различны при ПЭ с ранним и поздним началом. Как правило, ранний клинический фенотип ПЭ, сочетанный с задержкой роста плода, является плацента-ассоциированным. Поздний, напротив, связан с наличием у матери соматической патологии (артериальной гипертензии, сахарного диабета, ожирения и др.) и, соответственно, исходного измененного гемодинамического статуса. Как было установлено, гемодинамические профили при ранней ПЭ ассоциированы с высоким общим периферическим сосудистым сопротивлением и низким сердечным выбросом, снижением внутрисосудистого объема; при этом, как правило, значимые сердечно-сосудистые нарушения развиваются у пациенток отсроченно после родов. При поздней ПЭ, напротив, высокий сердечный выброс сочетается с нормальным или низким сосудистым сопротивлением и гиперволемией [17]. Учитывая различную патофизиологию гемодинамических нарушений и различно сформированные гемодинамические профили пациенток с ПЭ с ранним и поздним началом, нами был проведен анализ влияния двух схем гипотензивной терапии на гемодинамику матери с оценкой расширенного спектра показателей.
По данным СМАД установлено, что, несмотря на значимо повышенные показатели САД и ДАД на фоне применения гипотензивной терапии у пациенток с ПЭ, целевые показатели АД были достигнуты (у пациенток с ранней ПЭ – на непродолжительное время). Однако, несмотря на нормализацию АД, минимальные значения САД и ДАД у всех пациенток были значимо выше, чем у здоровых беременных (рис. 1). Несмотря на проводимую гипотензивную терапию, у пациенток с ранней ПЭ не удалось длительно пролонгировать беременность из-за прогрессивного нарастания тяжести гипертензии и ухудшения состояния плода. Это, в свою очередь, привело к досрочному родоразрешению и рождению недоношенных маловесных новорожденных (табл. 1). Не было выявлено значимых различий в массе при рождении и оценке состояния по шкале Апгар, а также параметрам суточного профиля центрального АД в аорте между группами пациенток с ранней ПЭ, получающих моно- и комбинированную терапию (табл. 1). Это обосновывает целесообразность оценки дополнительных расчетных показателей, получаемых при контурном анализе пульсовой волны, характеризующих состояние систолической и диастолической функции сердца, скорость пульсовой волны, показателя субэндокардиального кровотока и др., которые играют существенную роль в оценке состояния ССС. Анализ этих показателей позволил установить, что при ПЭ с ранним началом, несмотря на применяемую терапию, выявляются изменения системной гемодинамики, которые более выражены при приеме комбинированной двухкомпонентной терапии. В частности, измененные параметры, которые не компенсированы применением препаратов «Допегит» и «Кордафлекс», включают: индекс аугментации (AIx) – наиболее часто используемый в клинической практике параметр, который отражает артериальную жесткость; максимальную скорость нарастания давления в артерии по времени (dP/dt)max – характеризует не только сократительную функцию миокарда, но и аортальный статус [18]; оценочную скорость пульсовой волны в аорте (PWVao) – параметр, оценивающий время распространения отраженной волны в аорте (табл. 2). Необходимо отметить, что важнейший параметр PWV (скорость распространения пульсовой волны, СРПВ), рекомендованный как основной параметр оценки жесткости стенки артерии (класс I, уровень доказательности А) [19], который отражает состояние сосудов артериального русла, определяя АД, а также отражает вязкость крови, вследствие чего позволяет комплексно характеризовать функции ССС пациента [20], не оценивается в программном приложении Vasotens. Однако показатель RWTT и взаимосвязанный с ним PWVao являются альтернативными показателями оценки ССС. Повышение всех трех указанных выше показателей у пациенток, принимающих комбинированную гипотензивную терапию, свидетельствует об отсутствии эффекта препаратов на системную гемодинамику (табл. 2). При монотерапии Допегитом у пациенток с ПЭ с ранним началом выявлялось только двукратное увеличение параметра (dP/dt)max по сравнению с аналогичным параметром пациенток с нормальной беременностью. По данным производителя (BPLab), этот показатель косвенно отражает сократимость миокарда, суммарную жесткость магистральных артерий, а также «динамическую» нагрузку на стенки сосудов во время прохождения пульсовой волны [8] (табл. 2).
Гемодинамическое равновесие в ССС более эффективно поддерживалось при применении гипотензивной терапии при ПЭ с поздним началом. При комбинированной двухкомпонентной терапии не выявлялось отличий по дополнительным гемодинамическим показателям по сравнению с их профилем при нормальной беременности (табл. 3), вследствие чего терапию можно оценить как эффективную. Такое заключение подтверждается пролонгированием срока беременности до доношенного в группе пациенток с комбинированной гипотензивной терапией (табл. 1). Монотерапия Допегитом продемонстрировала меньшую эффективность. У пациенток данной группы выявлены: значимо повышенные значения показателя (dP/dt)max и относительной длительности периода изгнания левого желудочка (ED). Пограничную значимость в данной группе пациенток имел показатель AIx (табл. 3). По-видимому, выявленные особенности гемодинамического профиля на фоне монотерапии при ПЭ с поздним началом свидетельствуют об изменениях миокарда у этих пациенток. Такой вывод можно сделать на основании повышения показателя (dP/dt)max, который отражает скорость изменения давления в левом желудочке во время изоволюмического сокращения и характеризует сократимость левого желудочка, что свидетельствует о повышении потребления сердцем кислорода и возрастании нагрузки на сердце, а также функциональных и компенсаторных изменениях миокарда. Этот вывод также подтверждается изменениями показателя ED, свидетельствующего о развитии систолической дисфункции миокарда [21], и выявленным трендом к повышению AIx у пациенток с ПЭ, получающих однокомпонентную терапию на поздних сроках беременности.
Гемодинамический профиль пациенток с ПЭ с ранним и поздним началом до назначения гипотензивной терапии был изучен нами ранее [22]. В данном исследовании были выявлены схожие изменения гемодинамических показателей, которые установлены при отсутствии эффективности применяемых лекарственных средств. Сопоставление ранее полученных данных с продемонстрированными в данном исследовании свидетельствует, что гипотензивная терапия оказывает эффект на ССС даже при ПЭ с ранним началом, поскольку при монотерапии препаратом Допегит ряд показателей скомпенсирован. Аналогично профиль гемодинамических показателей при ПЭ с поздним началом был схожим у пациенток без терапии [22] и с однокомпонентной терапией, что свидетельствует о неэффективности монотерапии при ПЭ с поздним началом.
Функциональное состояние ССС определяется не только состоянием сосудов, в частности их тонусом, эластичностью, сосудистым сопротивлением, но и адекватным функционированием эндотелия. Инициирующим фактором эндотелиальной дисфункции – ключевого патогенетического звена ПЭ, который определяет развитие эндотелиоза и полиорганной недостаточности, – является дисфункция поверхностного протективного слоя, ассоциированного с мембраной эндотелиальной клетки и обращенного в просвет сосуда – эГК [12]. Процесс «сшелушивания» эГК с выделением его структурных компонентов в кровоток установлен при различных заболеваниях, включая ПЭ, и всегда ассоциирован с потерей барьерной, антиадгезивной функций эндотелия, а также с потерей способности поддерживать физиологические значения АД в ССС [11]. Имеются экспериментальные данные о прямой зависимости жесткости сосудов от степени деструкции эГК [23, 24]. В нашем исследовании деструкция эГК установлена только при ПЭ с ранним началом; причем выраженная деструкция наблюдалась при однокомпонентной гипотензивной терапии, что свидетельствует об отсутствии фармакологической протекции эГК под воздействием применяемых лекарственных средств. При комбинированной гипотензивной терапии признаки деструкции эГК были менее выражены, т.к., кроме незначительного повышения содержания синдекана-1 в крови (пограничный уровень значимости), выявлялись значимо более низкое содержание гиалуронана по сравнению с нормальной беременностью (рис. 2). Необходимо отметить, что исследования циркулирующих в крови структурных компонентов эГК проводились при ПЭ и ранее, однако результаты этих исследований противоречивы [13]. В частности, деструкция эГК предполагает интенсивную потерю протеогликанов и гликозаминогликанов из слоя эГК и их повышенное содержание в крови, что было выявлено в нашем предшествующем исследовании, где были охарактеризованы различные молекулярно-функциональные паттерны сосудов при ПЭ с ранним и поздним началом [22]. Однако в ряде исследований выявлены сниженное содержание синдекана-1 и повышенное – гиалуронана при ПЭ, что противоположно эффектам, выявленным нами [25]. В цитируемых выше исследованиях не было указаний на применяемую терапию у пациенток с ПЭ, а также на сопоставимость сравниваемых групп по возрасту и индексу массы тела матерей. В нашем исследовании эти конфаундеры были учтены (табл. 1) и отбор пациенток в исследование производился по методу подбора пар, поскольку известно, что ригидность сосудов повышается с возрастом, а признаки активации системной воспалительной реакции – основного фактора дестабилизации эГК – наблюдаются даже при нормальной беременности, с увеличением гестационного срока, и особенно при ожирении [26]. Отличия в содержании циркулирующих компонентов в крови, полученные нами, могут быть обусловлены особенностями когорты пациентов, но также нельзя исключить присутствие в крови пациенток факторов, маскирующих эти компоненты. В частности, как нами было показано ранее, при ПЭ выявляется повышенный уровень аутоантител к компоненту эГК – гиалуронану, что может, по-видимому, объяснять его снижение в крови у пациенток с ПЭ [27]. Возможно, гипотензивная терапия способствует снижению выделения гиалуронана в кровоток, однако это необходимо доказывать в дальнейшем.
Анализ корреляционных связей между гемодинамическими параметрами матери, фето-плацентарного комплекса и компонентами эГК показал различные паттерны корреляционных связей в группах исследования. Синдекан-1, с учетом значимых различий, выявленных на ранних сроках беременности, по-видимому, выполняет особую роль (рис. 2, табл. 4), которая определяется его меняющейся динамической концентрацией в крови. Синдекан-1 является мультифункциональной молекулой, позитивно и негативно регулирующей процессы ангиогенеза, свертывания крови, воспаления, метаболизма липидов. Установлено, что он влияет на механочувствительность эндотелиальных клеток [28]. Учитывая отсутствие эффективности как моно-, так и комбинированной гипотензивной терапии при ПЭ с ранним началом, влияние синдекана-1 необходимо исследовать более детально, с изучением внутриклеточных сигнальных путей в модельных экспериментах. Корреляционные паттерны, выявленные при ПЭ с поздним началом, с учетом клинической эффективности гипотензивной терапии (особенно комбинированной терапии), напротив, свидетельствуют о позитивном влиянии гиалуронана на гемодинамику фетоплацентарного комплекса (табл. 5).
Заключение
Представленные данные, во-первых, свидетельствуют о наличии патогенетической связи между молекулярными и функциональными изменениями сосудов, которые отчасти компенсируются назначением гипотензивной терапии при ПЭ с ранним и поздним началом. Во-вторых, представлено успешное использование прибора BPLab и ПО Vasotens, позволяющих регистрировать широкий спектр показателей гемодинамического профиля матери для оценки эффективности гипотензивной терапии при обоих фенотипах ПЭ. Отсутствие эффективности гипотензивной терапии при ПЭ с ранним началом подтверждается изменениями гемодинамики, которые не корригируются назначением лекарственных средств. Относительно более выражен протективный эффект монотерапии при ПЭ с ранним началом, однако она не влияет на пролонгирование беременности; но в дальнейшем этот эффект может быть изучен в катамнезе за состоянием ССС пациенток в отдаленном будущем. Эффективность комбинированной гипотензивной терапии при ПЭ с поздним началом подтверждается компенсацией гемодинамических параметров ССС матери, что является важным выводом данного исследования, поскольку дополнительное назначение Кордафлекса производится по показаниям при ухудшении состояния пациенток и неэффективности монотерапии Допегитом. По-видимому, монотерапия при ПЭ с поздним началом менее эффективна, поскольку выявляются измененные показатели, свидетельствующие о дисфункции миокарда.



