В настоящее время большинство циклов лечения бесплодия методом экстракорпорального оплодотворения (ЭКО) проводятся с применением контролируемой стимуляции суперовуляции. Наиболее распространенным в клинической практике протоколом стимуляции яичников является протокол с антагонистами гонадотропин-рилизинг-гормона (ант-ГнРГ). Использование ант-ГнРГ подавляет на определенное время синтез эндогенного лютеинизирующего гормона (ЛГ), что позволяет управлять индуцированным менструальным циклом, предотвращая преждевременную лютеинизацию и делая возможным назначение триггера овуляции для получения зрелых ооцитов.
В естественном цикле пик ЛГ инициирует процесс овуляции и разрыв преовуляторного фолликула. На уровне клеток гранулезы пик ЛГ индуцирует разрыв межклеточных соединений между клетками гранулезы и отделение кумулюс-ооцитного комплекса (КОК), завершение мейотического деления и переход ооцита в фазу зрелости, а также лютеинизацию клеток гранулезы [1].
В течение длительного времени для индукции овуляции в циклах вспомогательных репродуктивных технологий (ВРТ) использовали введение человеческого хорионического гонадотропина (чХГ) – препарата, обладающего способностью связываться с рецепторами ЛГ и замещать его функцию. В 1974 году было показано, что ЛГ и чХГ имеют сходную структуру: идентичность α-субъединицы чХГ с α-субъединицей ЛГ, а также схожесть 85% их β-субъединиц позволяет чХГ связываться с ЛГ-рецептором и активировать его. Тем не менее, данные молекулы не являются абсолютными аналогами по строению и функции, так как чХГ имеет несколько большую по размерам молекулу, гораздо сильнее связывается с рецептором ЛГ и имеет более длительный период полувыведения.
Применение в качестве триггера овуляции препарата агониста гонадотропин рилизинг-гормона (а-ГнРГ) основано на способности данной молекулы замещать ГнРГ на его рецепторах, вызывая кратковременный пик эндогенного ЛГ, достаточный для овуляции.
Предполагается, что использование различных триггеров овуляции не оказывает влияние на качество получаемых в цикле ВРТ ооцитов и эмбрионов [2, 3]. В то же время возможное негативное влияние а-ГнРГ на исходы ВРТ реализуется за счет изменений в течении лютеиновой фазы, которые не могут быть компенсированы путем применения заместительной гормональной терапии [4, 5].
Более детальное изучение данной проблемы показало, что применение различных препаратов в качестве триггера овуляции приводит к различиям в эндокринном статусе периовуляторного периода. Анализ использования а-ГнРГ и чХГ для индукции овуляции показал значимые различия уровней стероидных гормонов и гонадотропинов в фолликулярной жидкости [6].
Кроме того, содержание в фолликулярной жидкости некоторых регуляторных факторов и факторов роста также различалось при использовании протоколов с различными триггерами овуляции [7, 8].
Следует учитывать, что содержание различных биологических веществ в фолликулярной жидкости может не полностью отражать биологические процессы, протекающие в КОК. Клетки кумулюса в процессе фолликулогенеза находятся в метаболическом симбиозе с развивающимся ооцитом, что делает их привлекательным субъектом для проведения исследований по сравнению с фолликулярной жидкостью. Так было показано, что профиль экспрессии генов стероидогенеза различается при использовании для индукции овуляции а-ГнРГ и чХГ [9].
Согласно полученным данным ряда исследователей, транскрипционный профиль клеток кумулюса может быть использован для прогнозирования качества эмбрионов и исходов программ ВРТ [10, 11].
Тем не менее, ни в одном из вышеперечисленных исследований не оценивали влияние а-ГнРГ и чХГ в качестве триггера овуляции на профиль экспрессии генов в клетках кумулюса.
Целью данной работы было изучение транскрипционного профиля (транскриптов) клеток кумулюса при использовании а-ГнРГ и чХГ в качестве триггера овуляции, а также возможности использования такого профиля в прогнозировании потенциала развития эмбрионов in vitro в программах ВРТ.
Материал и методы исследования
Данное исследование проводилось в период с 2014 по 2016 гг. на базе кафедры акушерства, гинекологии, перинатологии и репродуктологии ИПО Первого МГМУ им. И.М. Сеченова в условиях 1-го гинекологического отделения ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России. Исследование было одобрено комиссией по этике биомедицинских исследований при ГБОУ ВПО Первый МГМУ имени И.М. Сеченова Минздрава России.
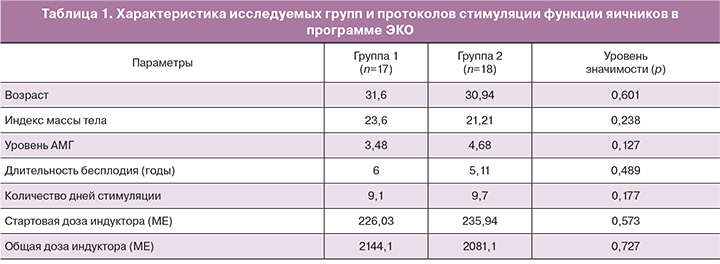
В исследование были включены 35 пациентов с нормальным ответом яичников. Критериями включения были: возраст пациенток от 22 до 38 лет, регулярный менструальный цикл (25–34 дней), индекс массы тела 18–29 кг/м2, уровень ФСГ≤10 МЕ/л, менее 3 неудачных предыдущих попыток ЭКО. Всем пациентам проводили стимуляцию яичников с рекомбинантным фолликулостимулирующим гормоном (ФСГ) (гонал-ф, Serono Merck, Швейцария; или пурегон, Organon, Нидерланды) и/или очищенным человеческим менопаузальным гонадотропином (менопур, Ferring, Швейцария) со 2-го дня менструального цикла. Стартовые дозы индуктора варьировали от 118,5 МЕ до 300 МЕ в день. Первый ультразвуковой контроль выполняли после 5 дней стимуляции и корректировали дозу индуктора в зависимости от реакции яичников. При достижении лидирующих фолликулов размеров 14 мм начинали ежедневное использование ант-ГнРГ 0,25 мг/сутки (цетротид, Serono Merck, Швейцария) для предупреждения преждевременного пика ЛГ и продолжали до дня введения триггера овуляции. При наличии в яичниках трех или более фолликулов диаметром ≥17 мм вводили триггер овуляции в дозе 10 000 МЕ чХГ (прегнил, Organon, Нидерланды) в группе 1 (n=17) или 0,2 мг трипторелина (диферелин, Ипсен Фарма) в группе 2 (n=18). Примерно через 35–36 ч после введения триггера производили трансвагинальную пункцию яичников. Перенос эмбрионов производили на 3-и или 5-е сутки культивирования эмбрионов после пункции фолликулов. Всем пациентам, которым был произведен перенос эмбрионов, назначали поддержку лютеиновой фазы: пациентам группы 1 – в виде микронизированного прогестерона – 600 мг в сутки (утрожестан, Besins, Iscovesco, С.т.С., Петах-Тиква, Израиль) начиная со следующего дня после пункции фолликулов, пациентам группы 2 – препарат чХГ в дозе 1500 МЕ в день пункции фолликулов, а также препарат микронизированного прогестерона 600 мг в сутки (утрожестан) и 6 мг эстрадиола валерата (прогинова; Schering) ежедневно.
Изолирование КОК и получение клеток кумулюса
Все манипуляции проводились в стерильных условиях на термостатируемых поверхностях (37°С). КОК были получены во время трансвагинальной пункции яичников при помощи 19-дюймовой иглы. Аспирированные КОК поэтапно подвергались промывке с буферным раствором «Flushing medium» для очистки комплекса от клеток гранулезы и клеток крови. Далее, все КОК до отделения кумулюса инкубировались в среде для оплодотворения IVF medium (Origio, Denmark) в течение 2–3 часов. Перед проведением интрацитоплазматической инъекции сперматозоида в ооцит (ИКСИ) под контролем бинокулярного микроскопа ооциты были очищены (денудированы) от клеток кумулюса путем обработки в растворе, содержащем 60 МЕ/мл гиалуронидазы (Origio, Denmark) с максимальной экспозицией не более 30 секунд. Затем клетки промывали в среде «Flushing medium» (Origio, Denmark). Для разделения клеток кумулюса от клеток короны производилась первичная обработка КОК в лунке с раствором гиалуронидазы, затем ооцит-корона комплекс переносили в другую лунку без гиалуронидазы и в ней производили окончательную механическую очистку ооцита от окружающих его клеток лучистого венца (corona radiata – клетки короны), используя денудационные пипетки диаметром 140 мкм (Origio, Denmark). После денудации и промывки ооциты помещали в чашки с индивидуальными микрокаплями культуральной среды IVF medium (Origio, Denmark) в которых в дальнейшем проводили их инжектирование. Кумулюсные клетки собирали в стерильные пробирки эппендорф объемом 1,5 мл, содержащие раствор гуанидинтиоцианата для избежания деградации РНК (лизирующий раствор, наборы «Проба НК», производства ООО «НПФ ДНК-Технология», Россия). Клетки кумулюса и клетки короны собирали раздельно из разных лунок чашек для денудации. Объем промывочной среды с клетками кумулюса или клетками короны составлял от 350 до 400 мкл. Образцы клеток сразу помещали в морозильную камеру и хранили при температуре минус 80°С в течение всего времени до момента выделения РНК. Всего было собрано 179 образцов кумулюсных клеток.
Выделение РНК и проведение полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР)
Для выделения нуклеиновых кислот использовали наборы «Проба НК». Метод основан на лизисе клеток в 4 М растворе гуанидинтиоцианата и осаждении нуклеиновых кислот изопропанолом в присутствии соосадителя с последующими отмывками этанолом и ацетоном.
Методом количественной ОТ-ПЦР в режиме реального времени в кумулюсных клетках исследован уровень экспрессии мРНК 13 генов: гиалуронан-синтетазы 2 (HAS2), кальмодулина (CALM2), простагландин синтетазы 2 (PTGS2), инозитол-трифосфат 3 киназы А (ITPKA), гремлина (GREM1), транзиторного рецептора потенциал-зависимых катионных каналов седьмой в подсемействе М (TRPM7), молекулы клеточной адгезии активированных лейкоцитов (ALCAM или CD166), синдекана 4 (SDC4), версикана (VCAN), супрессора цитокиновой сигнализации, содержащего SPRY-домен (SPSB2), p53-индуцируемого опухолевого протеина 3 (TP53I3), тромбоцитарной изоформы фосфофруктокиназы (PFKP) и прогестеронового рецептора (PGR) (все реактивы производства ООО «НПФ ДНК-Технология», Россия).
Реакцию обратной транскрипции (синтез кДНК из полученной РНК) проводили в объеме 40 мкл. В качестве праймеров для обратной транскрипции использовали разработанные специфические олигонуклеотиды и обратную транскриптазу M-MuLV. Реакцию проводили при температуре 40°С в течение 30 минут, с последующей инактивацией обратной транскриптазы при 95°С в течение 5 минут. Амплификацию осуществляли в режиме реального времени с измерением уровня флуоресценции по каналу FAM на каждом цикле при температуре отжига праймеров 64°С. В работе использовали высокоспецифичные в отношении мРНК олигонуклеотиды, не отжигающиеся на матрице геномной ДНК, что позволило исключить этап отработки образцов ДНК-азой. Реакцию ставили в двух повторах для каждой точки. Для постановки ПЦР в реальном времени использовали Taq-полимеразу с антителами (Taq-AT), позволяющую осуществить реализацию «горячего старта».
Нормировка уровня экспрессии исследуемых генов осуществлялась методом сравнения пороговых циклов (метод ΔCq) относительно трех референсных генов B2M, TBP, GUSB.
Анализ экспрессии по каждому гену проводили с учетом образованием бластоцист из ооцитов, от которых получены кумулюсные клетки. Группу экспрессии A составляли образцы клеток кумулюса, из ооцитов которых были получены бластоцисты, группу B – из которых бластоцист получено не было.
Статистическую обработку результатов исследования уровней экспрессии генов проводили с использованием методов непараметрического анализа. Исследованные количественные показатели представлены в виде Ме (1Q-3Q), где Ме – медиана, 1Q – нижний квартиль, 3Q – верхний квартиль. Для сопоставления двух групп по количественным признакам использован U-критерий Манна–Уитни. Различие между группами полагали статистически значимым при p<0,05. Обработку полученных результатов проводили в программном пакете StatSoft Statistica 10.0 и IBM SPSS Statistics, версия 22.
Результаты исследования
Для анализа были отобраны 179 КОК. Образцы клеток были разделены соответственно на 2 группы в зависимости от использованного триггера овуляции.
Группу 1 составили 86 КОК, полученных от 17 пациенток, при использовании в качестве триггера овуляции чХГ. Группу 2 составили 93 КОК, полученных от 18 пациенток, при использовании в качестве триггера овуляции а-ГнРГ.
Параметры сравнения исследуемых групп представлены в табл. 1.
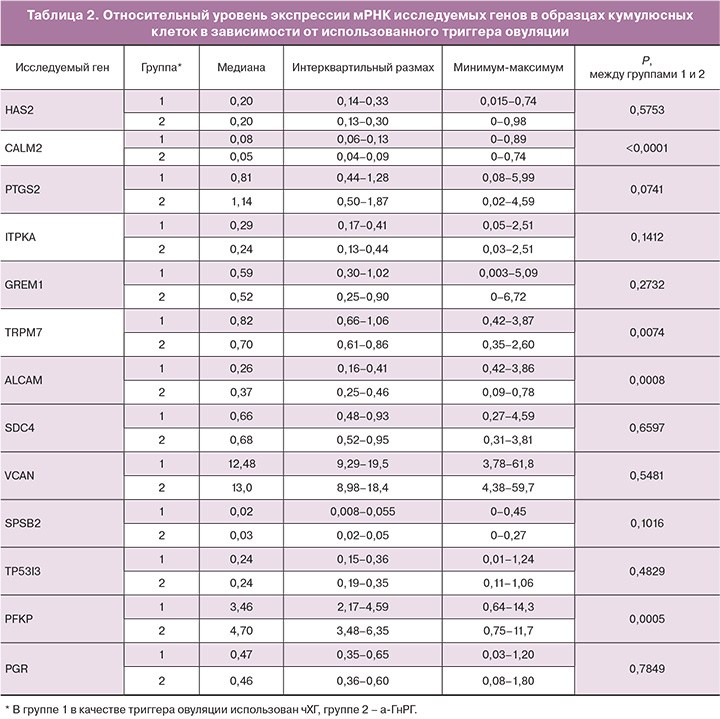
При анализе результатов экспрессии мРНК исследуемых генов в кумулюсных клетках в двух группах получены достоверные различия в уровне экспрессии 4 из 13 генов: CALM2, ALCAM, PFKP и TRPM7 (табл. 2). В группе с использованием а-ГнРГ в качестве триггера было выявлено повышение уровня экспрессии мРНК генов ALCAM и PFKP в 1,4 раза. В то же время уровень экспрессии мРНК генов CALM2 и TRPM7 был снижен в 1,6 и 1,2 раза соответственно по сравнению с образцами кумулюсных клеток, полученных при использовании чХГ в качестве триггера овуляции.
Различия в экспрессии генов кумулусными клетками в группах триггеров а-ГнРГ и чХГ были выявлены среди генов CALM2 (0,08 против 0,05; P<0,0001), TRPM7 (0,82 против 0,70; P=0,007), ALCAM (0,26 против 0,37; P=0,0008) и PFKP (3,46 против 4,70; P=0,0005) (табл. 2).
Относительно генов HAS2 (0,20 против 0,20; P=0,575), PTGS2 (0,81 против 1,14; P=0,0741), ITPKA (0,29 против 0,24; P=0,141), GREM1 (0,59 против 0,52; P=0,273), SDC4 (0,66 против 0,68; P=0,659), VCAN(12,48 против 13,0; P=0,548), SPSB2 (0,02 против 0,03; P=0,102), TP5313 (0,24 против 0,24; P=0,483) и PGR (0,47 против 0,46; P=785) значимых различий выявлено не было.
Следует отметить, что экспрессия мРНК генов не имела корреляционной связи с уровнем эстрадиола в крови пациенток в день назначения триггера овуляции (р>0,05).
При стратификации образцов в зависимости от формирования бластоцисты получены достоверные различия только для гена TP53I3. Экспрессия мРНК гена TP53I3 была выше в 1,3 раза в клетках кумулюса, из ооцитов которых в дальнейшем были получены бластоцисты по сравнению с кумулюсом, окружающим ооциты из которых бластоциста не развилась (0,3 vs 0,23; P=0,0304).
Обсуждение
Применение препаратов а-ГнРГ в качестве триггера овуляции в программах ВРТ используется для профилактики развития синдрома гиперстимуляции яичников (СГЯ) [12]. Предупреждая развитие СГЯ, препараты а-ГнРГ не оказывают негативного влияния на эмбриологические показатели, гормональный статус пациенток и клинические исходы ВРТ [13, 14].
Тем не менее, в настоящее время изучается влияние использования а-ГнРГ для финального созревания ооцитов на развитие фолликулов и КОК. В 2016 году A. Gurbuz и соавт. продемонстрировали различия в морфокинетических параметрах ранних эмбрионов человека при использовании а-ГнРГ и чХГ в качестве триггеров овуляции [15]. Данная работа подчеркивает необходимость проведения дальнейших исследований биологии фолликулогенеза и оогенеза при применении различных протоколов стимуляции суперовуляции. Поэтому цель нашей работы состояла в исследовании транскрипционного профиля генов, задействованных в регуляции клеточного цикла и пролиферации, ионного гомеостаза, клеточной адгезии и миграции, энергетическом обмене, тканевой дифференцировки, апоптозе и клеточной сигнализации в образцах кумулюса пациенток при использовании различных тригеров овуляции: а-ГнРГ и чХГ. Выбор этих генов был обоснован литературными данными об ассоциации уровня их экспрессии в кумулюсных клетках с качеством ооцитов, потенциалом эмбрионов и исходом программ ВРТ [16–19].
В результате проведенного исследования установлено, что экспрессия 4 генов была изменена при использовании в качестве триггера овуляции а-ГнРГ: CALM2, TRPM7, ALCAM и PFKP, причем экспрессия двух последних генов была повышена при использовании а-ГнРГ в качестве триггера овуляции.
Продукт гена CALM2 является Ca2+-связывающим белком, который задействован в сигнальных путях регуляции клеточного цикла и пролиферации. Были выявлены различия в экспрессии мРНК гена CALM2 (в группе 1 Me=0,08, в группе 2 Ме=0,05; р<0,0001).
Продукт гена TRPM7 является серин/треонин- протеинкиназой. Активность данной протеинкиназы имеет важное значение для функционирования ионных каналов, которые служат увеличению внутриклеточного содержания кальция и магния, тем самым участвуют в регуляции ионного гомеостаза. Были выявлены различия в экспрессии мРНК гена TRPM7 (в группе 1 Me=0,82, в группе 2 Me=0,70; p=0,007).
Продукт гена ALCAM, также известного как CD 166 (кластер дифференцировки166), представляет собой мембранный белок, участвующий во взаимодействии клеток между собой и внеклеточным матриксом и является геном молекулы клеточной адгезии активированных лейкоцитов. Было показано, что данный ген вовлечен в процесс начала имплантации эмбрионов человека [20]. Экспрессия мРНК гена ALCAM была ниже в группе 1 (0,26 против 0,37; р=0,0008)
Ген PFKP кодирует синтез одной из изоформ (тромбоцитарная) фосфофруктокиназы (ФФК). Высокая экспрессия данного гена обнаружена также в фибробластах. ФФК катализирует необратимую конверсию фруктозо-6-фосфата в фруктозо-1,6-бисфосфат, являясь основным регуляторным ферментом гликолиза. Экспрессия мРНК гена PFKP была ниже в группе 1 (3,46 против 4,70; р=0,0005).
Согласно данным литературы хорошее качество эмбрионов ассоциировано с высокими уровнями экспрессии мРНК генов CALM2, TRPM7, ALCAM и PFKP [19]. Учитывая отсутствие различий между группами по клиническим и эмбриологическим показателям, таким как качество и степень зрелости ооцитов, частота оплодотворения, качество эмбрионов на 3-и и 5-е сутки, частота имплантации эмбрионов, наступления беременности и живорождения, выявленные различия в уровне экспрессии генов в кумулюсных клетках в двух группах не являются негативными и представляют собой, по-видимому, вариант нормы в данных физиологических условиях. По мнению ряда авторов, изменения менее чем в 1,5 раза могут не оказывать значительного влияния на функциональное состояние КОК и, в конечном счете, существенного влияния на качество получаемых ооцитов [21–23].
Единственным геном, высокий уровень экспрессии которого был ассоциирован с формированием бласоцисты, был TP53I3. Данный ген классифицирован как ген, кодирующий продукцию белка, схожего по функциям с оксидоредуктазами; участвует в регуляции углеводного обмена и апоптозе клеток. В исследовании E. Fragouli и соавт. было установлено, что экспрессия мРНК гена TP53I3 ниже в кумулюсных клетках, окружающих ооциты с анеуплоидным набором хромосом [17]. Выявленная нами ассоциация высокого уровня экспрессии данного гена с благоприятным прогнозом формирования бластоцист, по-видимому, может быть обусловлена блокировкой деления бластомеров при некоторых видах анеуплоидий и несбалансированных геномных перестройках.
Таким образом, наши исследования показали, что экспрессия некоторых генов в группах с различными триггерами овуляции может отличатся. Однако эти различия были менее чем в 2 раза и, возможно, не оказывали существенного влияния на качество полученных ооцитов и эмбрионов.
Выводы
- Значимых различий в экспрессии генов, отвечающих за синтез гиалуроновой кислоты (HAS2), синтез простаноидов (PTGS2), клеточную сигнализацию (ITPKA,SDC4, SPSB2), участвующих в процессах пролиферации и апоптоза (VSCAN, TP53I3), в группах с использованием в качестве триггеров овуляции а-ГнРГ и чХГ не выявлено.
- Использование а-ГнРГ в протоколах стимуляции суперовуляции приводит к повышению экспрессии в клетках кумулюса мРНК генов ALCAM, PFKP в 1,4 раза и понижению CALM2 и TRPM7 соответственно в 1,6 и 1,2 раза.
- Установлена ассоциация высокого уровня экспрессии мРНК гена TP53I3 с благоприятным прогнозом формирования бластоцисты.
- Полученные данные свидетельствует в пользу того, что при проведении контролируемой стимуляции яичников в циклах ЭКО назначение различных типов триггера овуляции не оказывает влияние на качество получаемых ооцитов и в дальнейшем эмбрионов, происходящих из них.



