Широкое использование усовершенствованной технологии криопереноса стало прорывом во вспомогательных репродуктивных технологиях (ВРТ) за последнее десятилетие. В цикле криопереноса сохранена рецептивность эндометрия, исключен синдром гиперстимуляции яичников, возможен плановый перенос одного эмбриона после преимплантационного генетического тестирования в период «окна имплантации», что способствует сохранению фертильности и увеличению числа живорождений [1, 2]. Перинатальные исходы переноса криоконсервированных эмбрионов имеют преимущества в виде снижения частоты малого веса плода для гестационного возраста, преждевременных родов, предлежания плаценты, отслойки плаценты и перинатальной смертности по сравнению с переносом свежих эмбрионов [3–5]. Однако криоперенос сопровождается повышенным риском макросомии и гипертензивных нарушений беременности [6, 7]. Являются ли эти различия следствием использования препаратов заместительной гормональной терапии в протоколах подготовки эндометрия к переносу размороженных эмбрионов или отсутствия желтого тела, остается неизвестным [8, 9]. Отдельным большим вопросом является выбор гестагена для адекватной секреторной трансформации и последующей посттрансферной поддержки [10, 11].
В настоящее время изучается роль гестагенов в снижении поздних осложнений беременности, таких как преэклампсия. Ранее опубликованные данные ретроспективного исследования показывают снижение частоты преэклампсии после приема дидрогестерона для поддержки лютеиновой фазы в программах ВРТ [12, 13].
В литературных источниках имеются сведения об исследованиях, в которых сравнивали эффективность применения дидрогестерона и микронизированного вагинального прогестерона в циклах экстракорпорального оплодотворения [6, 14–16]. Однако доказательной базы в пользу преимуществ применения тех или иных гестагенов для поддержки лютеиновой фазы после переноса размороженных эмбрионов в настоящее время нет.
Необходимы дальнейшие проспективные рандомизированные исследования, чтобы определить оптимальные программы подготовки эндометрия с последующей посттрансферной поддержкой для улучшения исходов ВРТ.
Цель исследования: оценка эффективности программ переноса размороженных эмбрионов и исходов беременностей в зависимости от типа гестагена, используемого для секреторной трансформации эндометрия и посттрансферной поддержки.
Материалы и методы
Была проведена ретроспективная оценка исходов программ переноса размороженных собственных эмбрионов в цикле заместительной гормональной терапии в период с февраля 2021 г. по май 2022 г. на базе отделения ВРТ ФГБУ НИИ ОММ МЗ РФ. В исследование были включены 334 женщины с диагнозом женского бесплодия, которым с целью подготовки эндометрия к переносу размороженных эмбрионов были назначены гормональные препараты: для достижения пролиферативных изменений эндометрия – эстрогены (эстрадиола валерат в дозировке 6 мг/сут со 2–4-го дня менструального цикла), а для формирования секреторной трансформации и децидуализации эндометрия – гестагены (при достижении толщины эндометрия не менее 7 мм и до 12 недель беременности). Все пациентки разделены на 2 группы: в 1-ю группу вошли 224 пациентки, которые принимали для адекватной секреторной трансформации дидрогестерон (30 мг/сут внутрь), во 2-ю группу – 110 пациенток, которым поддерживающую терапию проводили микронизированным вагинальным прогестероном (600 мг/сут). Подготовка эндометрия не включала методы хирургической, инструментальной (кавитационное орошение) либо биологической (внутриматочное введение плазмы, обогащенной тромбоцитами) подготовки полости матки и эндометрия.
Основными показателями исхода были: наличие клинической беременности, живорождение, акушерские осложнения (частота невынашивания беременности, преждевременных родов).
Статистический анализ
Cтатистическую обработку результатов исследований проводили с использованием пакетов прикладных программ Microsoft Excel (2010), Stat Soft Statistica 6.0 (Stat Soft, США), SPSS Statistics версия 22.0 (IBM Microsoft, США). Оценку соответствия выборки нормальному распределению проводили с использованием критерия Колмогорова–Смирнова. В случае подчинения признака закону нормального распределения данные представляли в виде средней величины (М) и стандартного отклонения (SD). Качественные признаки представляли в виде абсолютного значения и относительной величины в процентах, оценку статистической значимости осуществляли с использованием критерия хи-квадрат (χ2), если абсолютные частоты были меньше 10, то применяли поправку Йейтса. Нулевая гипотеза отклонялась при р<0,05. Для оценки итоговых результатов каждого из изучаемых клинических исходов был рассчитан размер эффекта с помощью показателя отношения шансов (OШ) с 95% доверительным интервалом (ДИ).
Результаты и обсуждение
В 1-й группе средний возраст пациенток составил 34,3 (0,63) года, во 2-й группе – 33,8 (0,75) года, демографические показатели были сопоставимы в исследуемых группах (р=0,063).
При оценке характера сопутствующей соматической патологии выявлено, что в обеих группах ведущее место занимают болезни эндокринной системы, расстройства питания и нарушения обмена веществ: 54/224 – в 1-й группе, что составляет 24,10%, и 14/110 (12,72%) – во 2-й группе, при этом имеется статистически значимое различие (р=0,016). Болезни желудочно-кишечного тракта в 1-й группе встречались у 16/224 пациенток (7,14%), во 2-й группе – у 10/110 (9,09%) (p>0,05). Кроме того, в группе пациенток, применявших микронизированный вагинальный прогестерон, 4-е место в структуре соматической патологии занимало ожирение – 8/110 (7,27%) (табл. 1).
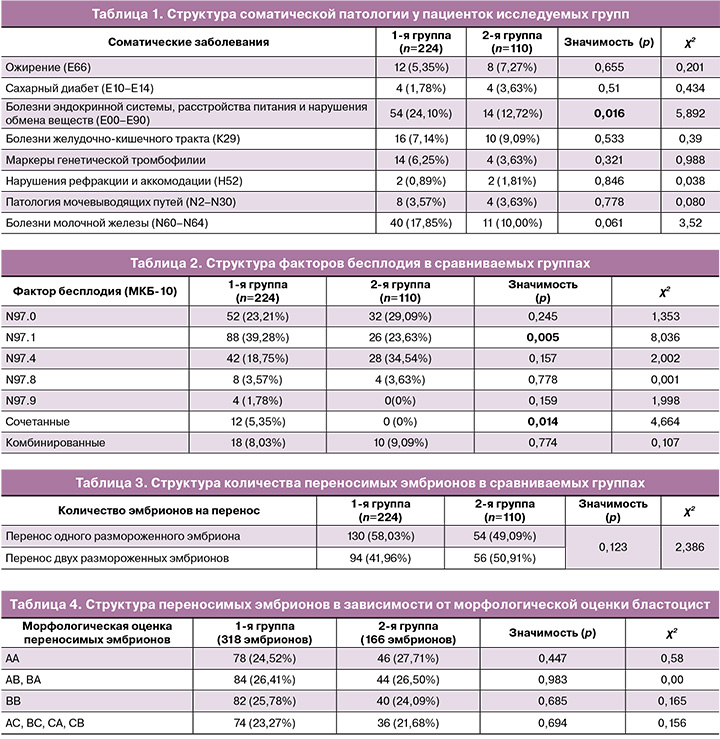
В структуре гинекологических заболеваний у пациенток обеих групп наиболее часто встречались следующие патологии: послеоперационный рубец на матке, требующий предоставления медицинской помощи матери – в 1-й группе 42/224 (18,75%) против 18/110 (16,36%) во 2-й группе, р=0,594; синдром поликистозных яичников – в 1-й группе 26/224 (11,60%) против 10/110 (9,09%) во 2-й группе, р=0,486; лейомиома матки – в 1-й группе 20/224 (8,92%) против 4/110 (3,63%) во 2-й группе, р=0,079. В структуре гинекологической патологии в обеих группах статистически значимых различий не было выявлено (p>0,05).
В ходе работы проанализирована структура бесплодия в каждой группе пациенток (табл. 2).
Наиболее частым фактором бесплодия у пациенток 1-й группы с применением дидрогестерона для поддержки лютеиновой фазы являлось женское бесплодие трубного происхождения (N97.1) – 88/224 (39,28%). Следующими по частоте являлись женское бесплодие, связанное с отсутствием овуляции (N97.0) – 52/224 (23,21%) и с мужским фактором (N97.4) – 42/224 (18,75%). В группе пациенток, применявших микронизированный вагинальный прогестерон, наиболее частыми факторами являлись: женское бесплодие, связанное с мужским фактором (N97.4) – 28/110 (34,54%) и с отсутствием овуляции (N97.0) – 32/110 (29,09%). У пациенток 1-й группы статистически значимо чаще встречалось женское бесплодие, связанное с трубным фактором, чем у пациенток 2-й группы (p=0,005), и сочетанные формы бесплодия (p=0,014). Принимая во внимание статистическую значимость по различиям в структуре бесплодия, был проанализирован эмбриологический этап программ переноса размороженных эмбрионов в данных группах. Статистически значимых различий по количеству переносимых эмбрионов у пациенток 1-й и 2-й групп не было выявлено. Перенос одного эмбриона в группе с применением дидрогестерона осуществляли в 130/224 (58,03%) случаях, а в группе микронизированного вагинального прогестерона – в 54/110 (49,09%) случаях (р=0,123); в остальных случаях проводили перенос двух размороженных эмбрионов в полость матки (табл. 3).
Все переносимые эмбрионы соответствовали стадии бластоцисты, криоконсервация их происходила на 5–6-е сутки развития эмбрионов. Преимплантационная диагностика эмбрионов не проводилась. После разморозки эмбрионы были оценены по классификации Гарднера. Нами была проанализирована структура переносов эмбрионов по качеству бластоцист (табл. 4). Частота переносимых эмбрионов отличного и хорошего качества (АА, АВ, ВА, ВВ) в группе с применением препаратов дидрогестерона составила 244/318 (76,73%), во 2-й группе – 130/166 (78,31%) (р>0,05). Остальные эмбрионы были удовлетворительного качества: в 1-й группе – 74/318 (23,27%) случая, во 2-й – 36/166 (21,68%) (р=0,694). Статистически значимых различий по качеству переносимых эмбрионов не выявлено во всех случаях.
Были оценены исходы программ ВРТ по наступлению клинических беременностей в исследуемых группах (табл. 5).
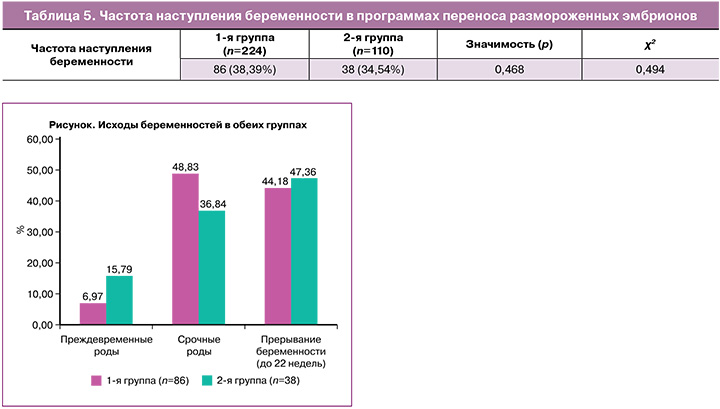
Данные, полученные в ходе анализа, показали сопоставимую эффективность гестагенов по частоте наступления клинической беременности в зависимости от вида применяемого гестагена (дидрогестерон или микронизированный вагинальный прогестерон) (табл. 3). В 1-й группе частота наступления беременности составила 86/224 (38,39%), во 2-й группе – 38/110 (34,54%) (р=0,468). При этом многоплодная беременность была зафиксирована в 1-й группе в 12/86 (13,95 %) случаях, а во 2-й – в 10/38 (26,31%) случаях (р=0,097).
Данные группы проанализированы по течению и осложнениям беременности (рисунок): прерывание беременности до 22 недель, преждевременные роды, срочные роды. В группе с дидрогестероном частота срочных родов была выше и составила 42/86 (48,83%), а в группе с микронизированным вагинальным прогестероном – 14/38 (36,84%) (р=0,216; ОШ=0,611; 95% ДИ 0,28–1,34). Частота преждевременных родов в группе с дидрогестероном – 6/86 (6,97%), в группе с вагинальным прогестероном – 6/38 (15,79%), однако статистической разницы не было выявлено (р=0,126; ОШ=0,4; 95% ДИ 0,12–1,33). Частота прерывания беременности до 22 недель в 1-й группе составила 38/86 (44,18%), во 2-й – 18/38 (47,36%), также статистически значимых различий не было выявлено (р=0,743; ОШ=0,844; 95% ДИ 0,393–1,813). При анализе исходов беременностей было выявлено, что частота потерь беременностей на ранних сроках достигает 47%. Полученные данные о структуре исходов беременностей после программ переноса размороженных эмбрионов соответствуют литературным данным о том, что дидрогестерон приводит к значительному снижению продукции провоспалительных цитокинов Th1 – интерферона-γ и фактора некроза опухоли-α, за счет чего происходит снижение рисков невынашивания беременности и частоты преждевременных родов [16, 17].
Заключение
Наше исследование было направлено на оценку эффективности программ ВРТ и перинатальных исходов после переноса размороженных эмбрионов в зависимости от гестагена для формирования секреторной трансформации, децидуализации эндометрия и посттрансферной поддержки.
Данные, полученные в ходе анализа, показали сопоставимую эффективность гестагенов по частоте наступления клинической беременности и перинатальных исходов в цикле подготовки к переносу размороженных эмбрионов; при этом статистически значимых различий не было получено. В группе с дидрогестероном чаще встречались срочные роды, однако статистической значимости различия в отношении частоты живорождения и акушерских осложнений не достигли.
Проведенное исследование демонстрирует возможность применения как микронизированного вагинального прогестерона, так и дидрогестерона в циклах заместительной гормональной терапии для подготовки эндометрия к переносу размороженных эмбрионов.
Необходимы дальнейшие многоцентровые исследования на большой выборке для формирования выводов по возможности персонализации применения гестагенов в программах ВРТ с переносом размороженного эмбриона, а также по оценке осложнений беременности и перинатальных исходов.



