Актуальность
Трубно-перитонеальное бесплодие у женщин, бесспорно занимая ведущее место в структуре бесплодного брака, является и самой трудной патологией в плане восстановления репродуктивной функции. Частота трубно-перитонеальных форм бесплодия колеблется от 35 до 60% и обнаруживается в среднем у половины всех пациенток, обращающихся по поводу лечения бесплодия. При этом считается, что преобладает трубный фактор (35–40%), а перитонеальная форма бесплодия встречается в 9,2–34% наблюдений [1]. Причиной возникновения трубно-перитонеальных форм бесплодия являются воспалительные процессы внутренних половых органов, оперативные вмешательства на органах брюшной полости и малого таза, воспалительные и травматические послеродовые осложнения, наружный эндометриоз, генитальные инфекции [2, 3]. Спаечный процесс в малом тазу может стать причиной многогранных нарушений женского организма и пусковым механизмом формирования множества дополнительных факторов женского бесплодия: частичного или полного нарушения проходимости маточных труб, приобретенной патологии матки, шейки матки и яичников, эндометриоза, нейро-эндокринного дисбаланса в виде хронической ановуляции и др.
Хирургические вмешательства на органах малого таза и брюшной полости, произведенные методом лапаротомии, составляют группу высокого риска по формированию трубно-перитонеального бесплодия [2]. По данным ВОЗ, одно- или двухсторонняя окклюзия маточных труб может сформироваться у 15% пациенток после аппендэктомии, у 60–80% пациенток после оперативных вмешательств на яичниках, консервативной миомэктомии, по поводу трубной беременности, особенно выполненных по экстренным показаниям [3]. Повреждение брюшины и последующие воспалительные изменения приводят к отложению фибрина и фибринолизу. В случаях затягивания воспалительно-дистрофического процесса брюшины с блокированием процессов фибринолиза и протеолиза фибринозные образования в месте операционной травмы вследствие повышенной локальной продукции коллагена превращаются в соединительно-тканные сращения (рис. 1) [1].
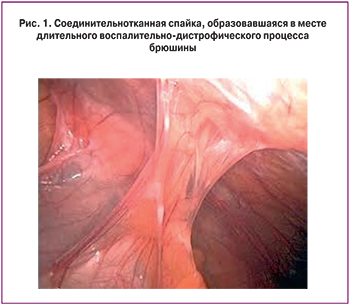 Соединительная ткань составляет более 90% массы тела, является составной частью всех органов и тканей, формируя вместе с кровью внутреннюю среду, через которую все структурные элементы получают питательные вещества и элиминируют продукты метаболизма. В отличие от большинства дифференцированных тканей, соединительная ткань сохраняет способность к регенерации и в зрелом возрасте. Вследствие этого она заполняет дефекты не только соединительнотканных, но и паренхиматозных органов (заместительная регенерация). В клинике до настоящего времени отсутствуют достаточно эффективные средства воздействия на гранулематозно-фиброзные, рубцовые, спаечные, анкилозирующие и подобные процессы. Ведутся поиски эффективных средств борьбы с гиперплазией (патологическим ростом) соединительной ткани. Наиболее эффективно применение глюкокортикостероидов и иммуносупрессоров, но оно ограничено из-за широкого спектра побочных эффектов (угнетение костномозгового кроветворения, снижение иммунной защиты и др.) [4].
Соединительная ткань составляет более 90% массы тела, является составной частью всех органов и тканей, формируя вместе с кровью внутреннюю среду, через которую все структурные элементы получают питательные вещества и элиминируют продукты метаболизма. В отличие от большинства дифференцированных тканей, соединительная ткань сохраняет способность к регенерации и в зрелом возрасте. Вследствие этого она заполняет дефекты не только соединительнотканных, но и паренхиматозных органов (заместительная регенерация). В клинике до настоящего времени отсутствуют достаточно эффективные средства воздействия на гранулематозно-фиброзные, рубцовые, спаечные, анкилозирующие и подобные процессы. Ведутся поиски эффективных средств борьбы с гиперплазией (патологическим ростом) соединительной ткани. Наиболее эффективно применение глюкокортикостероидов и иммуносупрессоров, но оно ограничено из-за широкого спектра побочных эффектов (угнетение костномозгового кроветворения, снижение иммунной защиты и др.) [4].
В связи с вовлечением в процессы гиперплазии соединительной ткани усиления синтеза компонентов матрикса (гликозаминогликанов) наиболее универсальным средством воздействия на эту патологию является фермент гиалуронидаза. Под влиянием гиалуронидазы в результате деполимеризации матрикса соединительной ткани гликозаминогликаны теряют одно из своих основных свойств – вязкость, и как следствие происходит увеличение проницаемости тканевых барьеров, повышение эластичности рубцовой ткани. Препараты на основе фермента гиалуронидазы (лидаза, alidasa, hyalasa, hyalidasa, hyasa, hyason, widasa и др.) применяются в гинекологической практике более 40 лет, но несмотря на патогенетическую значимость назначения, они малоэффективны, поскольку фермент быстро инактивируется многочисленными ингибиторами сыворотки крови, а их на сегодняшний день известно более 80 [5].
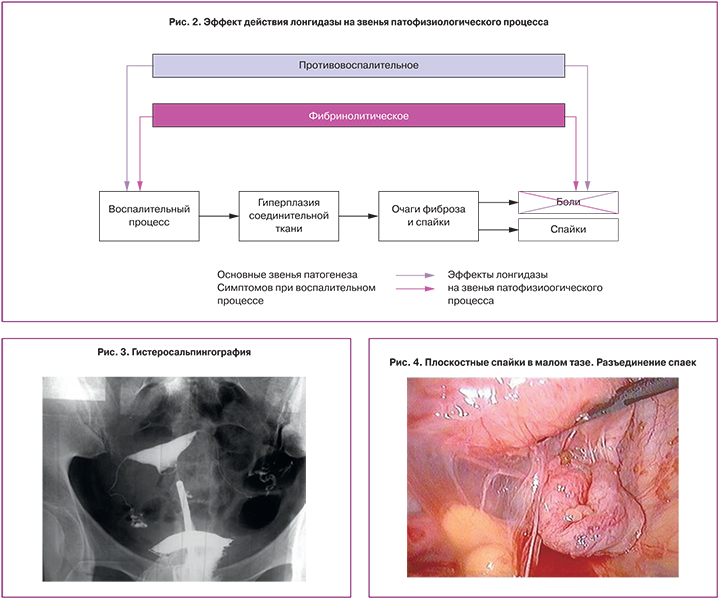
С 2005 года в клинической практике появился новый ферментный препарат лонгидаза, который представляет собой фермент гиалуронидаза, конъюгированный с высокомолекулярным носителем (активированным производным N-оксида полиэтиленпиперазина). Конъюгация повышает устойчивость фермента к действию температуры и ингибиторов, увеличивает его активность и приводит к пролонгированию действия. Лонгидаза благодаря носителю способна связывать освобождающиеся при гидролизе гликозаминогликанов ионы железа – активаторы свободно-радикальных реакций, ингибиторы гиалуронидазы и стимуляторы синтеза коллагена, и тем самым способна подавлять обратную реакцию, направленную на синтез компонентов соединительной ткани. Политропные свойства препарата лонгидаза (ферментативные, антиоксидантные, противовоспалительные) реализуются в выраженном противофиброзном действии (рис. 2) [6].
Положительные результаты клинических исследований, возможности применения лонгидазы при внутримышечном, ректальном и вагинальном введении в комплексной терапии патологических изменений эндометрия, при хронических воспалительных заболеваниях органов малого таза, в том числе и при лечении спаечного процесса в малом тазу, опубликованы многими исследователями (Смирнова Л.Е, 2006; Петрович Е.А., Колесов А.А., Манухин И.Б, 2006; Назаренко Т.А, Дубницкая Л.В., 2008; Ковалева Л.А., 2010 и др.).
Учитывая вышеперечисленное, хотелось бы на конкретном клиническом наблюдении оценить эффективность применения препарата лонгидаза в комплексной терапии у больной с трубно-перитонеальным бесплодием.
Описание клинического наблюдения
В клинику для оперативного лечения поступила пациентка В., 28 лет, с диагнозом: вторичное бесплодие. В амбулаторных условиях было проведено полное клинико-лабораторное обследование. В клинических и биохимических анализах крови и мочи патологии выявлено не было. По данным УЗИ были выявлены косвенные признаки спаечного процесса.
Из данных анамнеза выявлено, что у пациентки В. отмечалась высокая частота инфекционных заболеваний в детском и пубертатном возрасте, а также нарушение специфических функций женского организма (менструальной, репродуктивной), наличие сочетанной гинекологической патологии.
Обращает на себя внимание репродуктивный анамнез. Установлено, что у пациентки была 1 беременность, которая закончилась артифициальным абортом на сроке 7 недель, который осложнился острым эндомиометритом. В течение последующих 6 лет пациентка перенесла несколько эпизодов воспалительных заболеваний внутренних половых органов, по поводу чего лечилась амбулаторно. Последний год у больной появились жалобы на периодические тянущие боли в нижних отделах живота, болезненные менструации. На этапе догоспитального обследования пациентке была выполнена гистеросальпингография (рис. 3), при которой выявлена окклюзия обеих маточных труб.
У пациентки В. нами был произведен сальпинголизис обеих маточных труб с последующей хромосальпингоскопией, при которой обе маточные трубы стали проходимы (рис. 4).
В послеоперационном периоде пациентка получала антибактериальную терапию в сочетании с приемом лонгидазы в виде суппозиториев по 3000 МЕ интравагинально по 1 суппозиторию 1 раз в 3 дня № 10. Через 3 месяца в связи с задержкой менструации на 2 недели пациентке В. было выполнено УЗИ органов малого таза, при котором в полости матки было выявлено плодное яйцо.
Обсуждение
На примере данного клинического наблюдения мы можем гипотетически предположить, как сложилась бы судьба данной больной, если бы ей ранее была назначена терапия с применением лонгидазы.
Допустим, при впервые возникшем остром воспалительном процессе внутренних половых органов ей было бы включено в комплексную терапию использование лонгидазы в виде суппозиториев совместно с антибактериальной терапией. Учитывая противовоспалительные свойства лонгидазы, способность инактивировать активные формы кислорода и свободные радикалы, снижать избыточный синтез провоспалительных цитокинов и хелатирование стимуляторов радикальных реакций в очаге воспаления), это послужило бы профилактике формирования спаек, так как они начинают образовываться уже в острую фазу воспаления – на 3-й день от начала заболевания.
Важным свойством препарата становится то, что лонгидаза не повреждает нормальную соединительную ткань, а вызывает деструкцию измененной по составу и структуре патологической соединительной ткани спаек. Лонгидаза имеет высокий профиль безопасности, так как не обладает эмбриотоксической активностью, не оказывает мутагенного и канцерогенного действия.
Следует также отметить, что спектр действия лонгидазы cущественно шире других ферментных препаратов, так она не только оказывает протеолитическое действие на соединительную ткань, но и ингибирует причину ее образования — воспалительный процесс.
Или же предположим, что данная пациентка при обострении хронического воспалительного процесса впервые попала в поле зрения врача, который назначил бы ей прием Лонгидазы в составе комплексной консервативной терапии. Учитывая, что в этот момент у нее после перенесенного эпизода острого воспалительного процесса уже имелись спайки в брюшной полости, (так как при остром ВЗОМТ профилактику спаек препаратом лонгидаза ей не проводили), а следовательно, наличие спаечного процесса снижало эффективность терапии ВЗОМТ антибактериальным препаратами, что привело к рецидиву заболевания. В данной клинической ситуации лонгидаза способствует профилактике возникновения новых спаек при обострении воспалительного процесса, делает более эластичными старые спайки, уменьшает отек воспаленных тканей, ускоряет улучшает движение жидкости в межтканевом пространстве, что увеличивает биодоступность антибактериальной терапии.
Заключение
Таким образом, включение лонгидазы в комплексную терапию острых и хронических воспалительных заболеваний органов малого таза, а также после перенесенных операций на органах брюшной полости позволяет повысить эффективность этиотропной терапии, предотвратить формирование или уменьшить степень выраженности уже существующего спаечного процесса.



