Беременность, назначение эстрогенов и хорионического гонадотропина в протоколах вспомогательных репродуктивных технологий (ВРТ) – состояния, которые характеризуются повышенным риском развития венозных тромбоэмболических осложнений (ВТЭО) [1]. Предлагаемые в настоящее время режимы тромбопрофилактики основаны на балльной оценке факторов риска венозного тромбоэмболизма, дозы антикоагулянтов предлагается назначать, ориентируясь на массу тела женщины [2–4]. Лабораторный мониторинг за назначенными антикоагулянтами не предусмотрен, хотя авторы рекомендаций указывают на возможный риск геморрагических осложнений при проведении тромбопрофилактики. Показано, что кровотечения, связанные с беременностью могут иметь место в 1,98% случаев, послеоперационные гематомы – в 2% случаев. Обзор Cochrane [5] применения низкомолекулярных гепаринов (НМГ) и нефракционированного гепарина (НФГ) для тромбопрофилактики у женщин, перенесших кесарево сечение, выявил больше эпизодов возникновения кровотечений и гематом, чем у женщин, не получающих гепарин (отношение рисков 5,15).
В рекомендациях [2] для некоторых категорий пациенток (ожирение, тромбофилии высокого риска) предлагается возможность контроля дозы НМГ с помощью Анти-Xа активности и отмечается, что «уровни Анти-Xа дают лишь приблизительное представление о фактической концентрации гепарина и мало или не информативны в отношении профилактики тромбозов». В 2014 г. в рекомендациях Федерации анестезиологов и реаниматологов по периоперационному ведению больных, получающих длительную антитромботическую терапию, для контроля за НФГ и НМГ, в том числе предлагаются глобальные тесты оценки системы гемостаза – тромбоэластометрия и тромбодинамика [6].
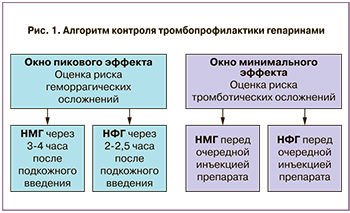 Тромбоэластометрия – это «прикроватный» глобальный тест, в первую очередь полезный для неотложной оценки риска кровотечения [7]. Мы используем тромбоэластометрию у беременных перед родами на сроке 36–37 недель, когда необходимо оценить риск геморрагических осложнений, особенно, при назначении антикоагулянтов. В этом случае взятие крови необходимо проводить на пике действия препарата (рис. 1).
Тромбоэластометрия – это «прикроватный» глобальный тест, в первую очередь полезный для неотложной оценки риска кровотечения [7]. Мы используем тромбоэластометрию у беременных перед родами на сроке 36–37 недель, когда необходимо оценить риск геморрагических осложнений, особенно, при назначении антикоагулянтов. В этом случае взятие крови необходимо проводить на пике действия препарата (рис. 1).
Тромбодинамика – это тест с высокой чувствительностью к действию всех современных антикоагулянтов, который позволяет оценить эффективность и безопасность назначенной антитромботической профилактики/терапии [8]. Мы используем тромбодинамику с целью персонифицированного подбора эффективной дозы НМГ у женщины во время проведения протокола ВРТ и при наступлении беременности на исходе действия препарата, то есть взятие крови необходимо проводить до очередной инъекции НМГ (рис. 1).
Представлен клинический случай, демонстрирующий возможности глобальных методов оценки системы гемостаза у пациентки с тромбофилией высокого риска ВТЭ.
В настоящее время все рекомендации по использованию НМГ у женщин, проходящих процедуру ВРТ/ЭКО, касаются только вопросов тромбопрофилактики, уровень доказательности достаточно низкий (C-D), дозы НМГ назначаются исходя из массы тела женщины [2, 4].
В клиническом случае представлен опыт ведения пациентки с высоким риском ВТЭО в протоколе ВРТ/ЭКО и во время наступившей беременности с использованием для контроля за состоянием системы гемостаза рутинных тестов гемостаза и тромбодинамики.
Пациентка А., 26 лет, рост 167 см, вес 60 кг. Из акушерско-гинекологического анамнеза: менархе в 13 лет, нарушений цикла и гинекологических заболеваний нет, всего 2 беременности: 1-я – в 2010 г. правосторонняя трубная, правая маточная труба удалена, 2-я – в 2011 г., неразвивающаяся на сроке 8 недель, закончилась выскабливанием полости матки с кариотипированием абортуса (кариотип в норме). Вторичное бесплодие. При обследовании выявлен врожденный дефицит антитромбина III (54%). Осложненный семейный тромботический анамнез – у матери тромбоз глубоких вен в возрасте 40 лет в позднем послеродовом периоде после вторых родов.
Протокол контролируемой стимуляции суперовуляции на фоне антагонистов. Стимуляция начата со 2-го дня менструального цикла препаратом рекомбинантного ФСГ со стартовой дозы 125 МЕ с последующим понижением дозы до 75 МЕ и введением препарата антагониста гонадотропин-рилизинг гормонов 0,25 мг с 9-го дня стимуляции при констатации доминантного фолликула 13–14 мм. На 12-й день стимуляции при достижении доминантного фолликула 17 мм введен триггер овуляции овитрель 250 мкг. Пункция пяти фолликулов произведена на 14-й день стимуляции. Поддержка лютеиновой фазы проводилась препаратами прогестерона.
В цикле предшествующем стимуляции был назначен комбинированный оральный контрацептив (КОК) для синхронизации роста фолликулов в цикле стимуляции и для планирования включения пациентки в протокол ЭКО.
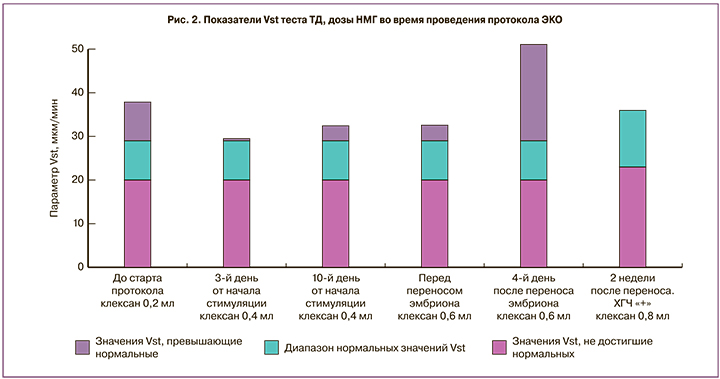
Показатели параметра стационарной скорости (Vst) теста тромодинамика, дозы антитромботических препаратов на этапах протокола представлены на рис. 2. После наступления беременности проводился контроль показателей системы гемостаза и теста тромбодинамики.
Врожденный дефицит антитромбина III – это тромбофилия высокого риска, до 60% носителей в течение жизни реализуют клинический тромбоз. Именно поэтому данное состояние – абсолютное показание для проведения тромбопрофилактики, начиная с момента планирования/установления беременности и в протоколах ВРТ. Важно, что рекомендованы высокие профилактические или даже лечебные дозы НМГ. Необходимо также сделать акцент на том, что и назначение высоких доз НМГ потенциально может приводить к снижению уровня антитромбина (так называемое потребление антитромбина), и у части пациентов требует либо заместительной терапии препаратом антитромбина III, либо перевода на фондапаринукс, применение которого у беременных малоизучено [2].
Обсуждение
Пациентка вступила в протокол ЭКО с исходной патологической гиперкоагуляцией по данным тромбодинамики на фоне приема КОК и профилактических доз НМГ (эноксапарин 0,2 мл). Проведение стимуляции суперовуляции сопровождалось прогрессированием патологической гиперкоагуляции и, к моменту переноса эмбрионов, доза эноксапарина была уже высокой профилактической (0,6 мл в сутки). На 4-й день после переноса эмбрионов с началом имплантации была зафиксирована выраженная патологическая гиперкоагуляция по данным тромбодинамики, что потребовало постепенного увеличения дозы эноксапарина до 1,0 мл в сутки (0,6 мл утром и 0,4 мл вечером) и дополнительного назначения ацетилсалициловой кислоты (тромбоасс 50 мг в сутки) в связи с выраженным спонтанным образованием сгустков (рис. 2). На фоне комбинированной антитромботической профилактики (эноксапарин и ацетилсалициловая кислота) удалось стабилизировать гемостаз и обеспечить наступление беременности.
На 9-й неделе беременности отмечено прогрессивное снижение уровня антитромбина III до 43% (таблица). В связи с отсутствием препарата антитромбина III проводилась трансфузия одногруппной свежезамороженной плазмы (СЗП) в объеме 3000 мл в течение недели (без осложнений), указанная терапия оказалась эффективной – уровень антитромбина III стабилизировался. Повторно трансфузия одногруппной СЗП потребовалась на сроке 14 недель в объеме 1400 мл (без осложнений), что вновь привело к стабилизации уровня антитромбина III до исходного.
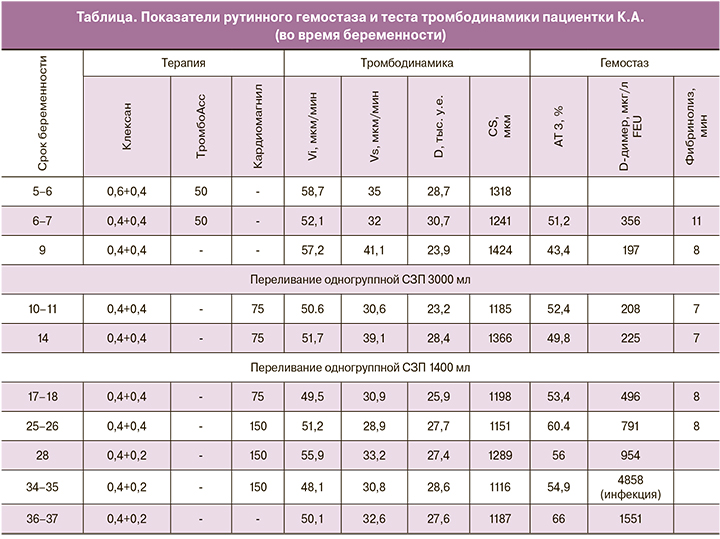
После 18 недели беременности в связи с патологическими изменениями по данным допплерометрии маточных артерий, доза ацетилсалициловой кислоты была увеличена до 150 мг в сутки, пациентка получала ее до 35 недель беременности. После 26 недели беременности дозу эноксапарина удалось снизить до 0,6 мл в сутки (0,4 мл утром и 0,2 мл вечером). В 36 недель была проведена оценка рисков геморрагических осложнений с помощью тромбоэластометрии (NATEM – оценка спонтанной коагуляции) – взятие крови произведено через 3 часа после введения утренней дозы эноксапарина. Результат представлен на рис. 3.
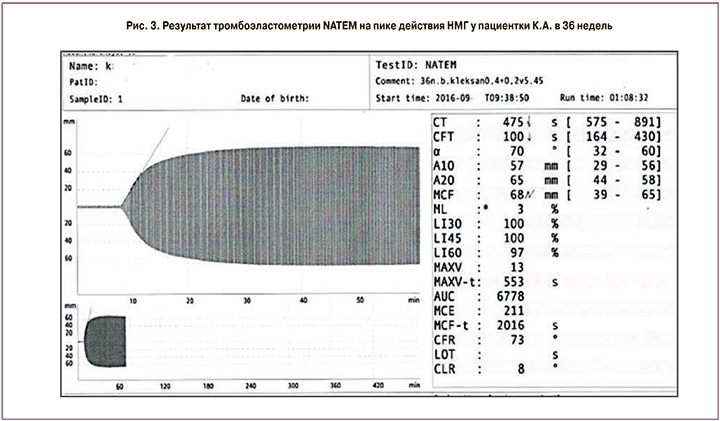
На пике действия эноксапарина регистрировалась хронометрическая гиперкоагуляция, что позволило рекомендовать отмену НМГ за 12 часов до планового родоразрешения. Родоразрешение произведено путем кесарева сечения на сроке 38 недель, вес ребенка 3980 г, 9 баллов по шкале Апгар. Постнатальная тромбопрофилактика НМГ проводилась в течение 6 недель.
Таким образом, проведение протокола ВРТ/ЭКО у женщин с тромбофилией высокого тромбогенного риска должно сопровождаться тщательным гемостазиологическим контролем и индивидуальным подбором антитромботической терапии. В случае выявления исходной выраженной патологической гиперкоагуляции, либо очевидной «неуправляемости» гемостаза к моменту переноса эмбрионов, предпочтительно перенос отложить до стабилизации гемостаза.
Выводы
- Для некоторых женщин с дополнительными факторами риска (осложненный семейный или личный тромботический анамнез) может быть необходима индивидуальная оценка тромбогенного риска, а также индивидуальный подбор дозировки назначаемых антикоагулянтов с целью тромбопрофилактики.
- Персонифицированный подбор доз НМГ с или без ацетилсалициловой кислоты у женщин с тромбофилией высокого риска, либо с исходной патологической гиперкоагуляцией в протоколах ЭКО преследует цели не только тромбопрофилактики, но и успешного вынашивания беременности в случае ее наступления и позволяет минимизировать геморрагические осложнения.



