Врастание плаценты (ВП) – наиболее тяжелая форма из всех вариантов аномалий ее прикрепления с высоким риском маточных кровотечений, занимающих, по данным ВОЗ, лидирующие позиции среди всех причин материнской смертности [1]. При этом непосредственная доля ВП в структуре материнской смертности достигает 7% [2].
Родоразрешение в родовспомогательном учреждении 3-го уровня с участием многопрофильной хирургической бригады, проведенное в соответствии с современными протоколами подтвержденной доказательной эффективности, позволяет снизить материнскую смертность, сохранить фертильность пациенток [3–6]. Однако выделение контингента, нуждающегося в такой адресной госпитализации, обеспечивается точностью пренатальной диагностики данной грозной патологии.
Общепризнано, что дородовая диагностика ВП основывается на эхографических признаках двухмерного серошкального изображения, цветового допплеровского картирования (ЦДК) и трехмерной эхографии с опцией энергетического допплера. В то же время пренатальный диагноз ВП остается в определенной степени субъективным и определяется опытом специалиста в выявлении данной патологии, который может быть ограничен редкостью ее встречаемости и отсутствием тренировочных программ, аналогичных существующим для анеуплоидий, врожденных пороков развития плода, в том числе пороков сердца. Как и при всех диагностических методах исследования, регистрация наличия или отсутствия каждого признака также зависит от интерпретации его оператором. Вариабельность представленных в научной литературе показателей чувствительности и специфичности большинства эхографических маркеров ВП обусловлена отсутствием используемой авторами единой терминологии. Последнее положение инициировало разработку экспертами из 35 стран Европейской рабочей группы по патологической инвазии плаценты (EW-AIP) предложений по стандартизации описания эхографических признаков при оформлении протоколов ультразвукового исследования [7].
С целью повышения точности пренатальной диагностики ВП и соответствия протоколов исследований, а также отечественных научных трудов международным требованиям авторы настоящей статьи сочли необходимым представить перечень предложенных EW-AIP терминов и их описание, а также краткий обзор научной информации и метаанализов различных методов ультразвуковой и лучевой визуализации ВП за последние 10 лет, составивший основу Консенсусных рекомендаций FIGO по нарушениям прикрепления плаценты [8].
Распространенность ВП в общей популяции составляет примерно 1,7 на 10 000 беременностей [9, 10].
В настоящее время различные варианты патологии прикрепления плаценты с позиций патофизиологии рассматриваются во взаимосвязи с процессами бластогенеза и объединяются термином «бластопатии» [11]. Патологическая инвазия трофобласта характеризуется проникновением первичных ворсин хориона за границы decidua basalis в миометрий. В зависимости от глубины инвазии ворсин в миометрий выделяют: частичное плотное прикрепление или приращение – placenta accreta, при котором ворсины хориона достигают миометрия, не повреждая целостности мышечных волокон. Это наиболее часто встречающийся вариант, составляющий 75%. Истинное врастание ворсин в толщу миометрия – placenta increta – сопровождается повреждением его структуры, частота данного варианта достигает 18%. Placenta percreta ассоциируется с прорастанием ворсинами всей толщины миометрия, вплоть до параметрия и брюшины, реже соседних органов (мочевой пузырь, кишечник). Хотя этот вариант относится к редким (встречается с частотой 7%), он приводит к самым грозным осложнениям [12].
ВП является растущей акушерской проблемой, обусловленной ежегодным увеличением удельного веса кесаревых сечений (КС) во всем мире. Начиная с 1965 г., отмечено 10-кратное увеличение данного вида родоразрешения [13, 14]. Так, в Великобритании этот показатель достиг 23%, в США – 31%. Подобная тенденция наблюдается и в России, где, по данным Федеральной службы государственной статистики, частота КС с 17,9% в 2005 г. возросла до 26,7% в 2014 г. [15].
Вышеизложенное обусловливает высокую актуальность проблемы диагностики различных вариантов аномалий прикрепления плаценты.
Недавние исследования, проведенные в Англии, Норвегии и США, показали, что ВП не диагностируется до родов в 2/3 случаев, а в 1/3 – и в специализированных учреждениях [16–19].
Родоразрешение в специализированном многопрофильном стационаре с бригадой высокопрофессиональных акушеров и использованием современных методов эндоваскулярной хирургии, безусловно, снижает материнскую заболеваемость и смертность. Однако такая госпитализация требует точной пренатальной диагностики данной грозной патологии. Именно точность диагностики определяет объем предоперационной подготовки и вид оперативного родоразрешения при ВП [3–6].
Общепризнано, что пренатальная диагностика ВП основывается на субъективных эхографических признаках двухмерного серошкального изображения, ЦДК и трехмерной эхографии с опцией энергетического допплера и, независимо от используемого метода, определяется современностью используемого оборудования, сроком беременности, а главное – опытом специалиста, проводящего исследование. Подтверждая последнее, результаты когортных исследований Finberg et Williams [20], Comstock et al. [21], а также работа Бойковой Ю.В. и соавт. [22] демонстрируют высокие показатели чувствительности и специфичности при двухмерном серошкальном изображении в выявлении ВП операторами экспертного уровня.
Необходимо отметить, что с момента первого ультразвукового описания ВП в 80-е годы прошлого столетия представлено всего 1078 случаев, и только 53 из них отмечены сообщениями в международной литературе [12].
Систематический обзор и метаанализ 2013 г. [23] ультразвуковых исследований, включающих 3907 беременностей с риском ВП, показали отличную производительность эхографии с чувствительностью 90,7% (95% ДИ 87,2–93,6), специфичностью 96,94% (95% ДИ 96,3–97,5) при диагностическом отношении шансов (ДОШ) 98,59% (95% ДИ 48,8–199,0). Другой систематический обзор и метаанализ 14 когортных исследований 2017 г. [24], включавших 3907 беременностей с предлежанием плаценты (ПП) или ее низким расположением, одним или более КС в анамнезе, выявил 328 (8,4%) случаев ВП, из которых 298 (90,9%) диагностированы пренатально с помощью эхографии. При этом объединенная пренатальная эффективность ее оказалась выше в проспективных исследованиях по сравнению с ретроспективными (с ДОШ 228,5 против 80,8 соответственно).
С целью улучшения ультразвуковой предикции, минимизации диагностических ошибок и достижения единого стандарта оформления протоколов EW-AIP предложила следующие термины для конкретных ультразвуковых признаков ВП и их описания [8], представленные в таблице.
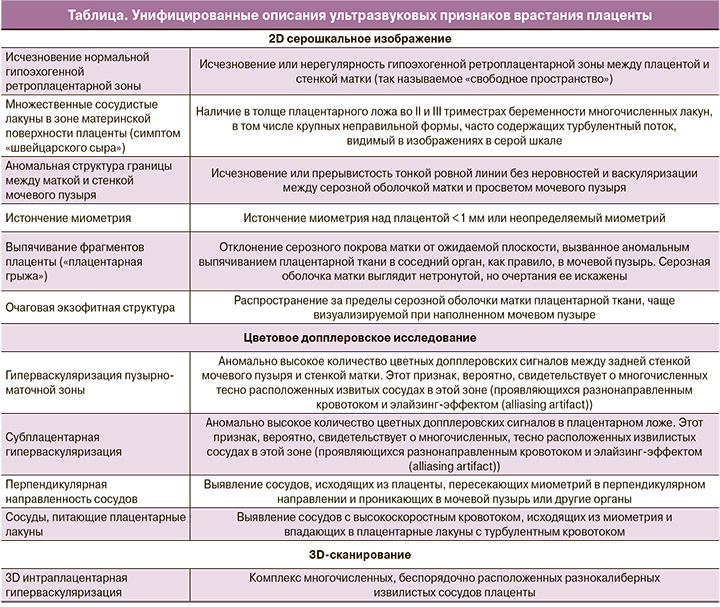
Систематический обзор результатов использования этого нового стандартизированного описания позволил выделить наиболее распространенные ультразвуковые признаки для различных морфологических вариантов инвазии. Так, для placenta accreta – исчезновение (нерегулярность) нормальной гипоэхогенной ретроплацентарной зоны (62,1%) и перпендикулярная направленность сосудов (71,4%); для placenta increta – исчезновение (нерегулярность) нормальной гипоэхогенной ретроплацентарной зоны (84,6%) и субплацентарная гиперваскуляризация (60%); для placenta percreta – наличие плацентарных лакун (82,4%) и субплацентарная гиперваскуляризация (54,5%) [12].
Для определения степени (глубины) инвазии плаценты в отдельных работах большое диагностическое значение отводилось такому ультразвуковому признаку, как плацентарные лакуны [21, 25]. По мнению Chou M.M. et al. [25], выраженные сосудистые изменения при ВП, обусловленные полнокровием и патологическим неоангиогенезом, способствуют их ранней визуализации во время беременности. Согласно исследованиям Bowman Z.S. et al. [16], для диагностики инвазии достаточно обнаружения 5±2,7 лакуны, тогда как при ложноположительном и ложноотрицательном диагнозах их выявляется вдвое меньше. Comstock C.H. et al. [21] также демонстрировали высокую диагностическую ценность этого признака: чувствительность 79% в сроки 15–20 недель и 93% – в сроки 15–40 недель беременности, а также прямую корреляционную зависимость степени инвазии от числа лакун.
Работы Weiniger C.F. et al. [26] и Rac M.W. et al. [27] показали, что объединение диагностических функций, связанных с ВП, и эхографических признаков при создании прогностических уравнений путем математического моделирования повышает точность пренатальной диагностики по сравнению только с эхографией. Тем не менее ни в одном из представленных выше сообщений варианты врастания по их степеням не различались. По мнению экспертов, выполнение исследований с ограниченным размером выборок в центрах, специализирующихся на пренатальной диагностике ВП, могло приводить к завышению показателей точности.
Таким образом, согласно мнению экспертов, подготовивших Консенсусные рекомендации FIGO [8], широкая гетерогенность в терминологии, используемой для описания степени ВП, и различия в дизайне не позволяют выделить отдельных ультразвуковых признаков или их комбинации для определения глубины инвазии [12, 23, 28].
Высокой прогностической ценностью при оценке как глубины, так и топографии при ВП обладает магнитно-резонансная томография (МРТ) [15]. Несмотря на немногочисленные сообщения, экспертами сделано заключение о наибольшей диагностической значимости метода для выявления инвазии плаценты в параметрий [29–31].
По данным систематического обзора 2014 г. [31] сделано заключение, что, не являясь скрининговым методом, МРТ следует рассматривать в качестве вспомогательного и при подозрении на ВП использовать после ультразвукового исследования. Предполагается, что применение в будущем безопасных контрастов повысит диагностические показатели МРТ.
Для лучшего аудита и повышения точности будущих исследований подчеркивается важность применения стандартизированной терминологии при описании ультразвуковых изображений, а также патоморфологической и клинической верификации в каждом отдельном случае ВП.
Оперативные вмешательства (КС, миомэктомия, повторные выскабливания стенок полости матки, приводящие к дистрофическим изменениям базального слоя эндометрия, нарушению эпителиально-стромальных взаимодействий и, как следствие, рецептивности); ПП; вспомогательные репродуктивные технологии (ВРТ); возраст матери (старше 35 лет); а также многоплодная беременность традиционно рассматриваются в качестве факторов риска данной патологии и относятся к клиническому скринингу [9, 10, 32].
Проведенный экспертами анализ показал, что наиболее часто описываемым фактором риска является сочетание предшествующего КС и ПП [6]. Подобное сочетание также ведет к таким серьезным осложнениям, как высокий риск кровотечения во время беременности, невозможность самопроизвольных родов, недостаточная сократимость нижнего маточного сегмента, ведущая к массивному послеродовому кровотечению. Частота риска ВП прогрессивно увеличивается с количеством КС в анамнезе: так, его вероятность при одном рубце на матке составляет 24%, при четырех и более может достигать 67% [3].
Согласно заключению Консенсусных рекомендаций [8], детальный скрининг на предмет ВП необходим именно у этой группы пациентов. Все женщины с низким расположением плаценты (нижний край плаценты <2 см от внутреннего зева шейки матки) после 16 недель беременности или с ПП и рубцом после КС в анамнезе должны быть направлены в перинатальный центр с опытом диагностики ВП.
Положение о том, что развитие беременности в рубце после предыдущего КС может служить предиктором одной из степеней ВП, по заключению рекомендаций FIGO [8], требует детального ультразвукового скрининга уже на ранних сроках беременности [33–36].
Выделены три диагностически значимых эхографических критерия для трансвагинального сканирования (ТВС):
- визуализация плодного яйца ближе к внутреннему зеву в пределах видимого дефекта миометрия (при истончении миометрия или неопределяемом миометрии) в нижнем маточном сегменте в области рубца от предыдущего КС;
- определение трофобластического/плацентарного типа кровотока при ЦДК (с высокой пиковой скоростью >20 см/с и низким пульсационным индексом <1);
- смещение плодного яйца при мягком давлении трансвагинальным датчиком позволяет дифференцировать данное состояние от спонтанного аборта [37].
В целом беременность в рубце на матке, даже при отсутствии врастания, представляет собой высокий риск акушерских осложнений, обусловленных последствиями обширного ПП, – массивного акушерского кровотечения. Таким образом, женщин с диагностированной в I триместре беременностью в области послеоперационного рубца следует проконсультировать относительно высокого риска осложнений, включая гистерэктомию.
Для изучения значимости в качестве маркеров пренатальной диагностики рассматриваемой патологии у женщин с ВП ретроспективно исследовались гормоны, уровень которых определяется при рутинном акушерском скрининге I триместра [37– 39]. Было установлено, что на 11–12-й неделе беременности показатель β-субъединицы хорионического гонадотропина человека (ХГЧ) понижен, а ассоциированного с беременностью белка плазмы крови РАРР-А – повышен. Медиана для β-ХГЧ и АФП на 14–22-й неделе беременности при ВП достигает 2,5 МоМ (OШ 3,9; 95% ДИ 1,5–9,9 и OШ 8,3; 95% ДИ 1,8–39,3 соответственно) [40]. Различий в уровнях внеклеточной фетальной ДНК обнаружено не было [41].
В целом после подтверждения результатов в проспективных исследованиях данные биомаркеры, по заключению членов Экспертной группы FIGO по диагностике и лечению placenta accreta [8], могут быть использованы в качестве дополнения к ультразвуковому скринингу.
Особое внимание в рекомендациях FIGO [8] уделено строгому соблюдению методологии, отдельным техническим аспектам выполнения исследования, отражающимся на точности полученных результатов.
В мировой литературе ультразвуковые признаки патологической инвазии плаценты чаще всего описаны при трансабдоминальном сканировании (ТАС) и гораздо реже, в основном при ПП, при ТВС [24]. При ТВС рекомендуется определить канал шейки матки, внутренний зев и локализацию нижнего края плаценты по отношению к внутреннему зеву, а также для прицельной оценки нижнего маточного сегмента и поверхности мочевого пузыря. Для ТАС предпочтителен выбор высокочастотного конвексного датчика (5–9 МГц), с помощью которого в положении, перпендикулярном стенке матки, проводится исследование послеоперационного рубца от одного конца до другого.
Ультразвуковое исследование должно осуществляться при наполненном мочевом пузыре (около 200–300 мл). Наличие так называемого «акустического окна» обеспечивает лучшую визуализацию нижнего маточного сегмента – предполагаемого места предыдущего КС. Таким образом оценивается расположение плаценты по отношению к предполагаемому месту рубца. При опорожненном мочевом пузыре такие признаки, как аномальная структура границы между маткой и стенкой мочевого пузыря, выпячивание фрагментов плаценты («плацентарная грыжа») и гиперваскуляризация пузырно-маточной зоны, не могут быть оценены должным образом.
Подчеркивается недопустимость чрезмерного надавливания датчиком во время ТАС, которое может привести к исчезновению нормальной гипоэхогенной ретроплацентарной зоны – одного из признаков патологической инвазии плаценты.
Использование ЦДК с опцией энергетического допплера при оценке кровотока области нижнего маточного сегмента не может рассматриваться как рутинное исследование. Даже опытные специалисты часто не имеют базовых знаний об особенностях кровотока в этой области. Несмотря на субъективность оценки, чрезмерную васкуляризацию в нижнем маточном сегменте связывают с патологической инвазией плаценты. Проведение исследования требует для каждой пациентки соответствующей настройки аппарата. Индивидуальная настройка усиления (gain) позволяет оптимально визуализировать ток крови, несмотря на возможность его затухания при повышенной плотности тканей (например, из-за различий толщины подкожножировой клетчатки). Аналогично правильно выбранная шкала скорости (velocity scale) имеет решающее значение для изображения сосудистой системы и, таким образом, минимизации ошибочных диагнозов.
Недавний систематический обзор и метаанализ показали, что при беременности в рубце на матке необходима выжидательная тактика, что обусловлено высоким уровнем материнской заболеваемости, включая массивное кровотечение, ранний разрыв матки, гистерэктомию [42]. Однако этот обзор включал только 69 случаев и не имел полноценных данных о ее развитии и диагностике в I триместре.
Ввиду растущего числа КС резко возрастает необходимость внесения в курс обучения по ультразвуковой диагностике специальной программы ультразвукового скрининга при врастании плаценты. Несмотря на неоднократные обсуждения, эти намерения так и не были реализованы. Все специалисты по ультразвуковой диагностике должны знать о риске ВП, обращать особое внимание при низком ее расположении по передней стенке матки или предлежании [8].
Следует помнить, что ультразвуковые заключения не тождественны гистопатологическому диагнозу. Небольшие зоны патологической инвазии могут обнаруживаться и без симптомов ВП и не представляют клинической значимости [43]. Аналогично плотное прикрепление плаценты не требует серьезного хирургического вмешательства и может быть проведено консервативно. Можно утверждать, что целью пренатальной диагностики ВП является предупреждение акушерской бригады о вероятности акушерских осложнений, иными словами – выявление степеней ВП, имеющих клиническое значение, то есть placenta increta и percreta [7, 12, 23, 28, 44, 45]. Поэтому вызывает удивление, что все больше специалистов пренатальной диагностики наряду с ВП относят к числу истинно морбидных состояний ее плотное прикрепление.
В Консенсусных рекомендациях FIGO [8] подчеркивается, что, хотя визуальная диагностика является лучшим методом исследования, доступным для пренатальной идентификации ВП, тем не менее чувствительность и специфичность ее не достигают 100%. В случаях ложноотрицательного результата пренатальной диагностики хирург, выполняющий КС, будет использовать низкий поперечный разрез матки, что может привести к массивному интраоперационному кровотечению еще до извлечения младенца. Напротив, ложноположительный диагноз ВП может стать причиной необоснованного вертикального срединного разреза кожи и донного КС, тем самым увеличивая как вероятность интраи послеоперационных осложнений, так и риск развития ВП и разрыва матки при последующих беременностях [23].
Заключение
Таким образом, краткие рекомендации по пренатальной диагностике и скринингу врастания плаценты, по мнению Экспертной группы FIGO по диагностике и лечению placenta accreta, можно представить следующим образом:
- эхография является недорогим и широкодоступным методом визуализации и, следовательно, должна быть первоочередной в диагностике ВП;
- во II триместре беременности при наличии рубца на матке после предшествующего КС необходима тщательная оценка плаценты, особенно при предлежании или ее низком расположении;
- ультразвуковые признаки, наблюдаемые при диагностике ВП, должны быть описаны с использованием стандартизированных протоколов. Единая интерпретация ультразвукового диагноза требует регистрации каждого ультразвукового признака. Для решения последней задачи Европейской рабочей группой по патологической инвазии плаценты (EW-AIP) предложен образец протокола ультразвукового исследования в случаях подозрения на ВП, рекомендованный для внедрения в ежедневную клиническую практику и представленный нами в Приложении;
- МРТ не играет первоочередной роли в диагностике ВП, но может быть незаменимой для детализации топографии областей, которые сложно оценить при эхографическом исследовании.
Приложение




