Преэклампсия (ПЭ) развивается на фоне активации функции стресс-реализующих систем, что находит свое отражение в напряженном функционировании системы гемостаза. В развитии ПЭ особое значение имеет наличие наследственных и приобретенных факторов тромбофилии, изменение цитокинового баланса с выраженным провоспалительным сдвигом, эндотелиальная дисфункция и гипоксическое поражение мембран форменных элементов крови [1–3]. Ранняя диагностика тромбофилии у беременных представляет собой сложную в практическом плане задачу. Это связано с дороговизной, отсутствием в рутинной практике родовспомогательных учреждений, а иногда и низкой информативностью тестов [1].
Инициирующую роль в патогенезе ПЭ играет нарушение формирования маточно-плацентарного звена кровообращения. Повышенная агрегация тромбоцитов на фоне отсутствия гестационной трансформации спиральных сосудов проявляется формированием «немых» бессосудистых зон в плаценте [4]. Ишемия плаценты становится причиной увеличенной продукции вазоконстрикторов. Это приводит к системным реакциям, препятствующим формированию устойчивого ваго-инсулярного паттерна регуляции материнской гемодинамики в 1-ю половину беременности. Нарушения автономной регуляции сопровождаются отсутствием физиологической гиперволемии и повышением центральной симпатической барорефлекторной активности [5, 6]. Периферический вазоспазм находит свое проявление во вторичных изменениях маточно-плацентарной и плодово-пуповинной гемоциркуляции. При этом оксидативный стресс, эндотелиальная дисфункция и тромбофилия экстраполируют свое влияние на плаценту в виде гиповаскуляризации, атероза сосудов, тромбозов и инфарктов [3, 7]. Ишемический некроз синцитиотрофобласта провоцирует развитие системного воспалительного ответа организма беременной, спутником которого является хроническая форма синдрома диссеминированного внутрисосудистого свертывания. По-видимому, коагулопатия является одним из основных звеньев сценария ПЭ.
Профилактика и лечение тромбофилических состояний у беременных с ПЭ с помощью препаратов низкомолекулярных гепаринов (НМГ) имеет всестороннее обоснование [2, 3, 8, 9]. В Украине в течение нескольких лет используется самый низкомолекулярный из II поколения этих препаратов – бемипарин. Бемипарин содержит наименьшее количество (<35%) полисахаридных цепей с молекулярным весом менее 2000 Дальтон, что минимизирует влияние на IIа фактор свертывания и оказывает достоверно меньшее влияние по сравнению с предшественниками, имеющими больший молекулярный вес, на тромбиновое время. Это также снижает риск кровотечений. Он отличается самым высоким среди всех НМГ соотношением анти-Ха/анти-IIa факторной активности – 8/1, поэтому может быть использован для предоперационного старта в случаях, требующих экстренного абдоминального родоразрешения [3, 8].
Применение бемипарина у беременных подтвердило его безопасность [2, 9]. Вызывает интерес изучение уровня эрго- и трофотропных реакций плода на фоне использования бемипарина у пациенток с ПЭ.
Целью работы было изучение состояния регуляторных систем плода у беременных с ПЭ.
Материал и методы исследования
 Нами были обследованы 124 пациентки в сроках гестации 34–38 недель, у 30 из которых беременность протекала физиологически (I группа). Во II группе было 48 беременных с ПЭ различной степени, которые получали гипотензивную терапию в соответствии с клиническим протоколом № 676 Министерства здравоохранения Украины. III группу составили 46 женщин с ПЭ, которым дополнительно назначали бемипарин по 2500 МЕ подкожно 1 раз в сутки на протяжении до 14 дней. Диагноз и степени тяжести ПЭ устанавливали в соответствии с общепринятыми критериями [10]. Пациентки основной (III) и группы сравнения (II) были сопоставимы по степени тяжести ПЭ, экстрагенитальной патологии. Уровень ПЭ легкой, средней и тяжелой степени составил во II и III группах соответственно: 24 (50,0%) и 23 (50,0%), 16 (33,3%) и 16 (34,8%), 8 (16,7%) и 7 (15,2%).
Нами были обследованы 124 пациентки в сроках гестации 34–38 недель, у 30 из которых беременность протекала физиологически (I группа). Во II группе было 48 беременных с ПЭ различной степени, которые получали гипотензивную терапию в соответствии с клиническим протоколом № 676 Министерства здравоохранения Украины. III группу составили 46 женщин с ПЭ, которым дополнительно назначали бемипарин по 2500 МЕ подкожно 1 раз в сутки на протяжении до 14 дней. Диагноз и степени тяжести ПЭ устанавливали в соответствии с общепринятыми критериями [10]. Пациентки основной (III) и группы сравнения (II) были сопоставимы по степени тяжести ПЭ, экстрагенитальной патологии. Уровень ПЭ легкой, средней и тяжелой степени составил во II и III группах соответственно: 24 (50,0%) и 23 (50,0%), 16 (33,3%) и 16 (34,8%), 8 (16,7%) и 7 (15,2%).
Для изучения уровня регуляторных систем плода всем обследованным пациенткам проводили изучение вариабельности сердечного ритма (ВСР) плода путем неинвазивной ЭКГ плода на 10-минутных записях с помощью компьютерно-диагностической системы «Кардиолаб Бэби-Кард» НТЦ «ХАИ-Медика» (Харьков, Украина). Высокое качество регистрируемой с передней брюшной стенки матери ЭКГ плода подтверждено в ходе тестирования украинских записей международными экспертами [11].
Оценивали значение общей мощности спектра ВСР (TP) и мощности трех спектральных компонентов: очень низкочастотного (VLF), низкочастотного (LF) и высокочастотного (HF). Изучали следующие временные характеристики ВСР плода: SDNN (стандартное отклонение кардиоинтервалов), RMSSD (квадратный корень из суммы квадратов разности величин последовательных пар RR), pNN5O (процент количества пар количества пар последовательных кардиоинтервалов, отличающихся более чем на 50 мс), АМо (число кардиоинтервалов, соответствующих значению моды (или попавших в модальный интервал) в процентах к объему выборки) и ИН (индекс напряжения, который определяется отношением высоты гистограммы к ее ширине и характеризует степень напряжения регуляторных систем организма). Регистрацию ЭКГ плода проводили в периоды его двигательной активности. Из морфологических параметров ЭКГ плода изучали соотношение T/QRS.
Также проводили спектральный анализ кривых скоростей кровотока в вене пуповины. Допплерометрию осуществляли на аппарате Voluson 730 (США). Полученные допплеровские спектрограммы кровотока в вене пуповины подвергались дальнейшей обработке. Были выделены кривые изменения во времени максимальной скорости кровотока, для которой определены спектральные составляющие. Спектры рассчитывали с шагом дискретизации Δ t=0,01 секунды для выборки из 256 точек. Результирующий спектр получали усреднением по всем выборкам для данного контингента.
Полученные результаты обработаны методами параметрической статистики (среднее – M, ошибка – m) с помощью пакета программ Excel, адаптированных для медико-биологических исследований.
Результаты и их обсуждение
 Наличие ПЭ у беременных основной и группы сравнения нашло отражение в изменении функции регуляторных систем плода. Показатели ВСР плода на фоне ПЭ демонстрировали снижение всех фрактальных составляющих, как в периоды шевелений, так и в состоянии «покоя» (таблица). Установлено уменьшение TP, снижение мощности VLF и LF-диапазона и незначительная активность HF-компонента волновой части спектра. У плодов беременных II и III группы отмечалось доминирование центрального симпатического контура регуляции, что подтверждалось относительным возрастанием вклада LF в общую мощность спектра. При этом уменьшение SDNN отражало возрастание роли периферических звеньев контроля сердечного ритма и напряженное функционирование гипоталамо-гипофизарно-надпочечниковой оси. По-видимому, гиперсимпатикотония являлась компенсаторной реакцией плода у беременных с ПЭ. Парасимпатические влияния по данным значений HF, RMSSD и pNN5O не играли значительной роли в регуляции гемодинамики плода. Это демонстрировало снижение уровня дыхательной синусовой аритмии и тенденцию к ригидному ритму. Важным фактом следует считать уменьшение мощности VLF, что отражало нарушение эрго- и трофотропных реакций плода и манифестировало энергодефицитное состояние. Значение ИН, характеризовавшее функциональные резервы регуляторных систем, увеличивалось по сравнению с контрольными значениями. У беременных с ПЭ во II группе ИН был более 550 усл. ед., а АМо – более 55,1%. Это было проявлением тенденции к возрастанию уровня анаэробных процессов в миокарде плода под влиянием активации β-адренорецепторов. Указанные изменения подтверждались высокими значениями соотношения T/QRS, что было обусловлено подъемом сегмента ST. В группе пациенток, получавших бемипарин, ИН был в пределах 351–550 усл. ед., а АМо – 45,1–55,0%.
Наличие ПЭ у беременных основной и группы сравнения нашло отражение в изменении функции регуляторных систем плода. Показатели ВСР плода на фоне ПЭ демонстрировали снижение всех фрактальных составляющих, как в периоды шевелений, так и в состоянии «покоя» (таблица). Установлено уменьшение TP, снижение мощности VLF и LF-диапазона и незначительная активность HF-компонента волновой части спектра. У плодов беременных II и III группы отмечалось доминирование центрального симпатического контура регуляции, что подтверждалось относительным возрастанием вклада LF в общую мощность спектра. При этом уменьшение SDNN отражало возрастание роли периферических звеньев контроля сердечного ритма и напряженное функционирование гипоталамо-гипофизарно-надпочечниковой оси. По-видимому, гиперсимпатикотония являлась компенсаторной реакцией плода у беременных с ПЭ. Парасимпатические влияния по данным значений HF, RMSSD и pNN5O не играли значительной роли в регуляции гемодинамики плода. Это демонстрировало снижение уровня дыхательной синусовой аритмии и тенденцию к ригидному ритму. Важным фактом следует считать уменьшение мощности VLF, что отражало нарушение эрго- и трофотропных реакций плода и манифестировало энергодефицитное состояние. Значение ИН, характеризовавшее функциональные резервы регуляторных систем, увеличивалось по сравнению с контрольными значениями. У беременных с ПЭ во II группе ИН был более 550 усл. ед., а АМо – более 55,1%. Это было проявлением тенденции к возрастанию уровня анаэробных процессов в миокарде плода под влиянием активации β-адренорецепторов. Указанные изменения подтверждались высокими значениями соотношения T/QRS, что было обусловлено подъемом сегмента ST. В группе пациенток, получавших бемипарин, ИН был в пределах 351–550 усл. ед., а АМо – 45,1–55,0%.
Соотношение T/QRS также уменьшалось, что отражало улучшение метаболических процессов в миокарде. В отношении уровня HF следует отметить, что вагальный тонус возрастал у беременных с ПЭ в основной группе на фоне восстановления периодов кардиореспираторной синхронизации.
Проведенные исследования позволили установить, что у беременных с ПЭ отмечалось значительное преобладание симпатической регуляции над парасимпатической. При этом наличие тахикардии было проявлением централизации гемодинамики. В случаях появления эпизодов брадикардии выраженного увеличения ВСР не происходило. Это служило основанием утверждать, что в патогенезе антенатальных децелераций значительную роль играет доминирование центрального симпатического контура регуляции при наличии формирующегося гипоксического поражения миокарда плода и угнетенного ответа синусового узла.
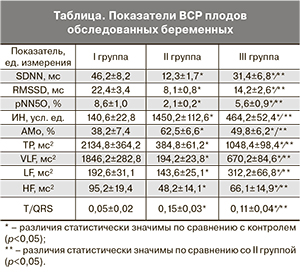
Изучение кровотока в вене пуповины, подчиняющегося автономным механизмам регуляции и обеспечивающего доставку кислорода и нутрициентов плоду, у обследованных беременных позволило охарактеризовать его с позиций природы установленных управляющих сигналов. В ходе построения фазовых портретов пуповинной венозной гемодинамики пациенток I группы были обнаружены два наиболее выраженных пика с частотными характеристиками 2 Гц и 7 Гц (рис. 1). Их амплитуда составила соответственно 0,15±0,03 усл. ед. и 0,14±0,02 усл. ед. Первый пик соответствовал частоте сердечных сокращений плода, а второй был обусловлен, по-видимому, сократительной активностью гладкомышечного слоя вены пуповины. Значение II пика можно было рассматривать как механизм, который способствует затуханию пульсационной волны в вене пуповины и поддерживает постоянный характер пуповинной флебогемодинамики.
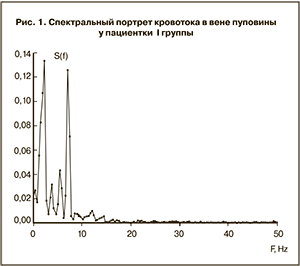
У пациенток II группы отмечено практическое отсутствие пика с частотой 7 Гц (рис. 2). При этом появлялся выраженный пик в области 0,5 Гц. По частотным характеристикам он соответствовал вагальному тону и характеризовал возрастающее влияние регуляторных механизмов матери на кровообращение плода [7, 12, 13]. По-видимому, дыхательная аритмия матери распространяла свое влияние на гемодинамику плода на фоне его страдания, что играло роль адаптационно-приспособительного механизма. Амплитуда пика в области 0,5 Гц составила 0,12±0,01 усл. ед. При этом пик в области 7 Гц отсутствовал, что характеризовало истощение собственной сократительной активности вены и сопровождалось тенденцией к появлению пульсационного паттерна кровотока.
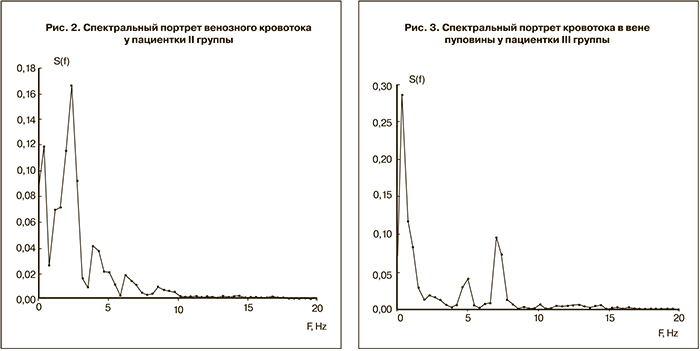
Под влиянием применения бемипарина (рис. 3) установлено возрастание по сравнению с группой сравнения амплитуды собственной сократительной активности вены и высокий уровень материнской гемодинамической «поддержки», распространявшей свое влияние на плод благодаря передаче медленно-волновых колебаний кровообращения через плацентарный барьер [7, 12, 13].
Амплитуда «материнского» и миогенного пиков в основной группе составила соответственно 0,22±0,06 усл. ед. и 0,11±0,04 усл. ед. Это позволило считать, что использование бемипарина оптимизирует маточно-плацентарное кровообращение и эрго-, трофотропные реакции пуповинной флебогемодинамики.
Результаты работы наводят на мысль, что возрастание симпатических влияний на регуляцию гемодинамики плода сопровождается постепенным уменьшением функциональных резервов регуляторных механизмов. Интересные изменения претерпевал теоретически полностью автономный кровоток в вене пуповины. У беременных с ПЭ на фоне страдания плода происходило истощение миогенной активности вены пуповины и возрастала роль медленно-волновых процессов, связанных с дыхательной аритмией матери.
В ходе наблюдения за обследованным контингентом установлено, что средние сроки родоразрешения составили 35,6±1,4 и 36,3±1,8 недели во II и III группах соответственно. Уровень дистресса плода в основной группе составил 17,4%, а в группе сравнения – 22,9%. При этом антенатальный дистресс был диагностирован в III группе в 10,9%, а во II – в 16,7% наблюдений. Необходимо отметить, что реализованные в «Кардиолаб Бэби-Кард» технологии позволяли дополнительно к показателям ВСР плода изучать параметры зубцов и интервалов фетальной ЭКГ. Примечательно, что благодаря оценке соотношения T/QRS показатели чувствительности и специфичности метода неинвазивной ЭКГ плода были абсолютными и составили 100,0%. Значение T/QRS у беременных с антенатальным дистрессом составило во II группе 0,19±0,04, а в III группе – 0,18±0,02. Тем не менее, малое количество наблюдений не дает возможности считать доказательными полученные данные о диагностических возможностях неинвазивной ЭКГ плода. Средняя оценка по шкале Апгар была в основной и группе сравнения соответственно 6,7±1,5 и 5,9±1,8 балла. Методологическая база данного исследования не позволяет делать выводы о влиянии бемипарина у беременных с ПЭ на исходы для матери и плода, но оставляет перспективу для подобной работы в будущем. Не отмечено влияния антикоагулянтной терапии на объем кровопотери в родах, который был во II и III группах практически одинаков и составил соответственно 480,6±64,2 и 492,1±79,5 мл. На объем кровопотери могло влиять активное использование на этапе родоразрешения препаратов, повышающих коагуляционный потенциал крови и сократительную активность матки.
Современное акушерство обладает стандартизованными подходами, сформулированными на основе многочисленных доказательных исследований. Тем не менее, возможности использования НМГ у беременных с различной гестационной патологией требуют дальнейшего изучения. Имеющиеся данные позволяют рассчитывать на перспективу в расширении показаний к применению препаратов НМГ в рутинной практике акушера-гинеколога.
Заключение
Применение бемипарина у беременных с ПЭ позволило оптимизировать автономную нервную регуляцию гемодинамических процессов плода, что сопровождалось относительным восстановлением дыхательной синусовой аритмии, нивелированием гиперсимпатикотонии с улучшением состояния миокарда плода и оптимизацией пуповинной флебогемодинамики.



