Опухоли яичников являются распространенной гинекологической патологией, занимая 2-е место по частоте после новообразований матки. Согласно данным RCOG (Royal College of Obstetricians and Gynecologists), около 10% женщин в течение жизни подвергаются хирургическому лечению по поводу объемных образований яичников [1, 2]. Приблизительно у 85% пациенток диагностируют эпителиальные опухоли, среди которых превалируют доброкачественные новообразования (70–80%), тогда как злокачественные опухоли составляют около 20–30% [3, 4].
Множество факторов связано с повышенным риском развития рака яичников (РЯ), в том числе: возраст, семейный анамнез РЯ, наследственные генетические мутации (например, BRCA1/BRCA2), ожирение, бесплодие или единственная беременность в анамнезе, использование заместительной гормональной терапии и увеличение числа овуляторных циклов в течение жизни [5, 6]. Большинство факторов риска демонстрируют значительную гетерогенность по подтипам РЯ [7]. Унаследованные мутации связаны с 5–15% развившихся карцином яичников. В связи с этим особой онкологической настороженности требуют пациентки с указанием на злокачественное новообразование любой локализации в анамнезе, установленными предрасполагающими мутациями BRCA1, BRCA2, P53, STK11 (синдром Пейтца–Егерса) [8–12], генов репарации ДНК (синдром Линча – наследственный неполипозный колоректальный рак), RAD51C, DICER и др., а также отягощенным генетическим анамнезом по раку молочной железы, яичников, эндометрия, толстой кишки, желудка, почек, легких. Для этих женщин рекомендуется генетическое консультирование, включая обсуждение рисков и преимуществ профилактики (риск-редуцирующие операции, RRSO) [13–15]. Отсутствие специфических клинических и диагностических маркеров, их латентное течение, особенности распространения (имплантационное, гематогенное, лимфогенное) и низкая выявляемость заболевания на ранних стадиях приводят к неоптимальным результатам лечения у данной группы пациенток. В связи с этим пятилетняя выживаемость при всех стадиях не превышает 35%, при этом прогноз заболевания напрямую зависит от стадии на момент постановки диагноза [16, 17]. Пациенты с 1-й стадией заболевания имеют 5-летнюю выживаемость 80–90%, тогда как с 3–4 стадией болезни – 10–20% [18]. В настоящее время ведущими медицинскими сообществами гинекологов-онкологов (SGO, ACOG) предложены стандарты обследования пациентов, включающие: 1) сбор анамнеза и клинический осмотр; 2) определение уровня СА-125 в периферической крови пациенток, 3) ультразвуковое обследование с цветным допплеровским картированием (трансабдоминальное и трансвагинальное).
Дифференциальная диагностика новообразований яичников имеет решающее значение для выбора оптимальной тактики ведения пациента. На сегодняшний день не существует эффективного и экономически оправданного скрининга. Срочная интраоперационная морфологическая диагностика (СИМД) криостатных срезов опухолей яичников используется, как правило, в третичных центрах для определения потенциала злокачественности новообразования и выбора объема хирургического лечения. Важность СИМД остается несомненной, так как применение данной методики позволяет избежать повторных операций или излишне обширных хирургических вмешательств, что влияет на качество жизни пациентов, фертильность, частоту интраоперационных и послеоперационных осложнений, время пребывания в стационаре и длительность реабилитационного периода. Настоящее исследование было проведено для изучения роли СИМД в выборе тактики хирургического лечения, а также нами предпринята попытка определения гистотипа опухолей на этапе интраоперационной диагностики.
Цель данного исследования состояла в том, чтобы определить чувствительность, специфичность и прогностическую значимость СИМД в дифференциальной диагностике опухолей яичников и оценить роль в выборе объема хирургического лечения, а также проанализировать возможности данной методики в определении гистологического подтипа опухоли.
Материалы и методы
Это было описательное продольное исследование, проведенное в отделении инновационной онкологии и гинекологии ФГБУ «НМИЦ АГиП им. В.И. Кулакова». За период с 2018 по 2020 гг. срочное интраоперационное гистологическое исследование выполнено 77 пациентам. Для срочного гистологического исследования применяли криостатные срезы, количество срезов варьировалось от 1 до 4 и определялось на основании типа и размера опухоли. Использовался криостат Leica CM1950. Получали срезы от 7 до 8 мкм с последующим их окрашиванием гематоксилином и эозином. Все срезы были изучены под микроскопом на малом и большом увеличении двумя патологами, в случае несовпадения диагнозов – выносилось единое решение консилиума. Срочное гистологическое исследование проводили в течение 20–30 мин. Морфологический диагноз был передан хирургической бригаде, выполняющей соответствующую операцию. Результат СИМД был позже сопоставлен с окончательным гистологическим диагнозом.
Определялась диагностическая эффективность данной методики (чувствительность, специфичность, положительная и отрицательная прогностическая значимость) по формуле:
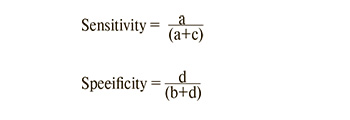
и ее влияние на объем оперативного лечения (a – больные, выявленные с помощью теста (истинно положительные); b – здоровые, имеющие положительный результат теста (ложноположительные); c – больные, не выявленные с помощью теста (ложноотрицательные); d – здоровые, имеющие отрицательный результат теста (подлинно отрицательные)).
Для цифрового анализа использовалось статистическое программное обеспечение SPSS версии 16.0 для Windows.
Также были проанализированы данные стандартного клинического обследования (уровень маркера СА-125, УЗ-характеристики новообразований). Были получены письменные информированные согласия всех пациентов, участвовавших в данном проспективном исследовании.
Результаты
Методика срочного исследования криостатных срезов выполнялась 77 пациентам с новообразованиями яичников в течение 18 месяцев. Возраст пациенток в исследуемой группе составил от 18 до 71 года, максимальное количество пациентов принадлежало к возрастной группе от 31 до 45 лет. В возрастном диапазоне 18–30 лет находились 9 пациенток, 31–45 лет – 32 пациентки, 46–60 лет – 23 пациентки, 61–75 лет – 13 пациенток.
Также оценивались клинические данные, симптомы, менструальная функция, семейный анамнез, перечисленные ранее факторы риска. Среди 77 исследованных пациентов наиболее распространенными симптомами были боль внизу живота (68,6%), увеличение живота в объеме, диспепсия, нарушение менструального цикла, запоры и учащенное мочеиспускание с элементами недержания мочи. Пациентам было выполнено экспертное предоперационное ультразвуковое исследование с подробным описанием опухоли. Все пациенты, имеющие новообразования с «пограничным риском злокачественности» (подозрение на экстраовариальное распространение опухоли/вовлечение мочеточника и гидронефротическая трансформация почек/лимфаденопатия и/или асцит от умеренного до массивного) направлялись на МРТ в качестве уточняющего исследования второго уровня. У 29 пациентов первичная операция была выполнена с использованием лапаротомного доступа, у 48 – выполнена лапароскопически.
Сонологические характеристики
Наличие асцитической жидкости различной степени выраженности определялось у 28 (36,4%) из общего числа пациентов. 23 (57,5%) пациента со злокачественными новообразованиями яичников имели выраженный асцит. У 43/77 (55,8%) пациенток размеры опухоли были более 10 см. Большинство опухолей яичников были односторонними. Из 23 (29,9%) двусторонних новообразований 17 (73,9%) были злокачественными. Отмечалось, что 37 (48%) опухолей имели кистозный характер, однако в 40 (52%) случаев имелся солидный компонент.
Опухолевый маркер CA-125
Всем пациентам в рамках предоперационного обследования определялся уровень онкомаркера СА-125. Значение СА-125 в сыворотке крови более 35 Ед/мл было обнаружено в 36 (46,8%) случаях. Уровень сывороточного СА-125 более 200 Ед/мл определялся в 23,4% случаев (18 пациентов). Из 40 пациентов с гистологически подтвержденными злокачественными опухолями в 32 случаях (80%) были повышенные значения сывороточного СА-125.
После удаления нативная опухоль немедленно передавалась в патоморфологическую лабораторию со всеми клиническими данными пациента. После тщательного исследования опухоли выполнялись срезы по усмотрению патолога. Количество замороженных срезов варьировалось от 1 до 4 и определялось на основании типа и размера опухоли. Во всех опухолях, диагностированных как пограничные, изучались как минимум два криостатных среза с помощью криостата Leica CM1860. Получали срезы от 7 до 8 мкм с последующим их окрашиванием гематоксилином и эозином. Все срезы были изучены под микроскопом на малом и большом увеличении двумя патологами с целью снижения операторозависимости методики, в случае несовпадения диагнозов – выносилось консилярное заключение. Морфологический диагноз передавался хирургической бригаде, выполняющей соответствующую операцию. Среднее время, затрачиваемое на всю процедуру (от отправки образца до получения результата), составляло приблизительно 20 минут. Диагноз был классифицирован как один из следующих: первичное эпителиальное новообразование яичника – доброкачественное, пограничное или злокачественное; первичная опухоль из зародышевых клеток яичника, доброкачественные неопухолевые состояния, а также в ходе исследования определялся гистологический подтип опухоли. По итогам результатов СИМД интраоперационно определялся объем оперативного вмешательства. Впоследствии результат исследования криостатных срезов сопоставлялся с окончательным гистологическим диагнозом (рисунок).
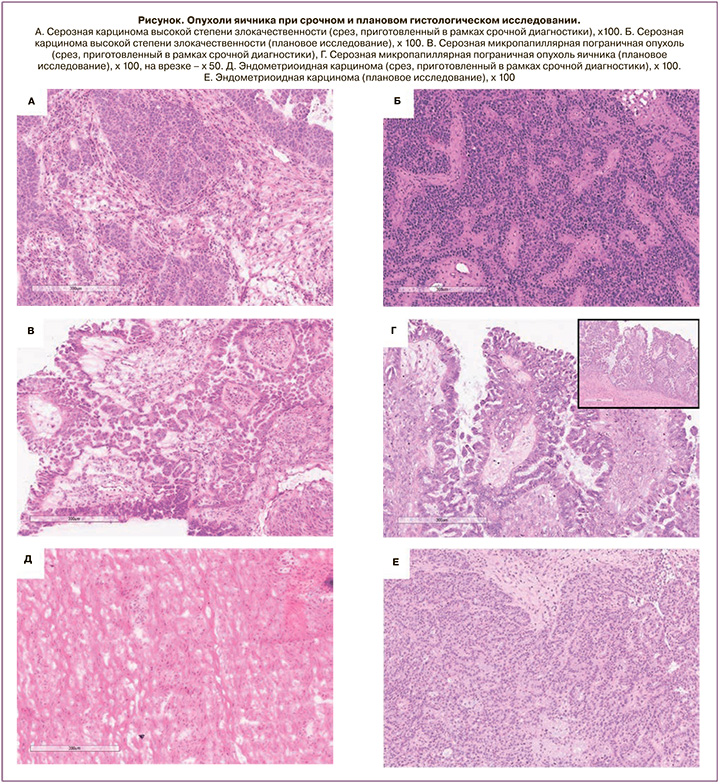
Срочная морфологическая диагностика криостатных срезов показала, что 20 (26%) опухолей были доброкачественными, 39 (50,6%) были злокачественными и 18 (23,4%) имели пограничный характер. Окончательный гистопатологический диагноз показал, что эпителиальных опухолей было 75 (97,4%), 1 (1,3%) – доброкачественная опухоль Бреннера, 1 (1,3%) – лютеинизированная текома яичника.
Среди 75 эпителиальных опухолей – 14 (20,8%) доброкачественных (10 серозных и 4 муцинозных), 21 (27,3%) пограничная (15 серозных, 3 серомуцинозных и 3 муцинозных) и 40 (51,9%) злокачественных (29 серозных карцином высокой степени злокачественности, 5 случаев серозных карцином низкой степени злокачественности, 1 муцинозная карцинома, 3 эндометриоидных и 2 светлоклеточных). Таким образом, из 75 случаев эпителиальных опухолей яичников в 7 случаях (9,3%) отмечено несовпадение между результатами СИМД и окончательными гистологическими заключениями, тогда как частота совпадений между диагнозами составила 90,7% (табл. 1). Было 2 отчета, где по результатам СИМД диагностирована серозная пограничная цистаденома, а в заключительном гистологическом диагнозе верифицирована серозная папиллярная цистаденокарцинома с низким потенциалом злокачественности (LGSC). Среди данных 7 случаев 4 пограничные опухоли яичников были ошибочно диагностированы как доброкачественные (одна муцинозная и три серозных) по данным СИМД. А также 1 серозная пограничная цистаденома, которая была неверно диагностирована как серозная цистаденокарцинома с высоким злокачественным потенциалом (HGSC).
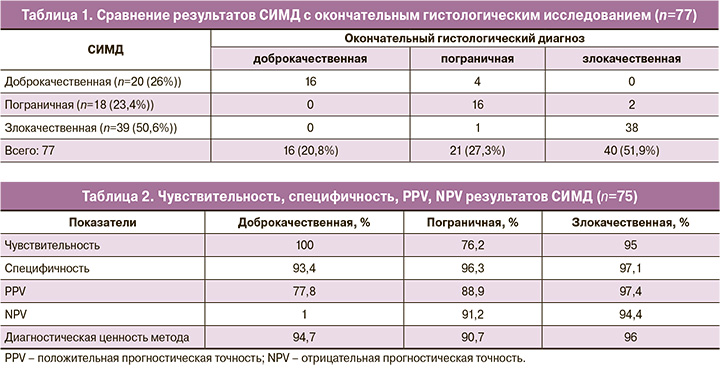
Точность данного метода (СИМД) для определения доброкачественных опухолей составила 94,7%, для пограничных – 90,7% и 96% в определении злокачественных новообразований. По итогам исследования СИМД продемонстрировало 100% чувствительность для доброкачественных опухолей, 93,44% специфичность, 77,8% положительную прогностическую ценность (PPV) и 100% отрицательную прогностическую ценность (NPV). Для определения злокачественных опухолей чувствительность составила 95% при специфичности 97,1%, PPV 97,44% и NPV 94,4%. Однако данная методика имела более низкую чувствительность (76,2%) и PPV (88,9%) в верификации пограничных опухолей. Специфичность составила 96,3%, а NPV – 91,2% в этой группе новообразований яичников (табл. 2). Оба случая диагностики неэпителиальных опухолей были верно определены по результатам срочного исследования. Также нами была предпринята попытка определения гистотипа исследуемых опухолей в рамках срочного гистологического исследования.
Обсуждение
Опухоли яичников всегда подвергаются СИМД с целью интраоперационной верификации диагноза, что обусловлено отсутствием дооперационной морфологической диагностики. Пункция новообразования сопряжена с высоким риском диссеминации опухолевого процесса. Изучение криостатных срезов является важным диагностическим инструментом определения характера поражений яичников. В 54% наблюдений проведено двустороннее исследование яичников. При СИМД сравнительно просто диагностируют неопухолевые поражения яичников, такие как фолликулярная, лютеиновая, эндометриоидная кисты, эндометриоз и т.д. СИМД истинных опухолей яичников имеет ряд ограничений, особенно при пограничных опухолях яичников, которые характеризуются некоторыми гистологическими особенностями – нарушением стратификации эпителиального пласта, увеличением митотической активности, в некоторых случаях ядерной атипией и отсутствием при этом стромальной инвазии. Срочная морфологическая диагностика криостатных срезов позволяет своевременно скорректировать объем оперативного лечения. При доброкачественных и пограничных опухолях яичников, а также в ряде случаев злокачественных новообразований возможно органосохраняющее лечение у женщин репродуктивного возраста, в то время как злокачественные эпителиальные опухоли, как правило, требуют расширенного хирургического вмешательства с выполнением экстирпации матки с придатками, оментэктомии, выполнением этапов хирургического стадирования, а также тазовой и парааортальной лимфаденэктомии. При исследовании опухолей яичников необходимо тщательное макроскопическое исследование материала в совокупности с клиническими данными и методами визуализации. Желательно исследовать несколько криостатных срезов из разных участков, а также в связи с высокой операторозависимостью методики следует привлекать двух независимых специалистов и в случае расхождений в диагнозе принимать консилярное решение. По нашим данным, ошибка при исследовании опухолей яичников имела характер гиподиагностики в 7,8% случаев, что связано в основном с наличием лишь микроочагов опухоли. Эффективность СИМД в дифференциальной диагностике доброкачественных и злокачественных опухолей яичников повышается при наличии выраженного солидного компонента в опухоли. Большой размер опухоли, двустороннее поражение, а также муцинозный характер также являются неблагоприятными факторами в определении злокачественного потенциала при СИМД. Основные недостатки методики замороженных срезов — ограниченное количество используемых участков и более низкое качество гистологических препаратов, чем при плановом гистологическом исследовании после приготовления парафиновых блоков, что влияет на точность морфологического диагноза. В замороженных срезах образуются кристаллы льда, вследствие чего происходит деформация материала и искажается архитектоника ткани.
Возрастной диапазон исследуемой группы составил от 18 до 71 года. Максимальное количество пациентов принадлежало к возрастной группе от 31 до 45 лет. Самому молодому пациенту в нашем исследовании было 18 лет, а самому старшему – 71 год. Средний возраст составил 43,6 года.
Визуализационные характеристики
В нашем исследовании большинство пациентов со злокачественными опухолями яичников имели размер опухоли более 10 см, солидный компонент и асцит. Это значимые параметры злокачественного потенциала опухоли.
Опухолевый маркер CA-125
Значения СА-125 в сыворотке крови более 35 Ед/мл были обнаружены в 36 (46,8%) случаях. Уровень сывороточного СА-125 более 200 Ед/мл определялся в 23,4% случаев (18 пациентов). Из 40 пациентов с гистологически подтвержденными злокачественными опухолями в 32 случаях (80%) значение СА-125 превышало нормативное.
Диагностическая точность срочного исследования криостатных срезов
Из 77 случаев ЭОЯ в 7 случаях (9,3%) отмечено несовпадение между результатами СИМД и окончательными гистологическими заключениями, тогда как частота совпадений между диагнозами составила 90,7%. Было 2 отчета, где по результатам СИМД диагностирована серозная пограничная цистаденома, а в заключительном гистологическом диагнозе верифицирована серозная папиллярная цистаденокарцинома с низким потенциалом злокачественности (LGSC). Среди данных 7 случаев 4 пограничные опухоли яичников были ошибочно диагностированы как доброкачественные (одна муцинозная и три серозных) по данным СИМД. А также 1 серозная пограничная цистаденома, которая была неверно диагностирована как серозная цистаденокарцинома с высоким злокачественным потенциалом (HGSC).
В соответствии с предыдущими опубликованными исследованиями было отмечено, что замороженный срез имел высокую чувствительность, специфичность и прогностические значения при прогнозировании доброкачественных и злокачественных новообразований яичника, но низкую чувствительность и PPV среди пограничных опухолей. На точность диагностики криостатных срезов могут влиять различные факторы, в том числе ошибка выборки, качество препаратов и опыт патологов. При СИМД сравнительно просто диагностируются неопухолевые поражения яичников, такие как фолликулярная, лютеиновая, эндометриоидная кисты, эндометриоз и др. Так, муцинозная опухоль яичника может иногда содержать доброкачественные, пограничные и злокачественные компоненты, в отличие от серозных опухолей. Около 20% серозных пограничных опухолей иногда содержат небольшие очаги серозного рака, которые могут не попасть в срез при срочном исследовании из-за ограниченного количества отбора проб [19, 20]. Возможности интраоперационного исследования муцинозных пограничных опухолей особенно ограничены из-за больших размеров опухоли и гетерогенности структуры: в одной и той же опухоли присутствуют доброкачественные, пограничные и злокачественные участки. В классификации ВОЗ (4-е издание, 2014 г.) приведены требования к вырезке материала для планового гистологического исследования: для опухолей менее 10 см в наибольшем измерении 1 блок на каждый сантиметр максимального размера; для образований более 10 см — по 2 блока на каждый сантиметр, особое внимание следует уделять участкам солидного строения, что неосуществимо в условиях СИМД [21]. Было установлено, что морфологическая сложность пограничных опухолей является основной причиной неточной диагностики пограничных опухолей во время СИМД. Другой возможной причиной низкого PPV для пограничных опухолей в настоящем исследовании может быть недостаточное количество пограничных опухолей. PPV и NPV напрямую связаны с распространенностью заболевания. В двух случаях гиподиагностики было проведено нерадикальное хирургическое вмешательство, в связи с чем была выполнена повторная операция в объеме экстирпации матки с придатками, оментэктомии, тазовой и поясничной лимфаденэктомии (серозная папиллярная цистаденокарцинома с низким потенциалом злокачественности (LGSC)). Учитывая молодой возраст пациенток, у которых доброкачественные опухоли были определены как пограничные, объем операции был ультраконсервативным, что позволило сохранить пациенткам фертильность и избежать излишне обширной операции. А также в случае, когда серозная пограничная цистаденома была неверно диагностирована как серозная цистаденокарцинома с высоким злокачественным потенциалом (HGSC), была выполнена органосохранная операция в связи с категорическим отказом пациентки (28 лет, нереализованная репродуктивная функция) от радикальной операции на первом этапе (выполнение радикального вмешательства после получения планового гистологического заключения). В этом случае гипердиагностика имела бы серьезные терапевтические последствия для молодой пациентки. Ни одной пациентке не было проведено необоснованное химиотерапевтическое лечение по данным СИМД, критерием назначения специфического лечения является результат планового гистологического исследования.
РЯ является гетерогенным заболеванием и включает гистологические подтипы (гистотипы), которые отличаются по своему клеточному происхождению, патогенезу, молекулярно-генетическим особенностям и прогнозу. Злокачественные опухоли яичников, или карциномы, состоят из пяти основных гистотипов: серозные карциномы высокой степени злокачественности (HGSOC; 70%), эндометриоидные (ENOC; 10%), светлоклеточные (CCOC; 10%), муцинозные (MOC; 3%) и серозные карциномы низкой степени злокачественности (LGSOC; <5%). Внутри каждого из этих подтипов, чаще всего среди серозных и муцинозных, имеются опухоли с неопределенным злокачественным потенциалом, известные как пограничные опухоли или опухоли с низким злокачественным потенциалом, которые содержат микроскопические признаки злокачественного новообразования без инвазии в подлежащую строму.
Клеточное происхождение и патогенез РЯ не совсем ясны. Морфологические и генетические исследования породили весомую гипотезу об экстраовариальном происхождении рака яичников, согласно которой серозные опухоли происходят из эпителия маточной трубы (напрямую или опосредованно через эндосальпингиоз), эндометриоидные и светлоклеточные являются производными эндометрия (опосредованно через эндометриоз), а муцинозные и переходноклеточные предположительно связаны с зачатками переходного эпителия в области брыжейки маточной трубы.
Среди серозных раков в настоящее время выделяют два основных типа – высокодифференцированная серозная карцинома яичника (high-grade serous ovarian carcinoma, HGSOC) и низкодифференцированная серозная карцинома яичника (low-grade serous ovarian carcinoma, LGSOC). Помимо различных гистологической и молекулярно-генетической характеристик, эти два варианта, как полагают, имеют и различные источники происхождения, и различный патогенез.
В настоящее время основным источником развития HGSOC считается эпителий маточной трубы. Скорее всего, данный тип инклюзионных кист формируется при имплантации эпителия маточной трубы на поверхность яичника, и в таких кистах могут протекать все последовательные этапы патогенеза серозной трубной интраэпителиальной карциномы (serous tubal intraepithelial carcinoma, STIC). Соответственно, при отсутствии STIC у женщин с HGSOC или первичной серозной карциномой брюшины можно предположить, что инициация данного процесса произошла не на территории маточной трубы, а уже на территории яичника (в инклюзионной кисте), хотя предшественником патологического процесса в данном случае все равно выступит эпителий маточной трубы.
Нельзя не отметить и тот факт, что ряд HGSOC, как полагают некоторые исследователи, развивается из LGSOC, однако механизм данной трансформации до конца не изучен. Полностью нельзя исключить происхождение HGSOC из поверхностного эпителия яичника, особенно в области трубно-яичниковых и трубно-перитонеальных переходных зон.
Современные представления о патогенезе LGSOC заключаются в последовательной трансформации эпителия инклюзионных кист с мюллеровым фенотипом в серозные цистаденомы, серозных цистаденом – в серозные пограничные опухоли, последних – в неинвазивные LGSOC с дальнейшим развитием LGSOC.
В нашем исследовании предпринята попытка определения гистотипа опухоли на этапе срочного морфологического исследования. Исследовались 65 образцов новообразований яичников. Полученные результаты, представленные в таблице 3, продемонстрировали высокую диагностическую значимость в постановке интраоперационного диагноза в случаях высокодифференцированного и низкодифференцированного рака яичников, однако являлись недостаточно перспективными в дифференциальной диагностике эндометриоидных и светлоклеточных вариантов опухолей. Некоторые серозные и эндометриоидные карциномы высокой степени злокачественности чрезвычайно трудно, а иногда и невозможно дифференцировать при срочном гистологическом исследовании. Более того, трудность дифференциальной диагностики сохраняется и при исследовании плановых срезов, во многих случаях требуется дополнительное иммуногистохимическое исследование. Проблема срочной дифференциальной диагностики касается серозных пограничных опухолей и серозных карцином низкой степени злокачественности, так как определяющим в постановке этих диагнозов является наличие микроинвазивного компонента опухоли, который порой может быть выявлен только в рамках планового исследования. И если в случаях дифференциальной диагностики серозных, светлоклеточных и эндометриоидных карцином высокой степени злокачественности в большинстве случаев определение гистотипа не имеет принципиального значения (достаточно информации о том, что опухоль имеет высокую степень злокачественности), то в случае дифференциальной диагностики серозных пограничных опухолей и серозных карцином низкой степени злокачественности ответ гистолога в рамках срочного исследования может определить тактику оперативного лечения. Поэтому улучшение качества криостатных срезов и модификация алгоритмов срочного диагностического исследования играют важнейшую роль.

Заключение
СИМД продемонстрировала высокую чувствительность, специфичность и NPV для доброкачественных и злокачественных новообразований яичника. Было обнаружено, что методика исследования криостатных срезов является точным и полезным методом интраоперационной оценки новообразований яичников. Результаты помогают определить тип и объем оперативного вмешательства. Особого внимания заслуживают пограничные опухоли, карциномы яичников с низким потенциалом злокачественности и муцинозные опухоли яичников. Вероятность гипердиагностики и ограничения СИМД должны обсуждаться с молодыми пациентками до операции, которая может ошибочно привести к потере фертильности. Выбор верной хирургической тактики у онкогинекологических больных репродуктивного возраста значительно влияет не только на успех противоопухолевого лечения, но и на продолжительность и качество жизни пациенток. Применение органосохраняющих операций в тех случаях, когда это позволяет клиническая ситуация, поможет сохранить сексуальную и репродуктивную функции. Информированные согласия должны включать все возможные варианты, учитывающие интраоперационные результаты СИМД. И наконец, интраоперационное общение между хирургами и патологами имеет исключительно важное значение и позволяет существенно минимизировать ошибки.



