Многоплодная монохориальная беременность относится к беременности высокого риска за счет повышенной частоты развития материнских и плодовых осложнений различной степени тяжести, неблагоприятно влияющих на акушерские и перинатальные исходы [1].
Наиболее частым (до 25% случаев) осложнением монохориального многоплодия является синдром селективной задержки роста плода (ССЗРП) [2], основным этиологическим фактором развития которого является неравномерное разделение плацентарной площадки между близнецами, а также наличие сосудистых анастомозов плаценты. Вторым по частоте встречаемости осложнением (8–15% случаев) является фето-фетальный трансфузионный синдром (ФФТС), развивающийся в результате несбалансированного шунтирования межблизнецового кровотока через анастомозы плаценты [3].
По данным ряда исследований, объем плацентарной площадки напрямую коррелирует с массо-ростовыми показателями новорожденных [4–6], а наличие сосудистых анастомозов является одним из субстратов развития специфических осложнений монохориального многоплодия [7–9]. Основные предпосылки нарушений в системе плод-плацента закладываются в ранние сроки беременности в момент инвазии трофобласта и обусловлены особенностями васкуло- и ангиогенеза как в маточно-плацентарном, так и в фето-плацентарном русле.
Неблагоприятный перинатальный исход осложненной монохориальной беременности является основной детерминантой поиска специфических предикторов акушерских неудач. В аспекте разбираемой проблемы научно-практический интерес представляет изучение факторов васкуло- и ангиогенеза при ССЗРП и ФФТС, которые, являясь этиологическими факторами, могут служить своеобразными инструментами мониторинга тяжести состояния плодов и основанием для принятия решения о проведении внутриутробного вмешательства или досрочного родоразрешения.
ССЗРП и ФФТС характеризуются угнетением процессов ангиогенеза, однако в литературе отсутствуют данные об особенностях васкулогенеза при монохориальном типе плацентации.
Согласно данным литературы, антиангиогенный фактор – растворимая fms-подобная тироксиназа 1 (sFlt-1) снижает скорость инвазии цитотрофобласта. Увеличение экспрессии sFlt-1 приводит к ассоциированному уменьшению синтеза плацентарного фактора роста (PlGF) и изменению синтеза cосудисто-эндотелиального фактора роста (VEGF), что является одним из наиболее ярких признаков нарушения баланса продукции эндотелиальных факторов роста [7]. Стоит отметить, что основными функциями VEGF является стабилизация эндотелиальных клеток сосудов, что особенно необходимо для поддержания функции эндотелия почек, печени и головного мозга. VEGF взаимодействует с двумя основными рецепторами: Flk-1 и Flt-1. Вариантом мембранно-связанного рецептора к VEGF (его часто обозначают VEGF-R1) является sFlt-1, который вызывает антиангиогенный эффект. Данный фактор секретируется в основном синцитиотрофобластом, связывает VEGF и PlGF и препятствует их взаимодействию с соответствующими рецепторами [8].
Ангиогенные и антиангиогенные факторы секретируются в материнский кровоток, причем в зависимости от гестационного срока отмечена количественная и качественная изменчивость показателей данных факторов. В исследовании Lyall F. et al. (1997) описано повышение секреции VEGF в организме матери при развитии гипоксии, вследствие чего можно предположить взаимосвязь выраженной гипоксемии с высокими концентрациями VEGF [9].
Другим важным аспектом является диагностическая значимость sVEGFR-1 в пуповинной крови. В исследованиях Kaufmann P. et al. (2004) доказано, что уровень sVEGFR-1 повышается как в начале, так и в конце II триместра беременности у пациенток с нормально протекающей многоплодной монохориальной беременностью [10]. У беременных с диагностированным ССЗРП значения sVEGFR-1 значительно увеличивались только в конце II триместра. Уровни PlGF были значительно ниже в начале и в конце II триместра в обеих группах беременных. Уровень PlGF в пуповинной крови был значительно ниже у плода с меньшей массой тела. Кроме VEGF, важную роль в регуляции плацентации играет трансформирующий фактор роста β1 (TGF-β1), нарушение экспрессии которого может привести даже к потере беременности [11, 12]. TGF-β1 участвует в процессах ангиогенеза, имплантации и дифференциации цитотрофобласта; в том числе одной из его функций является изменение метаболизма L-аргинина, что нарушает генерацию оксида азота, а также опосредованно инициирует структурные изменения сосудистой стенки.
В исследовании Wang X.-H. et al. показана взаимосвязь фактора, индуцируемого гипоксией (HIF), с преэклампсией и задержкой роста плода. Инвазия и пролиферация трофобласта критически регулируются кислородом, а низкий уровень кислорода направляет дифференцировку стволовых клеток трофобласта к фенотипам, которые зависят от сигнальных путей HIF [13].
Многочисленными исследованиями описано развитие задержки роста плода при дисбалансе в концентрации ангиопоэтина 1 и 2. Gunatillake T. et al. описали индукцию преждевременного созревания капилляров терминальных ворсин посредством увеличения концентрации ангиопоэтина 1 (ANGPT1) и снижения концентрации ангиопоэтина 2 (ANGPT2), приводящих к формированию преэклампсии и задержке роста плода [14].
Сравнительная характеристика показателей про- и антиангиогенных факторов при осложненной многоплодной беременности позволит усовершенствовать алгоритм обследования и ведения беременных с многоплодием с целью улучшения перинатальных исходов и снижения рисков развития тяжелых перинатальных и неонатальных осложнений.
Цель исследования: изучение прогностической роли сосудисто-эндотелиальных факторов роста в перинатальных исходах, неонатальной заболеваемости и смертности при монохориальной многоплодной беременности, осложненной ФФТС и ССЗРП.
Материалы и методы
Было проведено проспективное исследование на базе ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России в период с января 2020 г. по декабрь 2021 г. Проведены анализ течения беременности 84 женщин с монохориальной диамниотической двойней и их 152 новорожденных, родившихся живыми, изучение факторов васкуло- и ангиогенеза в зависимости от развития специфических осложнений. 1-ю группу составили пациентки с ФФТС (n=33), 2-ю группу – с ССЗРП (n=31), 3-ю группу – с неосложненным течением монохориальной двойни (n=20).
Критерии включения: монохориальная диамниотическая двойня, наличие двух живых плодов.
Критерии невключения: монохориальная моноамниотическая двойня, дихориальная диамниотическая двойня, многоплодная беременность высшего порядка (тройни, четверни).
Диагностика ФФТС основывалась на следующих эхографических критериях – выявлении маловодия плода-донора (максимальный вертикальный карман (МВК) менее 2 см) и многоводия плода-реципиента (МВК более 8–10 см). Оценка степени тяжести ФФТС проводилась согласно классификации, предложенной Quintero R. et al. (1999) [15].
Диагностика ССЗРП основывалась на данных ультразвукового исследования: предполагаемая масса одного из плодов менее 10-го перцентиля, разница предполагаемой массы плодов более 25%, нарушение кровотока в артерии пуповины, венозном протоке плода с задержкой роста.
Содержание указанных ниже маркеров в плазме периферической крови определяли методом твердофазного иммуноферментного анализа с использованием следующих тест-систем: ANGPT2 (RayBiotech), HIF1α (RayBiotech), VEGF-С (Invitrogen), растворимый рецептор васкулоэндотелиального фактора роста (sVEGF-R1) (Invitrogen), TGF-β1 (Invitrogen). Учет результатов производили на планшетном спектрофотометре Infinite F50 (TECAN).
Статистический анализ
Статистическая обработка полученных данных выполнялась с использованием Microsoft Excel и статистического программного обеспечения IBM SPSS Statistics Standard Edition 23.0. Результаты были представлены как среднее значение и стандартное отклонение M (SD) для данных с нормальным распределением. Для описания количественных данных, отличных от нормального распределения, оценивались медианы (Me) и значения интерквартильного интервала (Q1; Q3). Нормальность распределения оценена по критерию Колмогорова–Смирнова.
Для сравнения двух независимых непараметрических выборок применялся критерий Манна–Уитни. Категориальные данные описывались с указанием абсолютных значений и процентных долей. Сравнение трех групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью критерия Краскела–Уоллиса. Качественные переменные сравнивались с помощью теста χ2 (хи-квадрат, анализ таблиц сопряженности) и знакового критерия Уилкоксона. Результаты расценивались как достоверные при уровне p<0,05.
Прогностический диагностический потенциал факторов роста в вероятности рождения новорожденных с нормальной массой тела оценивался на основании ROC-анализа (позволяющего оценить диагностическую эффективность прогностической модели) с определением площади под кривой (AUC), а также с определением его специфичности и чувствительности.
Исследование было одобрено комиссией по этике ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
Результаты
Нами отмечено более позднее родоразрешение при неосложненном течении беременности (3-я группа) – 36,2 недели (35,85; 36,5), в сравнении с 1-й группой – 32,2 (28,4; 34,1) и 2-й группой – 32,4 (31,45; 34,8) недели (р<0,001) (табл. 1).

Анализ влияния факторов васкуло- и ангиогенеза на жизнеспособность новорожденных не показал диагностически значимых различий (табл. 2). Однако для неонатальной смертности характерно повышение в крови матери VEGF-R1, VEGF-C и HIF-1a. При мертворождаемости диагностировалась высокая концентрация HIF-1a.
Среди выживших новорожденных 86/140 (61,4%) были с нормальной массой тела и 54/140 (38,6%) – с задержкой роста ниже 3-й процентили.
При оценке вероятности рождения новорожденных с низкой массой тела от уровня TGF-β1 – 468,92 пг/мл, VEGF-C – 0,69 нг/мл и HIF-1a – 0,19 нг/мл в плазме крови матери во время беременности с помощью ROC-анализа не было получено статистически значимых моделей (p=0,084, p=0,549 и p=0,758 соответственно).
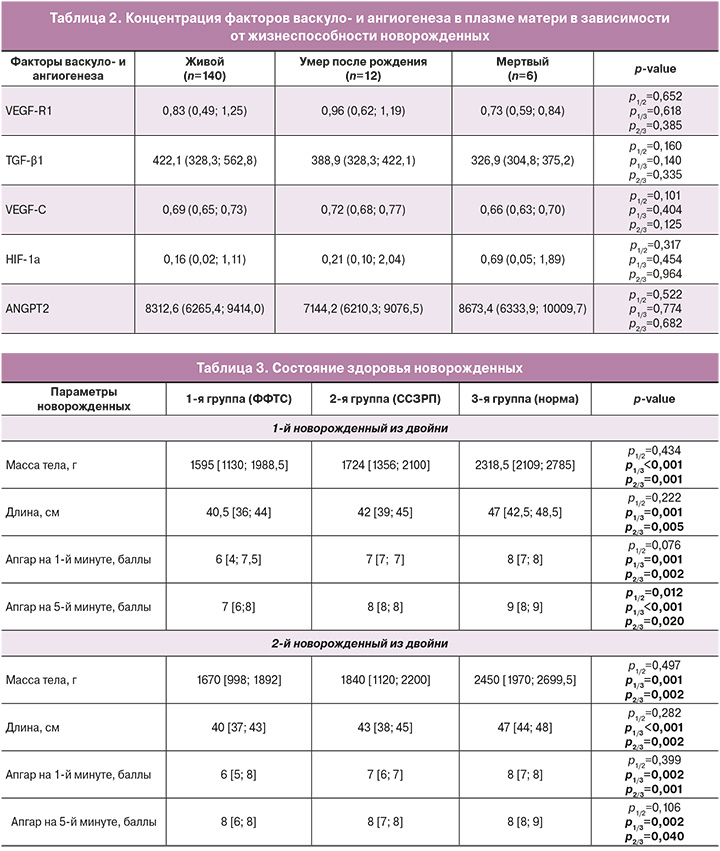
При оценке вероятности рождения новорожденных с низкой массой тела от уровня VEGF-R1 в плазме крови матери во время беременности с помощью ROC-анализа были получены следующие результаты (рис. 1).
Площадь под ROC-кривой составила 0,602±0,051 c 95% ДИ: 0,502–0,702. Прогностическая модель была статистически значимой (p=0,042).
Пороговое значение VEGF-R в точке cut-off составляло 0,787. У пациентов с VEGF-R более 0,787 нг/мл предполагалась высокая вероятность рождения новорожденных с низкой массой тела. Чувствительность и специфичность метода составили 66,7 и 51,2% соответственно.
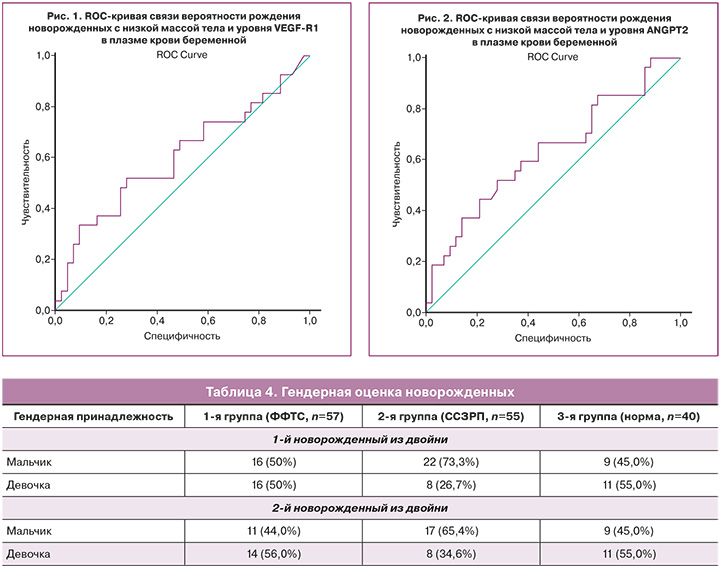
При оценке вероятности рождения новорожденных с низкой массой тела от уровня ANGPT2 в плазме крови матери во время беременности с помощью ROC-анализа были получены следующие результаты (рис. 2).
Площадь под ROC-кривой составила 0,632±0,049 c 95% ДИ: 0,535–0,728. Прогностическая модель была статистически значимой (p=0,009).
Пороговое значение ANGPT2 в точке cut-off составляло 8255,91. У пациентов с ANGPT2 более 8255,91 нг/мл предполагалась высокая вероятность рождения новорожденных с низкой массой тела. Чувствительность и специфичность метода составили 66,7 и 55,8% соответственно.
В таблице 3 представлено состояние здоровья новорожденных в группах наблюдения. При изучении массо-ростовых показателей были выявлены статистически значимые различия, что обусловлено более ранними сроками родоразрешения пациенток 1-й и 2-й групп. Оценка состояния новорожденных по шкале Апгар была также значительно ниже у новорожденных из этих групп, что связано с более высокой степенью недоношенности и высокой заболеваемостью.
Количество рожденных мальчиков и девочек статистически в группах не различалось (табл. 4).
Заболеваемость новорожденных при монохориальном многоплодии представлена в таблице 5. Здоровые дети наблюдались достоверно чаще в группе сравнения, что обусловлено сроком их родоразрешения. Обращает внимание высокая частота заболеваний бронхолегочной системы в группе ФФТС и ССЗРП, что главным образом связано со степенью недоношенности. Респираторный дистресс-синдром, врожденная пневмония, бронхолегочная дисплазия достоверно чаще встречались в 1-й и 2-й группах, транзиторное тахипноэ новорожденных – в 3-й группе.
При оценке перинатальных поражений центральной нервной системы (ЦНС) были отмечены внутрижелудочковое кровоизлияние I–II степени первого плода (плод-реципиент в группе ФФТС, плод с нормальной массой в группе ССЗРП) во всех группах (в 1-й группе – 53,3%, во 2-й группе – 44,8%, в 3-й группе – 30%, p=0,0105), а также проявления церебральной ишемии, которая значимо чаще была диагностирована в 1-й и 2-й группах (16,67 и 3,57%, p<0,0001). Поражения ЦНС второго плода (плод-донор в группе ФФТС, плод с меньшей массой тела в группе ССЗРП) достоверно чаще регистрировались в 1-й и 2-й группах (в 1-й группе – 70,8%, во 2-й – 56%, в 3-й – 25%, p=0,009). Такие тяжелые поражения ЦНС, как внутрижелудочковое кровоизлияние III–IV степени, перивентрикулярная лейкомаляция наблюдались у новорожденных только из группы ФФТС.
Анализ сердечно-сосудистой системы новорожденных показал, что врожденные пороки сердца первого плода (плод-реципиент в группе ФФТС, плод с нормальной массой в группе ССЗРП) были диагностированы значимо чаще в сравнении с неосложненной монохориальной двойней – 46,7, 63,3, 15% соответственно, р=0,003. Сравнение аномалий сердечно-сосудистой системы второго плода (плод-донор в группе ФФТС, плод с меньшей массой тела в группе ССЗРП) не показало статистически значимых различий. Данные изменения, вероятно, обусловлены неравномерным сбросом крови от одного плода к другому в группе осложненных монохориальных двоен.
При изучении патологии желудочно-кишечного тракта (ЖКТ) новорожденных было выявлено, что внутриутробный перитонит и некротизирующий энтероколит обоих новорожденных значимо чаще были диагностированы в 1-й и 2-й группах. Клинические проявления кишечной непроходимости в группе сравнения не выявлены, а в 1-й и 2-й группах составили 2,15 и 1,5% соответственно, что было статистически не значимо, p=0,0553. Высокая частота заболеваний ЖКТ, вероятно, обусловлена особенностями внутриутробного кровоснабжения и высокой степенью недоношенности новорожденных из 1-й и 2-й групп.
Анализ раннего неонатального периода показал достоверно значимое различие в пребывании в отделении реанимации и интенсивной терапии новорожденных (ОРИТН) из 1-й и 2-й групп, p<0,0001. Время нахождения детей в неонатальных отделениях было достоверно выше в группах осложненной двойни, что обусловлено степенью недоношенности и высокой заболеваемостью.
Обсуждение
Поиску молекулярных детерминант развития осложнений монохориальной многоплодной беременности с целью своевременной профилактики и улучшения перинатальных исходов посвящены исследования последних лет. Исследователями была определена разнонаправленность особенностей секреции факторов ангио- и васкулогенеза при осложненной монохориальной многоплодной беременности [16, 17]. Нами было показано, что повышение в крови матери уровней VEGF-R1, VEGF-C и HIF-1a повышает риск ранней неонатальной смертности, а значительное увеличение концентрации HIF-1a может приводить к мертворождаемости.
Известно, что sVEGF-R1 является негативным регулятором ангиогенеза, сдерживающим избыточное формирование кровеносных сосудов. Ангиогенный VEGF-C фактор способствует формированию анастомозов между плодами [11]. Ввиду дисбаланса данных факторов нарушается процесс васкуло- и ангиогенеза плаценты, приводящих к формированию специфических осложнений монохориального многоплодия. В отсутствие своевременного лечения или при неверно выбранной тактике ведения пациенток увеличиваются неонатальная заболеваемость и смертность.
HIF-1a является субъединицей гетеродимерного фактора транскрипции, индуцируемого при гипоксии [18]. При несбалансированном токе крови между плодами, развитии ФФТС и ССЗРП уровень данного белка повышается, увеличивая мертворождаемость. Изменение концентрации VEGF-R1 и ANGPT2 в крови матери увеличивает риск рождения плода с задержкой роста.
Анализ течения раннего неонатального периода показал высокую заболеваемость органов дыхания, сердечно-сосудистой системы и органов ЖКТ у новорожденных из группы ФФТС и ССЗРП. Вероятно, это связано с недоношенностью, а также с испытываемыми внутриутробно дефицитами. Так, ввиду неравномерного тока крови в монохориальной плаценте в кровеносном русле одного плода происходит увеличение объема циркулирующей крови, а у другого плода – уменьшение. Такое перераспределение крови ведет к снижению сердечного выброса плода, что при длительном течении и прогрессировании основного заболевания способствует формированию врожденных пороков сердца плода, таких как атрезия легочной артерии, коарктация аорты, патологически влияет на гестационное развитие всех систем (ЦНС, ЖКТ).
Заключение
Современные представления о патогенезе осложнений монохориального многоплодия разнообразны; в то же время не выявлено специфичных маркеров развития ССЗРП и ФФТС, а главное – предикторов неблагоприятного перинатального исхода. Вместе с тем изучение факторов ангио- и васкулогенеза при этих наиболее часто встречающихся осложнениях монохориальной беременности двойней позволяет предположить их детерминирующую роль в формировании данных осложнений и наметить векторы научного поиска, направленного на повышение эффективности акушерского менеджмента, в том числе фетоскопических вмешательств.



