1) ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России, Москва, Россия;
2) ФГБУ «Научный медицинский исследовательский центр сердечно-сосудистой хирургии имени А.Н. Бакулева» Минздрава России, Москва, Россия;
3) ФГАОУ ВО «Российский университет дружбы народов имени Патриса Лумумбы», Москва, Россия
Актуальность: Ведение многоплодной монохориальной беременности с аномалиями развития у одного из плодов представляет собой клиническую и этическую дилемму, поскольку как при выжидательной тактике, так и при проведении селективного фетоцида существует риск преждевременного рождения и перинатальной гибели второго близнеца. Оптимизировать тактику ведения беременной и новорожденных в таких случаях помогают современные молекулярно-генетические методы. Мы представляем наблюдение ведения многоплодной беременности: монозиготой двойни, дискордантной по множественным аномалиям развития.
Описание: Повторнобеременная пациентка 40 лет обратилась в сроке 17 недель беременности на перинатальный консилиум ФГБУ «НМИЦ АГП им. академика В.И. Кулакова» Минздрава России для определения тактики ведения монохориальной двойни с омфалоцеле больших размеров и деформацией позвоночника у одного из плодов.
На первом этапе обследования пациентке был проведен раздельный амниоцентез, у обоих плодов выявлен нормальный женский молекулярный кариотип arr(1-22,X)х2. Дополнительно по ДНК амниотической жидкости обоих плодов были исключены нарушения метилирования участков IC1 (H19) и IC2 (KCNQ1OT1) критического региона хромосомы 11, ассоциированного с синдромом Беквита–Видемана. Монозиготность была подтверждена по совпадению образцов первого и второго плода по пяти маркерам на каждой из 22 пар аутосом. Учитывая нормальный результат генетического обследования обоих плодов и потенциальные риски перинатальных осложнений при проведении внутриутробного вмешательства, от селективного фетоцида пациентка отказалась.
В связи с повторным нарастанием многоводия и нулевыми диастолическими кровотоками в артериях пуповины по данным УЗ-допплеровского исследования в сроке 33 недели 5 дней проведено оперативное родоразрешение. Первая здоровая девочка родилась массой тела 2140 г, с оценкой состояния по шкале Апгар 7–8 баллов, выписана домой в удовлетворительном состоянии в возрасте 12 суток жизни. Вторая девочка с множественными аномалиями развития родилась массой тела 1760 г, с оценкой состояния по шкале Апгар 5–6 баллов, умерла в возрасте 2 суток 2 ч вследствие полиорганной недостаточности.
Постнатально у обоих детей выявлен нормальный женский кариотип (46,ХХ), проведено полноэкзомное секвенирование патогенных и вероятно патогенных вариантов, ассоциированных с фенотипом. Подтверждена монозиготность близнецов, случайных находок не обнаружено.
Заключение: В представленном нами наблюдении продемонстрированы принципы современной анте- и перинатальной мультидисциплинарной тактики для многоплодных беременностей с дискордантностью по структурным мальформациям плодов.
Вклад авторов: Ходжаева З.С., Сакало В.А., Большакова А.С., Ярыгина Т.А. – концепция; Сакало В.А., Гладкова К.А., Большакова А.С., Барков И.Ю. – сбор и обработка материала; Большакова А.С., Ярыгина Т.А., Сакало В.А. –
написание текста; Ходжаева З.С., Саделов И.О. – редактирование.
Конфликт интересов: Авторы заявляют об отсутствии конфликта интересов.
Финансирование: Работа выполнена в рамках Государственного задания МЗ РФ № 121040600434-3 «Молекулярно-биологические детерминанты формирования осложнений многоплодной беременности: патогенетические подходы к профилактике и лечению».
Одобрение Этического комитета: ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России.
Согласие пациентов на публикацию: Пациентка подписала информированное согласие на проведение генетических исследований во время беременности, согласие на обследование детей и публикацию данного клинического наблюдения.
Для цитирования: Большакова А.С., Ярыгина Т.А., Сакало В.А., Гладкова К.А.,
Барков И.Ю., Саделов И.О., Ходжаева З.С. Наблюдение монозиготной двойни, дискордантной по множественным аномалиям развития.
Акушерство и гинекология. 2023; 12: 205-212
https://dx.doi.org/10.18565/aig.2023.286
монохориальная беременность
монозиготная двойня
дискордантность
пороки развития
омфалоцеле
зиготность
селективный фетоцид
хромосомный микроматричный анализ (ХМА)
полноэкзомное секвенирование
Поиск путей совершенствования качества медицинской помощи пациенткам с многоплодием не теряет своей актуальности в связи с быстрым ростом числа подобных беременностей, достигшего в мире за последние десятилетия беспрецедентного уровня [1]. Беременность двойней составляет более 97% всех случаев многоплодия и представлена дизиготными (разнояйцевыми) близнецами в 60–70% либо монозиготными (однояйцевыми) близнецами в 20–30% случаев [2]. С 1980-х гг. глобальный показатель родов двойней увеличился на треть: с 9,1 до 12,0 случая на 1000 родов, что составляет около 1,6 млн пар близнецов каждый год [1, 3]. В основном столь быстрый рост обусловлен увеличением числа рождений дизиготных двоен в результате применения вспомогательных репродуктивных технологий (ВРТ) на фоне возрастания среднего возраста беременных до 30–39 лет [1, 3].
Несмотря на достижения перинатальной медицины последних лет, показатели недоношенности и неонатальной смертности при многоплодии многократно превышают таковые при беременности одним плодом [4], и многоплодие относится к факторам высокого риска мертворождения [5].
Считалось, что уровень рождаемости монозиготных близнецов относительно постоянен [6] и составляет 3,5–4 на 1000 беременностей [7, 8]; однако исследования последних лет продемонстрировали значимое увеличение случаев подобного типа многоплодия – до 16–17 случаев на 1000 беременностей, наступивших в результате экстракорпорального оплодотворения [9].
Хориальность является важнейшим фактором для стратификации риска неблагоприятного исхода при беременности двойней: перинатальная заболеваемость и смертность многократно выше при монохориальном в сравнении с дихориальным типом плацентации [10].
За исключением крайне редких случаев дизиготных монохориальных двоен, зачастую также ассоциированных с ВРТ, дихориальность облигатна для дизиготных двоен; однако нельзя забывать, что до 25% монозиготных двоен также будут иметь две отдельные плаценты, а 75% – одну общую [11–13].
В рутинной клинической практике основным методом определения типа хориальности (но не зиготности) является ультразвуковая диагностика [14].
Однако необходимо помнить, что ошибки в ультразвуковой диагностике монохориальной беременности, обусловленные как недостаточным опытом специалиста, так и объективными затруднениями визуализации, особенностями расположения плаценты и межплодных амниотических мембран, могут достигать 19%, в особенности если исследование проводится в сроках более 14 недель гестации [15, 16].
Ошибочное отнесение монохориальной двойни к дихориальному типу может привести к запоздалой диагностике и, соответственно, лечению осложнений, ассоциированных с монохориальностью. И напротив, диагностика монохориального типа плацентации в случаях наличия двух плацент приводит к необоснованному, как минимум двукратному, увеличению числа проводимых исследований, повышению уровня стресса родителей, увеличению затрат здравоохранения, потенциальной ошибочной диагностике осложнений и риску ятрогенных вмешательств [14, 17].
Для максимально точного установления зиготности близнецов в последние годы активно изучаются неинвазивные генетические методы, имеющие высокую чувствительность и специфичность [16–19]. В нашем клиническом наблюдении на пренатальном этапе использовалось сравнение данных хромосомного микроматричного анализа (ХМА) по амниотической жидкости обоих плодов, а постнатально проводилось сравнение данных полноэкзомного секвенирования по крови новорожденных, что позволило с абсолютной точностью установить факт монозиготности.
Особенный интерес в точном установлении хориальности и зиготности возникает в случаях дискордантных структурных аномалий, частота которых достигает 6–8% при монохориальном и 1–2% при дихориальном типе плацентации [4].
Ведение многоплодной монохориальной беременности с аномалиями развития у одного из плодов представляет собой клиническую и этическую дилемму [20], поскольку как при выжидательной тактике, так и при проведении селективного фетоцида существует риск преждевременного рождения и перинатальной гибели второго близнеца [4, 21, 22].
Более того, необходимо помнить о важности генетического обследования каждого из плодов даже при установлении монозиготности двойни. Ранее считалось, что монозиготные близнецы фенотипически и генетически идентичны, однако опубликовано немало случаев дискордантности [4, 21–24], для объяснения которой существуют несколько теорий: хромосомный мозаицизм, постзиготические мутации, неравновесная инактивация хромосомы Х, другие эпигенетические механизмы, а также внешние факторы [25, 26].
Современные молекулярно-генетические методы: ХМА, полноэкзомное секвенирование, анализ метилирования и другие, внедренные в клиническую практику ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России (далее – Центр), позволяют провести полноценный диагностической поиск для большинства случаев врожденных аномалий при одноплодной и многоплодной беременности, установить генетическую причину дискордантности при ее наличии, оптимизировать тактику ведения беременной и новорожденных [27–36].
Мы представляем наблюдение ведения многоплодной беременности: монозиготой двойни, дискордантной по множественным аномалиям развития.
Клиническое наблюдение
Пациентка 40 лет обратилась на перинатальный консилиум Центра для определения тактики ведения многоплодной беременности с дискордантностью по структурным мальформациям плодов.
Семейный и соматический анамнез пациентки были не отягощены; акушерско-гинекологический анамнез отягощен двумя медицинскими абортами в I триместре беременности, проведенными по желанию пациентки. Две желанные беременности завершились физиологическим рождением здоровых детей мужского и женского пола. Данная беременность пятая, наступила в результате естественного зачатия. При проведении ультразвукового исследования в рамках раннего пренатального скрининга по месту амбулаторного наблюдения пациентки выявлен врожденный порок развития передней брюшной стенки у одного из плодов монохориальной диамниотической двойни.
При исследовании в сроке 16 недель 6 дней в Центре подтвержден предполагаемый тип многоплодия: монохориальная диамниотическая двойня и отсутствие ультразвуковых признаков патологии у первого плода; у второго плода диагностированы омфалоцеле больших размеров, содержащее петли кишечника и печень, деформация позвоночника (рис. 1, 2).
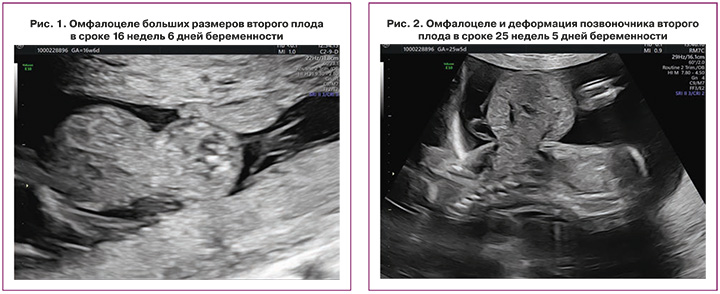
С учетом частоты ассоциации данного типа мальформации с генетической патологией на первом этапе обследования пациентке было предложено проведение инвазивной диагностики и получено ее согласие [37].
В сроке 17 недель 4 дня проведен раздельный амниоцентез и проведено молекулярное кариотипирование (ХМА). ДНК плодов была получена из 35 мл амниотической жидкости с помощью набора IGENatal kit. Исследование выполняли с использованием системы GenoScan 3000 на SNP (Single Nucleotide Polymorphism) микроматрицах CytoScan Optima (Thermo Fisher Scientific, США) согласно протоколу производителя. Анализ полученных данных производился с помощью программного обеспечения ChАS (Сhromosome Аnalysis Suite), опираясь на критерии Американского колледжа медицинских генетиков (American College of Medical Genetics) [33]. У плодов выявлен нормальный женский молекулярный кариотип arr(1-22,X)х2.
С целью уточнения зиготности проведено сопоставление образцов первого и второго плода по пяти SNP-маркерам на каждой из 22 пар аутосом; обнаружено совпадение маркеров, что позволило сделать вывод о монозиготности близнецов. Дополнительно по ДНК амниотической жидкости обоих плодов проведен анализ нарушений метилирования участков IC1 (H19) и IC2 (KCNQ1OT1) критического региона хромосомы 11, ассоциированных с синдромом Беквита–Видемана, так как к характерным признакам данного синдрома относится омфалоцеле [37]. Нарушения метилирования обнаружены не были.
На повторном перинатальном консилиуме диагностировано омфалоцеле второго плода в сочетании с деформацией позвоночника (рис. 2). Специалистами медицины плода, акушерами-гинекологами и неонатальными хирургами пациентка была предупреждена о неблагоприятном прогнозе для жизни у второго плода в связи с наличием омфалоцеле больших размеров [37], проинформирована о возможности проведения селективного фетоцида [4, 21], а также риске прерывания беременности, преждевременных родов, низкой массы тела анатомически нормального близнеца при рождении и его перинатальной смертности как при выжидательной тактике [22], так и при внутриутробном вмешательстве [4, 21].
Учитывая нормальный результат генетического обследования обоих плодов и потенциальные риски перинатальных осложнений при проведении внутриутробного вмешательства, от селективного фетоцида пациентка отказалась, продолжив динамическое наблюдение за развитием близнецов согласно протоколу клинической рекомендации «Многоплодная беременность» (2021) [38].
За время антенатального мониторинга ультразвуковых признаков осложнений, ассоциированных с монохориальностью [39], выявлено не было.
Однако после 28 недель развилась гипоплазия дуги и перешейка аорты у второго плода, а также произошло нарастание многоводия в данной амниотической полости, в связи с чем в сроке 30 недель 4 дня в стационарных условиях проведен амниоцентез с амниоредукцией – удалено 3000 мл амниотической жидкости, что позволило пролонгировать беременность. В связи с повторным нарастанием многоводия второго плода с омфалоцеле больших размеров в 33 недели 5 дней проведено оперативное родоразрешение. Первая здоровая девочка массой тела 2140 г и длиной тела 43 см родилась в удовлетворительном состоянии, с оценкой по шкале Апгар 7–8 баллов. Вторая девочка с множественными аномалиями развития массой тела 1760 г и длиной тела 41 см родилась в состоянии средней степени тяжести, с оценкой по шкале Апгар 5–6 баллов.
По клеткам периферической крови новорожденных проведен цитогенетический анализ на препаратах метафазных хромосом при использовании дифференциального окрашивания хромосом по длине (GTG), полученных путем культивирования in vitro лимфоцитов в соответствии со стандартной методикой. У обеих девочек выявлен нормальный женский кариотип (46, ХХ).
По ДНК крови обеих новорожденных проведено полноэкзомное секвенирование с целью поиска возможных моногенных причин множественных аномалий развития. ДНК из крови получена с помощью набора PREP-MB MAX DNA Extraction Kit. Секвенирование проводилось на платформе Illumina NovaSeq 6000 согласно протоколу производителя. Биоинформатический анализ проводился с использованием баз данных OMIM, ClinVar, LOVD, Genome Aggregation Database (gnomAD), собственной внутренней базы данных и других литературных источников, опираясь на рекомендации, разработанные ACMG, и российское руководство по интерпретации данных, полученных методом NGS [31, 32].
Патогенных и вероятно патогенных вариантов, ассоциированных с фенотипом, а также случайных находок (согласно списку генов ACMG) не обнаружено.
Для постнатального подтверждения монозиготности по данным высокопроизводительного секвенирования проведен анализ крайне редких полиморфизмов (частота во внутренней базе Центра и в общепопуляционной базе данных gnomAD менее 0,1%). Оценивался как минимум один полиморфизм на каждой из 22 пар аутосом. У близнецов получено совпадение по всем таким вариантам.
Первая здоровая девочка была выписана домой в удовлетворительном состоянии в возрасте 12 суток жизни; на момент публикации ее психомоторное развитие соответствует постконцептуальному возрасту.
У второго ребенка в связи с отсутствием самостоятельного дыхания и брадикардией в родильном зале проводилась искусственная вентиляция легких, при поступлении в отделение реанимации и интенсивной терапии новорожденных введен сурфактант, подключена инсуффляция оксида азота, ужесточены параметры вентиляции; но, несмотря на проводимую терапию, в возрасте 2 суток 2 ч произошла гибель новорожденной вследствие полиорганной недостаточности.
При патологоанатомическом исследовании было подтверждено наличие основного заболевания – омфалоцеле с эвентрацией печени, селезенки, желудка, поджелудочной железы, петель тонкой и толстой кишки с червеобразным отростком, восходящей части поперечно-ободочной кишки; также обнаружена истинная левосторонняя диафрагмальная грыжа с эвентрацией верхнего полюса левого надпочечника в левую плевральную полость и правосторонний сколиоз позвоночника. Патологоанатомическое исследование плаценты и пуповины, со своей стороны, также подтвердило монохориальную диамниотическую плаценту, выявив в ее структуре замедленное созревание и множественные инфаркты ворсинчатого дерева, гиперизвитость обеих пуповин с краевым прикреплением второй пуповины.
Обсуждение
Беременность монохориальной двойней относится к группе высокого риска широчайшего спектра перинатальных осложнений, в том числе наличия структурных аномалий у обоих либо одного из близнецов [2, 4, 5, 9, 10, 21, 22]; в связи с чем является крайне важным прицельный поиск ранних признаков специфических осложнений монохориального многоплодия, маркеров синдромальной патологии и врожденных пороков развития при проведении ультразвукового исследования в рамках пренатального скрининга I триместра [38, 40].
Предполагается, что совершенствование методики антенатального исследования анатомии плода с применением режимов трехмерной реконструкции позволит увеличить детализацию изображений и, соответственно, точность диагностики, столь важной для формирования прогноза о возможности хирургической коррекции мальформаций [41, 42].
В представленном нами случае именно своевременная диагностика омфалоцеле предоставила время для проведения консультаций профильных специалистов, полного обследования до достижения сроков жизнеспособности, что позволило пациентке сделать осознанный выбор тактики ведения своей беременности.
При обнаружении во время беременности аномалий развития у одного из плодов при монохориальной двойне крайне важно проведение генетического обследования с целью выбора оптимальной тактики ведения беременности. На первом этапе целесообразно исключение хромосомной патологии, предпочтительнее с применением ХМА, не требующего длительного культивирования амниотической жидкости. ХМА разработан с целью обнаружения микроскопических и субмикроскопических вариаций числа копий в геноме [28, 43]. В методических рекомендациях и публикациях ХMA рекомендуется к проведению у пациентов с врожденными аномалиями развития, в том числе в пренатальной диагностике [29, 30, 33]. Выявление же моногенной патологии у плодов и новорожденных вошло в широкую клиническую практику с появлением технологии высокопроизводительного секвенирования [34]. Диагностическая ценность полноэкзомного секвенирования (т.е. анализа вариантов нуклеотидной последовательности белок-кодирующих участков генома) при аномалиях развития продемонстрирована многочисленными исследованиями [35, 36].
В нашем клиническом наблюдении у монозиготных дискордантных по структурным порокам близнецов исключена хромосомная патология, что дало возможность пролонгировать беременность в интересах анатомически здорового ребенка.
Омфалоцеле – врожденный порок развития, возникающий в результате дефекта закрытия вентральной стенки тела, частота которого в течение последних 40 лет наблюдений имеет тенденцию к значительному росту [44].
Точная этиология порока до конца не выяснена; помимо широкого спектра генетических аномалий [37], которые в представленном клиническом случае были исключены, омфалоцеле чаще встречается у молодых матерей либо беременных старшего репродуктивного возраста, к которому относилась наша пациентка. Кроме того, описана связь омфалоцеле с многоплодием, мальформациями прочих органов и систем плода, преждевременными родами [45, 46], что также соотносится с нашими данными.
Cao A., Monni G. [23] предполагают, что причиной некоторых аномалий, в том числе дефектов передней брюшной стенки, может служить неравномерное распределение бластомеров в момент разделения на два эмбриона и/или различное их прикрепление к плаценте.
В представленном случае неблагоприятный прогноз для жизни больного ребенка был обусловлен значительными размерами дефекта, вызвавшего эвентрацию большинства органов брюшной полости, в сочетании с аномалиями скелета и диафрагмальной грыжей, не диагностированной на антенатальном этапе за счет выраженного изменения топографии органов, и, напротив, минимальным смещением надпочечника в грудную полость. При этом риски проведения селективного фетоцида и пролонгирования беременности оценивались приблизительно как равные, с учетом монохориального типа плацентации у монозиготной двойни. Важным представляется подчеркнуть точность ультразвуковой диагностики хориальности, которая была подтверждена генетическими и патологоанатомическими исследованиями.
Заключение
Анализ клинического наблюдения показал, что возможности медицинской помощи, в том числе хирургии и реанимации новорожденных, по объективным причинам ограничены в клинических ситуациях со сложными анатомическими особенностями второго плода из двойни. Однако последовательность и полноценность мультидисциплинарной анте- и перинатальной помощи, включающей весь необходимый на современном уровне объем генетических исследований, помогли семейной паре получить всеобъемлющую информацию о прогнозе для каждого из детей, вариантах ведения беременности, существующих рисках, сделать осознанный выбор в пользу пролонгирования беременности, что сохранило жизнь и здоровье первой девочке-близнецу.
- Monden C., Pison G., Smits J. Twin Peaks: more twinning in humans than ever before. Hum Reprod. 2021 May 17;36(6):1666-1673.https://dx.doi.org/10.1093/humrep/deab029.
- Benn P., Rebarber A. Non-invasive prenatal testing in the management of twin pregnancies. Prenat. Diagn. 2021; 41(10): 1233-40. https://dx.doi.org/10.1002/pd.5989.
- Hur Y.M. Changes in multiple birth rates and parental demographic factors in South Korea during the last four decades: 1981-2019. Twin Res. Hum. Genet. 2021; 24(3): 163-7. https://dx.doi.org/10.1017/thg.2021.23.
- Li N., Sun J., Wang J., Jian W., Lu J., Miao Y. et al. Selective termination of the fetus in multiple pregnancies using ultrasound-guided radiofrequency ablation. BMC Pregnancy Childbirth. 2021; 21(1): 821. https://dx.doi.org/10.1186/s12884-021-04285-4.
- Flenady V., Wojcieszek A.M., Middleton P., Ellwood D., Erwich J.J., Coory M. el al.; Lancet Ending Preventable Stillbirths study group; Lancet Stillbirths In High-Income Countries Investigator Group. Stillbirths: recall to action in high-income countries. Lancet. 2016; 387(10019): 691-702.https://dx.doi.org/10.1016/S0140-6736(15)01020-X.
- Bulmer M.G. Embryology, Human. Clarendon; 1970. 205 p.
- Hall J.G. Twinning. Lancet. 2003; 362(9385): 735-43.https://dx.doi.org/10.1016/S0140-6736(03)14237-7.
- Smits J., Monden C. Twinning across the developing world. PLoS One. 2011; 6(9): e25239. https://dx.doi.org/10.1371/journal.pone.0025239.
- Chen N., Li J., Li Y., Zhang Y., Li J., Gao J. et al. Risk factors associated with monozygotic twinning in offspring conceived by assisted reproductive technology. Hum. Reprod. Open. 2023; 2023(4): hoad035.https://dx.doi.org/10.1093/hropen/hoad035.
- Cheong-See F., Schuit E., Arroyo-Manzano D., Khalil A., Barrett J., Joseph K.S. et al.; Global Obstetrics Network (GONet) Collaboration. Prospective risk of stillbirth and neonatal complications in twin pregnancies: systematic review and meta-analysis. BMJ. 2016; 354: i4353. https://dx.doi.org/10.1136/bmj.i4353.
- Peters H.E., König T.E., Verhoeven M.O., Schats R., Mijatovic V., Ket J.C., Lambalk C.B. Unusual twinning resulting in chimerism: a systematic review on monochorionic dizygotic twins. Twin Res. Hum. Genet. 2017; 20(2): 161-8. https://dx.doi.org/10.1017/thg.2017.4.
- Trombetta G., Fabbro D., Demori E., Driul L., Damante G., Xodo S. Rare spontaneous monochorionic dizygotic twins: a case report and a systematic review. BMC Pregnancy Childbirth. 2022; 22(1): 564.https://dx.doi.org/10.1186/s12884-022-04866-x.
- Semrl N., Barth M., Feigl S., Hochstätter R., Oreskovic I., Fluhr H. et al. Birth of monozygotic dichorionic twins after a single blastocyst embryo transfer: a case report of genetic determination of zygosity. F S Rep. 2023; 4(2): 231-4.https://dx.doi.org/10.1016/j.xfre.2023.03.002.
- Khalil A., Rodgers M., Baschat A., Bhide A., Gratacos E., Hecher K. et al. ISUOG Practice Guidelines: role of ultrasound in twin pregnancy. Ultrasound Obstet. Gynecol. 2016; 47(2): 247-63. https://dx.doi.org/10.1002/uog.15821.
- Blumenfeld Y.J., Momirova V., Rouse D.J., Caritis S.N., Sciscione A., Peaceman A.M. et al.; Eunice Kennedy Shriver National Institute of Child Health and Human Development Maternal-Fetal Medicine Units Network. Accuracy of sonographic chorionicity classification in twin gestations. J. Ultrasound. Med. 2014; 33(12): 2187-92. https://dx.doi.org/10.7863/ultra.33.12.2187.
- Wojas A., Martin K.A., Koyen Malashevich A., Hashimoto K., Parmar S., White R. et al. Clinician-reported chorionicity and zygosity assignment using single-nucleotide polymorphism-based cell-free DNA: Lessons learned from 55,344 twin pregnancies. Prenat. Diagn. 2022; 42(10): 1235-41.https://dx.doi.org/10.1002/pd.6218.
- Baud D., Windrim R., Van Mieghem T., Keunen J., Seaward G., Ryan G. Twin-twin transfusion syndrome: a frequently missed diagnosis with important consequences. Ultrasound Obstet. Gynecol. 2014; 44(2): 205-9.https://dx.doi.org/10.1002/uog.13328.
- Wang Y., Qiu X., Chen S., Pan D., Hua R., Li S. et al. Noninvasive evaluation of fetal zygosity in twin pregnancies involving a binary analysis of single-nucleotide polymorphisms. J. Mol. Diagn. 2023; 25(9): 682-91.https://dx.doi.org/10.1016/j.jmoldx.2023.06.003.
- American College of Obstetricians and Gynecologists’ Committee on Practice Bulletins—Obstetrics; Committee on Genetics; Society for Maternal-Fetal Medicine. Screening for Fetal Chromosomal Abnormalities: ACOG Practice Bulletin, Number 226. Obstet. Gynecol. 2020; 136(4): e48-e69.https://dx.doi.org/10.1097/AOG.0000000000004084.
- Sebghati M., Khalil A. Reduction of multiple pregnancy: Counselling and techniques. Best Pract. Res. Clin. Obstet. Gynaecol. 2021; 70: 112-22.doi: 10.1016/j.bpobgyn.2020.06.013.
- Weber E.C., Strizek B., Recker F., Geipel A., Gembruch U., Berg C., Gottschalk I. Outcome of monochorionic pregnancies after selective feticide with bipolar cord coagulation: a German single center experience. J. Clin. Med. 2022; 11(6): 1516. doi: 10.3390/jcm11061516.
- Gul A., Cebeci A., Aslan H., Polat I., Sozen I., Ceylan Y. Perinatal outcomes of twin pregnancies discordant for major fetal anomalies. Fetal Diagn. Ther. 2005; 20(4): 244-8. https://dx.doi.org/10.1159/000085078.
- Cao A., Monni G. Phenotypic and genotypic discordance in monozygotic twins. In: Blickstein I., Keith L.G., eds. Multiple pregnancy: epidemiology, gestation and perinatal outcome: Taylor & Francis; 2005: 226-32.
- Rydzanicz M., Olszewski P., Kedra D., Davies H., Filipowicz N., Bruhn-Olszewska B. et al. Variable degree of mosaicism for tetrasomy 18p in phenotypically discordant monozygotic twins-diagnostic implications. Mol. Genet. Genomic. Med. 2021; 9(1): e1526. https://dx.doi.org/10.1002/mgg3.1526.
- Machin G. Non-identical monozygotic twins, intermediate twin types, zygosity testing, and the non-random nature of monozygotic twinning: a review. Am. J. Med. Genet. C. Semin. Med. Genet. 2009; 151C(2): 110-27.https://dx.doi.org/10.1002/ajmg.c.30212.
- Silva S., Martins Y., Matias A., Blickstein I. Why are monozygotic twins different? J. Perinat. Med. 2011; 39(2):195-202. doi: 10.1515/jpm.2010.140.
- Riggs E.R., Andersen E.F., Cherry A.M., Kantarci S., Kearney H., Patel A. et al. Technical standards for the interpretation and reporting of constitutional copy-number variants: a joint consensus recommendation of the American College of Medical Genetics and Genomics (ACMG) and the Clinical Genome Resource (ClinGen). Genet. Med. 2020; 22(2): 245-57. https://dx.doi.org/10.1038/s41436-019-0686-8.
- Faucett W.A., Savage M. Chromosomal microarray testing. JAAPA. 2012; 25(1): 65-6. https://dx.doi.org/10.1097/01720610-201201000-00016.
- Riggs E.R., Wain K.E., Riethmaier D., Smith-Packard B., Faucett W.A., Hoppman N. et al. Chromosomal microarray impacts clinical management. Clin. Genet. 2014; 85(2): 147-53. https://dx.doi.org/10.1111/cge.12107.
- Miller D.T., Adam M.P., Aradhya S., Biesecker L.G., Brothman A.R., Carter N.P. et al. Consensus statement: chromosomal microarray is a first-tier clinical diagnostic test for individuals with developmental disabilities or congenital anomalies. Am. J. Hum. Genet. 2010; 86(5): 749-64.https://dx.doi.org/10.1016/j.ajhg.2010.04.006.
- Richards S., Aziz N., Bale S., Bick D., Das S., Gastier-Foster J.,Grody W.W. et al.; ACMG Laboratory Quality Assurance Committee. Standards and guidelines for the interpretation of sequence variants: A joint consensus recommendation of the American college of medical genetics and genomics and the association for molecular pathology. Genet. Med. 2015; 17(5): 405-24.https://dx.doi.org/10.1038/gim.2015.30
- Рыжкова О.П., Кардымон О.Л., Прохорчук Е.Б., Коновалов Ф.А., Масленников А.Б., Степанов В.А., Афанасьев А.А., Заклязьминская Е.В., Ребриков Д.В., Савостьянов К.В., Глотов А.С., Костарева А.А., Павлов А.Е., Голубенко М.В., Поляков А.В., Куцев С.И. Руководство по интерпретации данных последовательности ДНК человека, полученных методами массового параллельного секвенирования (MPS) (редакция 2018, версия 2). Медицинская генетика. 2019; 18(2): 3-23.
- South S.T., Lee C., Lamb A.N., Higgins A.W., Kearney H.M.; Working Group for the American College of Medical Genetics and Genomics Laboratory Quality Assurance Committee. ACMG Standards and Guidelines for constitutional cytogenomic microarray analysis, including postnatal and prenatal applications: revision 2013. Genet. Med. 2013; 15(11): 901-9. https://dx.doi.org/10.1038/gim.2013.129.
- Ребриков Д.В., Коростин Д.О., Шубина Е.С., Ильинский В.В. NGS: высокопроизводительное секвенирование. М.: «Издательство "БИНОМ. Лаборатория знаний"»; 2014. 232 с.
- Mone F., Quinlan-Jones E., Ewer A.K., Kilby M.D. Exome sequencing in the assessment of congenital malformations in the fetus and neonate. Arch. Dis. Child Fetal Neonatal. Ed. 2019; 104(4): F452-F456.https://dx.doi.org/10.1136/archdischild-2018-316352.
- Lord J., McMullan D.J., Eberhardt R.Y., Rinck G., Hamilton S.J., Quinlan-Jones E. et al Prenatal Assessment of Genomes and Exomes Consortium. Prenatal exome sequencing analysis in fetal structural anomalies detected by ultrasonography (PAGE): a cohort study. Lancet. 2019; 393(10173): 747-57. https://dx.doi.org/10.1016/S0140-6736(18)31940-8.
- Rieder W., Maurer S.V., Giannoni E., Baud D. Fetal omphalocele: review of predictive factors important for antenatal counseling? Obstet. Gynecol. Surv. 2022; 77(11): 683-95. doi: 10.1097/OGX.0000000000001073.
- Министерство здравоохранения Российской Федерации. Клинические рекомендации «Многоплодная беременность». 2021.
- Костюков К.В., Гладкова К.А. Диагностика фето-фетального трансфузионного синдрома, синдрома анемии-полицитемии при монохориальной многоплодной беременности. Акушерство и гинекология. 2016; 1: 10-5.
- Приказ Министерства здравоохранения Российской Федерации от 20 октября 2020 г. №1130н «Об утверждении Порядка оказания медицинской помощи по профилю «акушерство и гинекология». Приложение 9. Зарегистрировано в Минюсте России 12 ноября 2020 г. №60869.
- Nishie E.N., Osmundo Junior G.S., Mohamed S.H.M., Tannuri A.C.A., Gibelli M.A.B.C., Carvalho W.B. et al. Three-dimensional ultrasound evaluation of lung volume in fetuses with abdominal wall defect. Fetal. Diagn. Ther. 2023; 50(4): 259-68. https://dx.doi.org/10.1159/000531594.
- Mu W., He M., Lei T., Zhang L., Du L., Xie H. Measurement of the Cobb angle by 3D ultrasound: a valuable additional method for the prenatal evaluation of congenital scoliosis. Quant. Imaging Med. Surg. 2022; 12(5): 2805-12.https://dx.doi.org/10.21037/qims-21-558.
- United Healthcare Medical Policy. Chromosome microarray testing. 10/1/2015. Available at:https://www.unitedhealthcareonline.com/ccmcontent/Providerll/UHC/en-US/ Assets/ProviderStaticFiles/ProviderStaticFilesPdf/Toolsand Resources/PoliciesandProtocols/MedicalPolicies/MedicalPolicies/Chromosome_Microarray_Testing.pdf. Accessed June 26, 2016.
- Ng D., Bouhlal Y., Ursell P.C., Shieh J.T. Monoamniotic monochorionic twins discordant for noncompaction cardiomyopathy. Am. J. Med. Genet. A. 2013; 161A(6): 1339-44. https://dx.doi.org/10.1002/ajmg.a.35925.
- Ng Z.Y., Sau P.Y., Lim G.J. Discordant type I preaxial polydactyly in monozygotic twins on the same hand: a case report. Ann. Plast Surg. 2015; 75(4): 398-400. https://dx.doi.org/10.1097/SAP.0000000000000336.
- Stanek J. Placental fetal vascular malperfusion in congenital diaphragmatic hernia. Virchows Arch. 2023 Jul 13. https://dx.doi.org/10.1007/s00428-023-03600-y.
Поступила 08.12.2023
Принята в печать 11.12.2023
Большакова Анна Сергеевна, врач-генетик отделения клинической генетики Института репродуктивной генетики, Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России, +7(909)982-27-99,
a_bolshakova@oparina4.ru,
https://orcid.org/0000-0002-7508-0899, 117997, Россия, Москва, ул. Академика Опарина, д. 4.
Ярыгина Тамара Александровна, к.м.н., врач ультразвуковой диагностики, н.с. Перинатального кардиологического центра, Национальный медицинский исследовательский центр сердечно-сосудистой хирургии им. А.Н. Бакулева, 121552, Россия, Москва, Рублевское шоссе, д. 135, +7(495)414-78-75; доцент кафедры ультразвуковой диагностики факультета непрерывного медицинского образования Медицинского Института, Российский университет дружбы народов им. Патриса Лумумбы,
127015, Россия, Москва, ул. Писцовая, д. 10,
tamarayarygina@gmail.com, https://orcid.org/0000-0001-6140-1930
Сакало Виктория Анатольевна, к.м.н., м.н.с. отдела акушерской и экстрагенитальной патологии Института акушерства, врач акушер-гинеколог 1-го акушерского отделения патологии беременности, Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России, +7(495)438-07-88,
v_sakalo@oparina4.ru, https://orcid.org/0000-0002-5870-4655, 117997, Россия, Москва, ул. Академика Опарина, д. 4.
Гладкова Кристина Александровна, к.м.н., с.н.с. отдела медицины плода Института акушерства, заведующая 1-м акушерским отделением патологии беременности, Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России, +7(495)438-07-88,
k_gladkova@oparina4.ru, https://orcid.org/0000-0001-8131-4682, 117997, Россия, Москва, ул. Академика Опарина, д. 4.
Барков Илья Юрьевич, к.м.н., заведующий лабораторией пренатального ДНК-скрининга Института репродуктивной генетики, Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России, +7(495)438-24-10,
i_barkov@oparina4.ru,
117997, Россия, Москва, ул. Академика Опарина, д. 4.
Саделов Игорь Олегович, врач-генетик лаборатории анализа геномных данных Института репродуктивной генетики, Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России, +7(495)438-2410,
i_sadelov@oparina4.ru,
117997, Россия, Москва, ул. Академика Опарина, д. 4.
Ходжаева Зульфия Сагдуллаевна, д.м.н., профессор, заместитель директора Института акушерства по научной работе, Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России, +7(495)438-07-88,
z_khodzhaeva@oparina4.ru,
https://orcid.org/0000-0001-8159-3714, 117997, Россия, Москва, ул. Академика Опарина, д. 4.
Автор, ответственный за переписку: Анна Сергеевна Большакова,
a_bolshakova@oparina4.ru



