Опущение и выпадение тазовых органов – это группа мультифакторных заболеваний, проявляющихся периферическим смещением матки и/или стенок влагалища в сочетании со смежными органами малого таза (мочевой пузырь, прямая кишка, петли кишечника) за пределы вульварного кольца в результате функциональной несостоятельности связочного аппарата внутренних половых органов и мышц тазового дна [1–3].
Распространенность генитального пролапса сильно различается по данным различных исследований и составляет от 3 до 50% [2, 4]. Подобная вариабельность обусловлена различиями дизайнов проведенных исследований, а также использованием различных подходов к диагностике изучаемых состояний. В исследованиях, основанных на объективном гинекологическом осмотре без учета субъективных симптомов у обследуемых пациенток, распространенность пролапса тазовых органов (ПТО) достигает 50% [5].
Дисфункция тазового дна проявляется у 25% небеременных женщин старше 20 лет в популяции населения экономически развитых стран; при этом 17% страдают недержанием мочи средней и тяжелой степени [6, 7]. Ожидается, что с увеличением продолжительности жизни данная патология в ближайшем будущем приобретет особую актуальность. По оценкам Wu A. et al. (2020), в США к 2050 г. доля женщин, страдающих симптоматическим ПТО, увеличится до 46% [6].
ПТО в зависимости от нарушения поддержки определенного компонента тазового дна подразделяют на пролапс переднего отдела, представленный в виде уретроцеле, цистоцеле, цистоуретроцеле; пролапс среднего отдела, включающий маточный пролапс, пролапс сводов влагалища; и пролапс заднего отдела тазового дна, проявляющийся в виде ректои энтероцеле [8]. Пролапс переднего компартмента встречается наиболее часто среди трех вышеуказанных типов и, как сообщается, в два раза чаще, чем пролапс заднего компартмента, и в три раза чаще по сравнению с апикальным пролапсом [9].
Несостоятельность мышц тазового дна с опущением передней стенки влагалища проявляется такими симптомами, как нарушения мочеиспускания, недержание мочи, выпадение тазовых органов, диспареуния и тазовая боль, существенно нарушая качество жизни женщины.
Для диагностики данной патологии недостаточным является проведение только клинического обследования. Эффективным диагностическим инструментом является метод динамической магнитно‑резонансной томографии (дМРТ) тазового дна, позволяющий выполнять всестороннюю оценку анатомических и функциональных характеристик стенок таза и тазовых органов [10–12].
До недавнего времени стандартным подходом при обследовании пациентов с ПТО являлась оценка переднего отдела тазового дна по результатам клинического обследования, а также с использованием ультразвукового исследования (УЗИ) и уродинамических тестов. Однако в последние годы все более широко применяется метод дМРТ, что обусловлено высоким качеством получаемого изображения, хорошей воспроизводимостью и максимальной способностью отображения характеристик тазового дна. Однако, несмотря на значительные преимущества, в литературе продолжается обсуждение диагностической точности метода, проводится поиск корреляций получаемых с его помощью данных с результатами клинического обследования пациентки.
Особенно важны результаты дМРТ органов малого таза в случаях несовпадения результатов физикального обследования и комбинированного уродинамического исследования. Получаемые данные могут предоставить полезную информацию в процессе преди послеоперационного обследования пациенток с ПТО, которым проводится хирургическое лечение, особенно при мультикомпартментных нарушениях.
Цель исследования: анализ литературных данных о возможностях и ограничениях применения метода динамической МРТ при ПТО.
Этиология и патогенез патологии опорных структур тазовых органов
К этиологическим факторам развития дисфункции тазового дна относят комбинации генетических, анатомических, физиологических факторов, высокого паритета и образа жизни, взаимодействующих между собой в различные периоды жизни женщины и приводящих к возникновению данной патологии [13–15].
В исследовании DeLancey J.O. (2016) было показано, что в физиологических условиях поддержка таза обеспечивается взаимодействием между группой мышц, поднимающих задний проход, и связок, которые стабилизируют влагалище на разных уровнях [16]. Любая слабость или разрыв соединительной ткани приводит к возникновению дефектов тазового дна. Описаны 3 уровня соединительнотканной поддержки влагалища [17]; при этом кардинальные и крестцово‑маточные связки обеспечивают наиболее прочную поддержку апикального уровня [18, 19]. Однако, изменения структуры внеклеточного матрикса приводят к возникновению патологических изменений соединительной ткани, что в итоге проявляется нарушениями функций и целостности тканей тазового дна и обусловливает развитие пролапса [20].
Клинические проявления и диагностика пролапса тазовых органов
Патологические изменения в переднем компартменте таза затрагивают мочевой пузырь, уретру и связанные с ними структуры таза. К факторам риска этой патологии относятся: пожилой возраст, многоплодная беременность в анамнезе, семейный анамнез заболеваний тазового дна, хирургические вмешательства и травмы органов малого таза, хроническое повышение давления в брюшной полости, вызванное, в частности, хроническим запором или хронической обструктивной болезнью легких, ожирением, повреждением нервов, иннервирующих соответствующие тазовые структуры, болезни соединительной ткани, например, синдром Элерса–Данлоса.
У многих женщин наблюдается симптоматический пролапс, который может влиять на их повседневную деятельность, сексуальную функцию, физическую активность и другие аспекты качества жизни. По оценкам, около 50% рожениц имеют, как минимум незначительную степень ПТО; пожизненный риск подвергнуться реконструктивным вмешательствам в области таза у женщин оценивается примерно в 11%. Таким образом этот диагноз является одним из наиболее частых показаний к хирургическому лечению у женщин [21]. Наиболее характерным симптомом является ощущение инородного тела во влагалище, выходящего за его пределы. У пациенток с полным выпадением матки могут присутствовать гнойные выделения из влагалища, связанные с присоединением вторичной инфекции к декубитальной язве. По данным Lawrence J.M. at al. (2008), ПТО часто сопутствуют следующие заболевания: 40% пациенток страдают недержанием мочи при напряжении, 37% – гиперактивным мочевым пузырем и 50% – недержанием кала [22].
Совокупность клинических проявлений, возникающих в результате расстройств тазового дна, может вызвать психологический стресс, который ведет к снижению качества жизни [23].
Уродинамические тесты, стресс‑тесты с пессарием могут помочь диагностировать вышеуказанные расстройства при ПТО, но ни один из этих тестов не может гарантировать точность диагноза в связи с очень низкой чувствительностью в отношении прогноза недержания мочи (17–39%). С другой стороны, хотя УЗИ обладает высокой чувствительностью при диагностике стрессового недержания мочи, этот метод не обладает достаточной чувствительностью для диагностики пролапса [24].
дМРТ малого таза позволяет всесторонне оценить анатомические и функциональные особенности таза, исключая воздействие на организм ионизирующего излучения [25]. Для метода характерна хорошая визуализация с высоким разрешением и отличным контрастом мягких тканей. Метод позволяет оценивать состояние эвакуаторной функции визуализируемых структур в динамике [26].
Одновременная визуализация всех трех отделов тазового дна с помощью дМРТ делает возможной оценку мультикомпартментных нарушений, позволяя корректировать хирургическое лечение примерно в 67% случаев [27, 28].
Оценка анатомических характеристик при динамической магнитно-резонансной томографии
Четкие представления об анатомии тазового дна являются необходимой базой точной диагностики различных патологических изменений. При проведении дМРТ поле зрения включает мочевой пузырь, передний отдел уретры, матку и шейку матки, влагалище, прямую кишку и анальный канал.
Основными структурами, поддерживающими тазовое дно, являются внутритазовая фасция, тазовая диафрагма и мочеполовая диафрагма. В каждой из этих структур имеются элементы, поддерживающие мочевой пузырь и уретру.
Внутритазовая фасция представляет собой тонкий верхний слой фиброзно‑мышечной соединительной ткани, который покрывает внутренние органы таза и комплекс, поднимающий задний проход. Эта фасция состоит из нескольких компонентов. Передняя часть пубоцервикальной фасции проходит от лобковой кости до шейки матки, обеспечивая опору для уретры и шейки мочевого пузыря. Три уплотнения внутритазовой фасции представляют собой уретральные связки – периуретральную, парауретральную и пубоуретральную. Эти структуры также поддерживают уретру и шейку мочевого пузыря. Передняя стенка влагалища и ее прикрепления к мышцам, поднимающим задний проход, и к сухожильной арке таза также обеспечивают поддержку уретры и мочевого пузыря, напоминая «петлю» или «гамак» [29].
Параметрий и паракольпий представляют собой фасциальное продолжение боковых стенок таза, которые отходят от матки и влагалища. Параметрий образует уплотнения, которые представляют собой маточно‑крестцовые связки, поддерживающие матку и верхнюю часть влагалища. Задним продолжением внутритазовой фасции между влагалищем и прямой кишкой является ректовагинальная фасция. Мышцы, поднимающие задний проход (Levator Ani Complex), а также седалищно‑копчиковые (копчиковые) мышцы образуют тазовую диафрагму, которая поддерживает тонус и поднимает тазовые органы в верхнем и переднем отделах.
Комплекс, поднимающий задний проход, состоит из пубо‑ректальной, пубо‑копчиковой и подвздошно‑копчиковой мышц. Из них пубо‑ректальная прямая мышца (рис. 1), которая отходит от лобковой кости спереди и охватывает аноректальный переход, образуя урогенитальную щель, удерживает органы тазового дна вместе и прилегает к лобковым костям, предотвращая пролапс этих органов, также формирует угол между анальным каналом и прямой кишкой, играет роль для удержания кала [29].
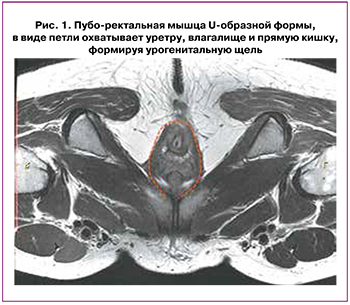
Подвздошно‑копчиковая мышца ориентирована горизонтально, образуя нижний изгиб, прикрепляется к сухожильной дуге и копчику, что лучше всего визуализировать на коронарной проекции. Лобково‑копчиковая мышца отходит от верхней ветви лобковой кости и прикрепляется к сухожильной дуге и копчику.
Урогенитальная диафрагма образует нижние отделы тазового дна, состоящего из мышц и соединительной ткани, которые прикрепляются к лобковому симфизу, седалищным ветвям и промежности. Уретра и влагалище проходят через мочеполовую диафрагму. Мышечный компонент диафрагмы состоит из сфинктера уретры, который окружает уретру, обеспечивая удержание мочи, и глубокой поперечной мышцы промежности, которая обеспечивает поддержку дистального отдела влагалища [30].
На рисунке 2 схематично представлены ориентиры на изображениях органов малого таза в норме: аноректальное соединение – точка пересечения оси анального канала с осью нижнеампулярного отдела прямой кишки (измеряется по задней стенке кишки). В покое аноректальное соединение расположено выше или на уровне лонно‑копчиковой линии (ЛКЛ), при натуживании – смещается до 3 см ниже ЛКЛ. Аноректальный угол меняется в зависимости от напряжения или расслабления лонно‑прямокишечной мышцы в покое составляет 90–110°, при натуживании и расслаблении лонно‑прямокишечной мышцы открывается до 103–137°, при напряжении лонно‑прямокишечной мышцы становится более острым.

Техника динамической магнитно-резонансной томографии
При подготовке к проведению дМРТ пациента просят не принимать пищу в течение 4 ч до исследования; в некоторых случаях осуществляют подготовку кишечника для предотвращения возникновения двигательных артефактов, обусловленных кишечной перистальтикой. Перед исследованием пациента просят полностью опорожнить мочевой пузырь, затем необходимо выпить 200 мл воды, чтобы во время процедуры мочевой пузырь начал частично заполняться. Чрезмерное растяжение стенок мочевого пузыря может снизить точность результатов вследствие возникновения потоковых артефактов от перемещения мочи в переполненном мочевом пузыре, а также будет затруднять выполнение команд с натуживанием, что приведет к недооценке пролапса мочевого пузыря [31].
120 мл стерильного смазывающего геля вводят в прямую кишку с помощью шприца для имитации дефекации и оценки полного опорожнения кишки. 10–20 мл геля вводят во влагалище. Заполнение мочевого пузыря не требуется, поскольку моча имеет высокий сигнал на Т2‑взвешенных изображениях (ВИ).
Обследование обычно выполняется на МРТсканере с напряженностью магнитного поля 1,5 тесла (1,5 Тл), когда пациент находится в положении лежа на спине с подушкой под коленями. При использовании МРТ‑сканера с напряженностью магнитного поля в 3Tл увеличивается количество двигательных артефактов, обусловленных пневматизацией кишечника и кишечной перистальтикой, что затрудняет оценку изображений.
У пациентов с клаустрофобией обследование может проводиться на открытом МР‑томографе с напряженностью магнитного поля 0,5 Тл или 1,0 Тл в сидячем положении. В то же время, следует учитывать, что качество изображений, получаемых на открытых МР‑томографах более низкое из‑за плохого соотношения «сигнал‑шум», что также затрудняет интерпретацию томограмм. При проведении дМРТ внутривенное введение контрастного препарата не требуется.
Исследование выполняется в положении пациента «лежа на спине» с использованием поверхностной катушки. Положение стола центрируется на лобковом симфизе, что позволяет на обзорных изображениях с большим полем захватить все тазовые органы и мышцы тазового дна.
Затем получают стандартные Т2‑ВИ в трех проекциях в состоянии покоя пациента. Эти программы позволяют оценить состояние опорных структур тазового дна, включая уретральные связки и мышцы, поднимающие анус, а также состояние других тазовых органов.
После оценки структур тазового дна и тазовых органов в покое приступают ко второму «динамическому» этапу сканирования, во время которого пациента просят выполнить ряд команд – напрячь мышцы тазового дна, «втянув их в себя», затем потужиться и расслабиться. Для оценки пролапса тазовых структур динамическое исследование выполняется в сагиттальной проекции, позиционируется один срез толщиной 6–8 мм, расположенный по срединной линии тела пациента, чтобы в поле среза попадали лонное сочленение, крестец, матка, влагалище, мочевой пузырь и прямая кишка. Сканирование плоскости среза проводится в течение 15 сек, во время которых пациента просят вдохнуть, напрячь мышцы тазового дна на 2–3 сек, потом потужиться также в течение 2–3 сек, затем расслабиться и спокойно дышать. После этого осуществляется автоматическая постобработка полученных изображений с построением «кино‑петли», что позволяет оценить положение тазовых органов в покое и при натуживании относительно неподвижных костных структур таза (лонного сочленения и крестца). Следующим этапом повторяют исследование с функциональными пробами еще раз, но в конце его просят пациента, по возможности, опорожнить кишечник (исследование выполняется в памперсе) [31, 32].
В качестве эффективного результата рассматривается практически полная эвакуация ректального геля. Если этого не происходит при второй попытке опорожнения, предпринимаются следующие попытки для обеспечения хотя бы частичного опорожнения кишечника. У пациентов с частичным опорожнением ректального геля оценивают степень усилий во время фазы опорожнения по выступанию передней брюшной стенки.
После получения эвакуационных снимков обследование завершают.
Анализ изображений
Интерпретация изображения начинается с просмотра трех ортогональных T2‑ВИ, полученных в состоянии покоя, для оценки базовой анатомии и положения органов малого таза. Затем изучают динамические изображения, оценивают положение тазовых органов относительно костей таза в разные фазы натуживания, а также во время эвакуации геля из кишки и влагалища.
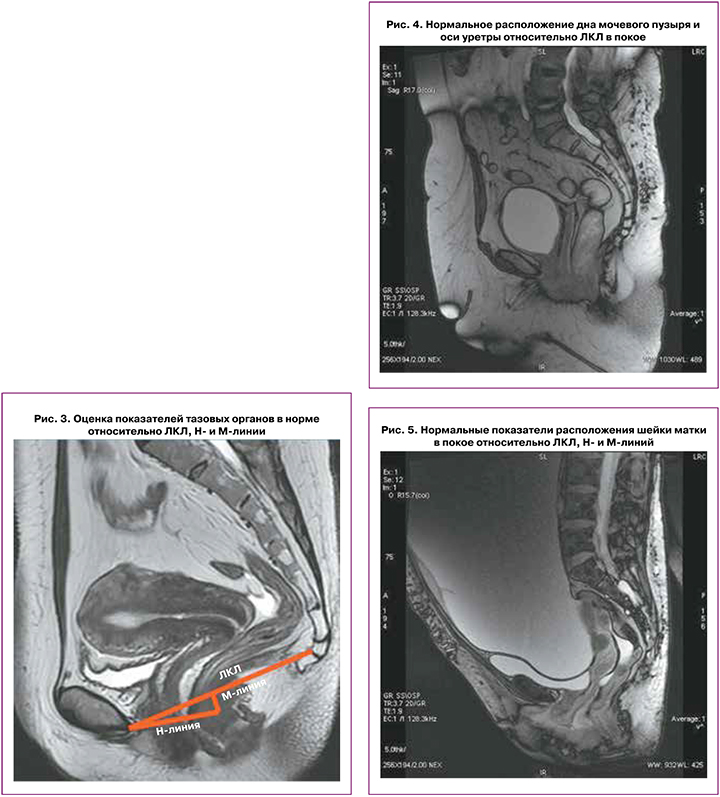
Показатели состояния тазовых органов оцениваются относительно ЛКЛ, соединяющей нижний край лобкового симфиза с последним копчиковым сочленением; линия Н – линия, соединяющая нижний край лонного симфиза с задней стенкой аноректального соединения – соответствует мочеполовой щели, сагиттальный ее размер не должен превышать 5 см; линия М – перпендикуляр, соединяющий линию Н с ЛКЛ – не должна превышать 2 см (рис. 3).
Контрольными точками при исследовании являются:
- основание мочевого пузыря для переднего компартмента;
- верхушка шейки матки или верхушка влагалища у пациенток, которым выполнялась гистерэктомия для среднего компартмента;
- аноректальное соединение для заднего компартмента.
В покое дно мочевого пузыря расположено на 2 см выше ЛКЛ; при натуживании может смещаться на 8 мм ниже ЛКЛ; в покое и при натуживании ось уретры располагается вертикально, может незначительно смещаться при натуживании, просвет уретры не зияет (рис. 4).
В покое шейка матки расположена на 4 см выше ЛКЛ, при натуживании – на 8 мм выше ЛКЛ, при этом Ни М‑линии при натуживании удлиняются незначительно (рис. 5).
Заболевания переднего отдела таза, которые могут быть диагностированы с использованием дМРТ, включают патологию поддерживающих структур тазового дня, цистоцеле, гипермобильность уретры и недостаточность сфинктера уретры [31, 32].
Искажение изображений опорных структур уретры
Мышцы, связки и фасции оценивают по интенсивности их сигналов и целостности изображения на дМРТ. Может наблюдаться ослабление структур тазового дна или их повреждение, охватывающие только передний отдел или все отделы, включая средний и задний.
Связки и фасции имеют вид симметрично расположенных тонких линейных структур низкой интенсивности сигнала на Т2‑ВИ. Мышцы тазового дна также имеют однородную низкую интенсивность сигнала на Т2‑ВИ, однако имеют большую толщину. К признакам их частичного повреждения относят асимметричное истончение, разволокнение структуры, извитость хода волокон, неравномерное повышение интенсивности сигнала от них на Т2‑ВИ. К признакам полного повреждения относят нарушение целостности хода волокон мышцы или связки, фрагментацию ее на несколько частей. В норме подвздошно‑копчиковая мышца может иметь разную толщину в зависимости от состояния покоя или напряжения, которая составляет 2,9–3,9 мм [31]. Пубо‑ректальная мышца обычно имеет размер 4,9–6,5 мм.
Повреждение комплекса levator ani выявляется у 19–28% женщин после родов через естественные родовые пути [32]. Lockhart M. et al. (2018) была выполнена дМРТ до и после родов; по результатам исследования была продемонстрирована взаимосвязь между разрывами леватора и ПТО после беременности и родов [33]. В других исследованиях была подтверждена взаимосвязь между дефектами этой мышцы и пролапсом в переднем отделе таза [34].
По данным дМРТ, независимо от статуса пролапса, у женщин с дефектами леватора отмечается более низкое расположение тазовых органов за счет расширения урогенитальной щели [35]. Для оценки размеров урогенитальной щели при МРТ используется построение Hи M‑линий. Линия H является отображением переднезаднего размера урогенитальной щели и обычно имеет длину <6 см; увеличение этого расстояния свидетельствует о расширении урогенитальной щели, что может быть причиной формирования опущения тазовых органов. Увеличение линии Н до 6–8 мм расценивается как легкая степень расширения урогенитальной щели, 8–10 см – средняя степень расширения и более 10 см – тяжелая степень.
Линия M, которая представляет собой вертикальное расстояние от ЛКЛ до линии H на уровне аноректального соединения, обычно имеет размер <2 см. Увеличение линии М до 2–4 мм является признаком легкой степени опущения заднего компартмента, до 4–6 см – умеренной степени, более 6 см – тяжелой степени опущения [35].
Цистоцеле
Цистоцеле, или пролапс переднего отдела тазового дна, представляет собой опущение основания мочевого пузыря. Эта патология обычно выявляется при натуживании, дефекации, но может возникать и в покое. По мере увеличения размеров цистоцеле отмечается увеличение размеров урогенитальной щели за счет пролабирования в нее части мочевого пузыря с деформацией передней стенки влагалища. Клинически это проявляется наличием пальпируемой выпуклости и может вызывать недержание мочи и/или дисфункцию мочеиспускания. Подобные изменения могут развиваться при ослаблении пубо‑цервикальной фасции и пубо‑ректальной мышцы [36].
В норме в покое шейка мочевого пузыря находится выше ЛКЛ; тогда как при слабости мышц тазового дна шейка пузыря может опускаться на уровень ЛКЛ или даже ниже ее. При натуживании в норме шейка мочевого пузыря несколько опускается вниз, но не ниже 1 см от уровня ЛКЛ. Как представлено на рисунке 6, при выполнении дМРТ размеры цистоцеле оцениваются при натуживании относительно ЛКЛ. Для оценки степени цистоцеле используют правило 3 см: опущение шейки пузыря на 1–3 см ниже ЛКЛ при натуживании считается легкой степенью опущения, на 3–6 см ниже ЛКЛ – умеренным опущением и более 6 см – тяжелым [37].
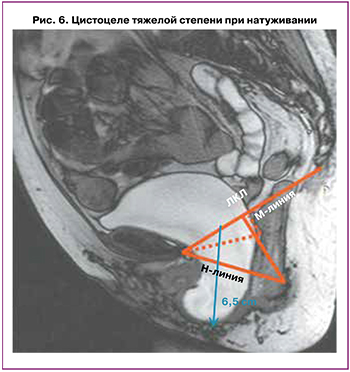
В ряде исследований для оценки истинных размеров цистоцеле подчеркивается важность проведения дМРТ не только с натуживанием, но и с обязательной дефекацией. Так, Arif‑Tiwari H. et al. (2018) сравнили изображения с дефекацией и изображения только с натуживанием (с выполнением пробы Вальсальвы) у 237 женщин с симптомами пролапса. Авторы показали, что у многих пациенток размеры цистоцеле при выполнении проб с дефекацией увеличивались до 3,4 см относительно ЛКЛ; в то время как при выполнении только пробы Вальсальвы цистоцеле пролабировало только на 1 см ниже ЛКЛ [38].
При клиническом обследовании выполняется стандартизированная оценка ПТО с использованием точек Aa и Ba [39–41]. Это исследование проводится в положении дорсальной литотомии и/ или стоя, когда пациенту предлагается выполнить пробу Вальсальвы. Точка Аа расположена вдоль передней стенки примерно на 3 см проксимальнее девственной плевы.
Точка Ва является наиболее дистальной точкой передней стенки влагалища, ее расположение колеблется от ‑3 см до +TVL (общая длина влагалища). Затем пролапс переходит в стадию от 0 до 4. Стадия 0 означает отсутствие пролапса, при стадии 1 дистальная часть находится более, чем на 1 см проксимальнее девственной плевы. Выпадение 2‑й стадии находится в пределах 1 см (дистальнее или проксимальнее) от девственной плевы. Выпадение 3‑й стадии – более чем на 1 см дистальнее девственной плевы, но менее чем на 2 см общей длины влагалища. Стадия 4 пролапса описывает полный выворот, при котором дистальная часть пролапса выступает не менее чем на 2 см общей длины влагалища [41–43].
Гипермобильность уретры
В нормальном состоянии уретра расположена позадилонно, перпендикулярно тазовому дну на среднесагиттальной проекции в состоянии покоя и напряжения. Иногда может наблюдаться небольшой горизонтальный изгиб уретры (рис. 7) .

Для пациентов с гипермобильностью уретры (ГУ) характерна более выраженная горизонтальная ротация при эвакуации содержимого вследствие недостаточности связок уретры, что может приводить к стрессовому типу недержания мочи. В клинической практике ГУ диагностируется с помощью ватной палочки при изменении угла наклона на 30° и более при растяжении уретры. В случае, когда ГУ не выявлена, для оценки давления выполняется комбинированное уродинамическое исследование. Как и уретральный тест, Q‑tip дМРТ позволяет выявить ГУ в случаях, когда угол уретры увеличен на 30° и более. Тяжелая форма цистоцеле может приводить к аномальному опущению уретровезикального перехода, что может маскировать симптомы недержания мочи при наличии сопутствующей ГУ [40].
Недостаточность уретральных мышц
Нормальная уретра имеет вид «мишени» на аксиальных Т2‑ВИ. Для слизистого и подслизистого слоев характерна высокая интенсивность сигнала, слой поперечно‑полосатой мускулатуры гипоинтенсивен, а средний гладкомышечный слой – гиперинтенсивен. Укорочение уретры и недостаточность ее сфинктера можно оценить с помощью дМРТ. При этом у пациентов обычно наблюдается стрессовое недержание мочи, подобное таковому при ГУ. На МР‑томограммах при длине уретры менее 3 см можно говорить об ее укорочении [44]. Истончение поперечно‑полосатой мышцы сфинктера уретры также сопровождается потерей мочи [45], хотя эта взаимосвязь дискутируется [44, 46]. Ослабление сфинктера уретры может привести к образованию дивертикула уретры. Эти изменения могут проявляться на фоне непроходимости мочеиспускательного канала с последующим инфицированием парауретральных желез. Дивертикул может быть разного размера, при этом более крупные из них имеют вид наполненной жидкостью сумки, окружающей уретру. Для постановки этого диагноза достаточно выполнения обычного МРТ исследования без проведения функциональных проб с натуживанием.
Многокомпартментная оценка
Диагностика многокомпонентного поражения может быть затруднена, хотя этот вариант патологии встречается довольно часто. дМРТ органов малого таза обеспечивает визуализацию и функциональный анализ всех трех отделов таза и нередко позволяет осуществлять выбор и коррекцию тактики хирургического лечения [26, 28].
Нарушения опорных структур среднего отдела тазового дна могут приводить к выпадению матки или влагалища. Диагностика пролапса среднего компартмента оценивается аналогично цистоцеле с использованием «правила 3 см» (рис. 8) [37].
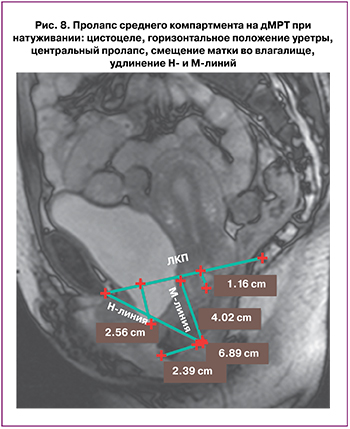
При нарушении опорной функции ректовагинальной фасции может формироваться опущение заднего компартмента тазовых органов, что приводит к образованию энтероцеле, перитонеоцеле или сигмоидоцеле, которые легко распознаются на дМРТ‑изображениях. При энтероцеле и перитонеоцеле отмечается пролабирование в прямокишечно‑влагалищное пространство петель тонкой кишки. На дМРТ при энтероцеле отмечается: расположение петель тонкой кишки или брыжейки между влагалищем и прямой кишкой, расположение петель кишечника ниже ЛКЛ, расширение прямокишечно‑влагалищной перегородки; нетипичное углубление дугласова пространства [47, 48]. Выпадение заднего отдела – ректоцеле – возникает в результате переднего выпячивания передней стенки прямой кишки. Клинически это ощущается как выпуклость на задней стенке влагалища. К другим клиническим проявлениям опущения органов заднего компартмента относят дисфункцию тазовых органов, инвагинацию и недержание кала.
Ограничения динамической магнитно-резонансной томографии
Ряд моментов ограничивают рутинное использование дМРТ. Так, мнения некоторых авторов разошлись в отношении точности МРТ при оценке ПТО. В то время как, одни авторы свидетельствуют о высоких уровнях чувствительности, положительной прогностической ценности и отрицательной прогностической ценности данных дМРТ при диагностике цистоцеле, по сравнению с интраоперационными данными; другие авторы, напротив, отмечают низкую согласованность результатов дМРТ и данных клинического обследования во всех трех отделах таза [49], а Ramage L. et al. (2017) продемонстрировали слабую корреляцию дМРТ с тяжестью жалоб пациентов [50]. Fauconnier A. et al. (2008) также отмечают относительно низкую корреляцию получаемых МР‑данных с результатами клинического обследования пациентов при оценке состояния всех трех отделов таза [41].
Исследование Rosenkrantz A. et al. (2014) показало, что признаки ПТО наблюдаются на дМРТ у бессимптомных женщин, что свидетельствует о необходимости дальнейших исследований в этой области [51].
Оценка выраженности усилий пациента по напряжению и максимальной эвакуации во время обследования должна проводиться хорошо обученными специалистами. Однако это осложняется в случаях, когда пациент чувствует дискомфорт во время динамической части исследования. Также применение метода занимает много времени и требует соответствующей подготовки пациента.
Заключение
Таким образом, дМРТ представляет собой метод исследования, для которого характерно высокое разрешение получаемых изображений и воспроизводимость. Метод позволяет выявлять патологию органов и опорных структур всех отделов таза, характеризуется достоверными корреляциями получаемых результатов с клиническими данными. Это особенно важно при обследовании пациентов со сложным анамнезом или в случаях сомнительных результатов исследования, а также в случаях наличия мультикомпартментных расстройств.
Использование динамической визуализации позволяет оценить функциональные изменения, сопровождающие патологию тазового дна. Безусловно, метод дМРТ не заменяет клиническую оценку, но может быть использован в качестве дополнительного инструмента для оценки состояния тазовых органов и структур тазового дна; его результаты позволяют производить объективную оценку состояния структур тазового дна. Это особенно важно при выборе тактики хирургического лечения пролапса тазовых органов.



