Послеродовые гнойно-воспалительные заболевания в настоящее время занимают одно из первых мест в структуре материнской заболеваемости и смертности [2]. Это связано с тем, что существующие на сегодня современные методы диагностики, профилактики и лечения послеродовых воспалительных осложнений недостаточно эффективны, поэтому число гнойно-септических осложнений остается стабильно высоким, составляя 26% в структуре материнской смертности [4]. Кроме того, послеродовые инфекционные заболевания напрямую влияют на репродуктивное здоровье женщины. Послеродовой эндометрит часто приводит к бесплодию и невынашиванию беременности. Акушерский перитонит, развившийся на фоне послеродового эндометрита, является показанием для экстирпации матки, что делает невозможным дальнейшее выполнение женщиной репродуктивной функции.
Вместе с тем своевременная диагностика, профилактика и лечение послеродовых гнойно-септических заболеваний до сих пор представляют значительные трудности, прежде всего, в связи с тем, что не всегда возможно спрогнозировать развитие воспалительного процесса на основании бактериальной обсемененности. Поэтому в настоящее время большое внимание уделяется исследованию местной иммунореактивности и ее роли в развитии воспалительного процесса.
Рисунок. Тролл-подобные рецепторы и их сигнальные пути.
Наибольшего внимания, на наш взгляд, заслуживает система врожденного, или неспецифического иммунитета, которая является первой линией защиты на пути проникновения инфекции.
Основными сигнальными рецепторами, распознающими лиганды патогенных микроорганизмов, являются толл-подобные рецепторы (TLR – Toll-like receptor), расположенные внутриклеточно и на поверхности нейтрофилов, макрофагов, дендритных, эндотелиальных и эпителиальных клеток, а также натуральных киллеров [3, 11]. Эта группа рецепторов (TLR1, 2, 4, 5 и 6) способна распознавать структуры мембран бактерий, грибов и простейших, а также РНК и ДНК вирусов и неметилированную бактериальную ДНК (TLR3, 7, 8 и 9), а также эндогенные лиганды [7, 10, 13, 15]. Связывание TLR c лигандом приводит к выработке цитокинов и антимикробных пептидов, что происходит путем внутриклеточной передачи сигнала двумя возможными путями (см. рисунок) [18]. Первый путь связан с включением адаптерного белка первичного ответа миелоидной дифференцировки 88 (MyD88), который активирует ядерный транскрипционный фактор (NF-kB), инициирующий в ядре транскрипцию генов провоспалительных цитокинов и антимикробных пептидов. Кроме того, TLR3 и TLR4 способны запускать иммунный ответ по MyD88-независимому пути. Он осуществляется посредством адаптерного белка, индуцирующего интерферон-1β (TRIF), что приводит к фосфорилированию интерферон-регулирующего фактора-3 (IRF-3). Альтернативный путь стимулирует выработку интерферонов I типа и активацию интерферон-индуцируемых генов [1].
Материал и методы исследования
В основную группу были включены 48 пациенток с послеродовым эндометритом. Во всех случаях
клиническая картина эндометрита развивалась на 2–4-е сут послеродового периода. Диагноз эндометрита был выставлен на основании клинико-лабораторных данных, включавших повышение температуры тела до 37,5–39,0 °С, симптомы общей интоксикации, лейкоцитоз – 17,6±7,9 109/л с нейтрофильным сдвигом (78,2±12,3%) и увеличение скорости оседания эритроцитов (СОЭ) — 42;3±17,4 мм/час. При бимануальном исследовании наблюдалась субинволюция матки. Эхографическое исследование матки использовали как вспомогательный метод, так как ультразвуковые признаки эндометрита (субинволюция матки и расширение ее полости более 8—12 мм) наблюдались только в 85,4±5Д% случаев.
Контрольную группу составили 56 пациенток с нормально протекаюшим послеродовым периодом. Клинико-лабораторные показатели в этой группе были в пределах нормы: лейкоциты — 7,9±2,2х10ул, нейтрофилы - 52,2±Ю,4%, СОЭ - 9;3±8;4 мм/час.
Все пациентки были родоразрешены через естественные родовые пути. Группы были сопоставимы по возрасту и паритету, на момент обследования у них отсутствовали тяжелые формы гестоза, экстрагенитальной патологии, острые и обострения хронических заболеваний.
Материалом для оценки экспрессии Т1_К служили эпителиальные клетки, взятые из цервикального канала на 3— 4-е сут послеродового периода. Полученный материал помешали в консервируюшую среду RNAlater("Аmbion", США), пробирки оставляли в холодильнике при температуре +4 "С на 1 сут, затем помешали в морозильную камеру и в дальнейшем хранили при температуре -28 "С.
Выделение, обратную транскрипцию и количественную полимеразную цепную реакцию (ПЦР) в режиме реального времени проводили согласно рекомендациям МIQE (Мinimum information for publication of quantitive Real Time PCR experiments [8].
После размораживания проб экстракцию РНК выполняли с помощью фенол- хлороформной экстракции по методу Р. Сhomchinsky and N. Saccini (1987) [9], с использованием реагента Тризол ("Invotrogen", США). Качество РНК проверяли методом электрофореза в агарозном геле. Для удаления геномной ДНК использовали набор DNAse IRNAse free ("Fermentas", США). Для проведения обратной транскрипции использовали обратную транскрипта зу Мint («Евроген», Россия) и oligoDT, в реакцию вносили 500 нгмРНК.
Для количественной ПЦР был произведен подбор специфических праймеров в базе данных Вlast (www.ncbi.nlm.nih.gov). Реакцию ПЦР проводили с использованием смеси qPCRmix-HS SYBR ("Евроген", Россия) с интеркалирующим красителемSYBR I. Количественную ПЦР проводили на амплификаторе SFX96 («Bio-rad», США).
В качестве генов-нормировщиков были выбраны бета-актин(beta-actin) и пептидилпропилизомераза A (PPIA). Полученные результаты выражали в относигельных единицах (relative units, RU), вычисляя их по формуле:
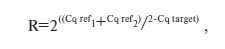
где R – нормализованная экспрессия мРНКисследуемых генов, Cq ref и Cq ref – Cq генов-нормировщиков, Cq target – Cq исследуемого гена [16, 19].
Статистическую обработку результатов проводили с использованиемпрограммы «Statistica 6.0». Проверку нормальности распределения признаков проводили с помощью критерия Колмогорова-Смирнова и Шапиро-Уилка. Так как данные подчинялись закону нормального распределения, для оценки достоверности различий использовали t-критерий Стьюдента для двух независимых выборок. Различия считали статистически достоверными при уровне значимости p<0,05.
Результаты исследования и обсуждение
Средний возраст женщин основной группы составил 27,В±7;В года, средний возраст группы контроля 25.2±5,7 года. Доля первородящих в основной группе составила 62%, в контрольной - 56%.
Было установлено, что у пациенгок с послеродовым эндомегритом наблюдалось снижение местной иммунореактивности (см. таблицу). Это выражалось в уменьшении экспрессии ТLR4 лиганд — липополисахариды грамотрицательных бактерий) и ТLR5 (лиганд — флагеллин бактерий). Уровни экспрессии ТLR1 и ТLR2 в обеих группах достоверно не отличались.
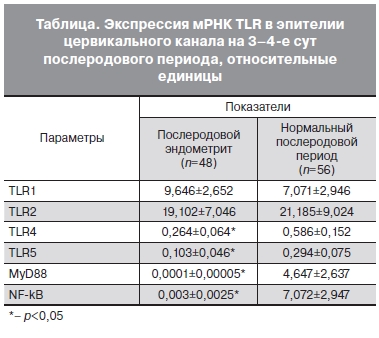
Для оценки влияния снижения экспрессии TLR4 и 5 на другие звенья врожденного иммунитета, определяли экспрессию белков МуD88-зависимого сигнального пути. Было выявлено, что у пациенток с послеродовым эндометритом уровень экс пресс и и NF-kВ был достоверно ниже, чем в группе контроля. Уровень МуD88 в обеих группах также достоверно отличался за счет его снижения в группе с послеродовым эндометритом. Между уровнем экспрессииМуD88 и NF-kВ наблюдалась умеренная корреляционная связь (r=0,42? p<0,05).
По-видимому, снижение экспрессии TLR4 и TLR5 является одной из основных причин развития послеродового эндометрита даже при небольшой бактериальной обсемененности. Этот механизм можно считать одним из ведущих, так как причиной развития послеродовой инфекции является активация собственной условно-патогенной микрофлоры.
Так как для передачи сигнала с TLR4 и TLR5 служит MyD88-зависимый путь, то снижение уровня MyD88 и NF-kB у этих пациенток является закономерным. Снижение экспрессии NF-kB, по-видимому, приводит к уменьшению выработки провоспалительных цитокинов и антимикробных пептидов на поверхности слизистых оболочек, что может способствовать инвазии возбудителя даже при небольшом количестве патогена.
Данных о роли TLR в развитии послеродовых гнойно-септических заболеваний у женщин в отечественной и зарубежной литературе нет. В работах на коровах, однако, было показано, что введение убитой нагреванием Escherichia coli или липополисахаридов в полость матки после родов приводит к TLR4-опосредованному увеличению продукции фактора некроза опухоли-α, синтазы оксида азота и простагландинов групп E и F [14, 20].
Была также показана роль TLR4 и TLR5 в развитии воспалительных процессов другой локализации. Так, T. Hawn и соавт. (2007) в экспериментах на мышах, нокаутированных по TLR5, доказали, что отсутствие экспрессии этого рецептора способствует быстрому развитию и тяжелому течению пневмонии по сравнению с нормальной линией мышей, несмотря на одинаковое количество возбудителя [12]. Это связано со снижением уровней провоспалительных цитокинов, в частности, фактора некроза опухоли-α, вследствие отсутствия активации TLR5. Недостаточная экспрессия TLR4 также приводила к более тяжелому течению пневмонии неинфекционного генеза [22].
В другом эксперименте было показано, что на 5-е сут после трансуретрального введения Escherichia coli у инфицированных мышей, нокаутированных по TLR5, бактериальная обсемененность почек и мочевого пузыря была достоверно выше, чем у контрольной дикой линии мышей. Это сопровождалось увеличением выработки цитокинов и хемокинов, более выраженными гистологическими признаками воспаления и снижением выживаемости [5].
Напротив, стимуляция экспрессии TLR5 путем местного введения флагеллина значительно уменьшает патологические изменения в тонком и толстом кишечнике и снижает смертность мышей в модели колита, вызванного Clostridium difficile [17]. Это связано не только с усилением местной иммунореактивности, но и с уменьшением апоптоза кишечных эпителиоцитов, что в совокупности значительно снижает возможность проникновения возбудителя через эпителиальный барьер.
По данным литературы, одной из основных причин стимуляции экспрессии ТLR женских половых путей является нормальная микрофлора влагалища. Так, M. Visozo и соавт. (2009) показали, что лактобактерии способны стимулировать экспрессию TLR2, TLR4 и TLR5 во влагалище и шейке матки [21]. Можно предположить, что одной из основных причин, способствующих снижению уровня TLR4 и TLR5 у родильниц, является исходно низкое содержание во влагалище лакто- и бифидобактерий. Лиганд TLR5 флагеллин является одним из перспективных компонентов для создания вакцин, стимулирующих антиинфекционный иммунитет слизистых оболочек [6]. Поэтому разрабатываемые вакцины на основе агонистов ТLR в перспективе могут быть использованы для профилактики послеродовых гнойно-септических осложнений.
Таким образом, уменьшение экспрессии TLR 4 и 5 в эпителии женских половых путей может играть значительную роль в патогенезе послеродового эндометрита, так как это способствует активации условно-патогенной флоры вследствие снижения местной иммунореактивности. Работа выполнена при поддержке гранта Президента РФ МК-1564.2010.7 и Госконтракта № 14.740.11.0248.



