Привычный выкидыш – это самопроизвольное прерывание двух и более беременностей в сроке до 22 недель; встречается у 3–5% супружеских пар, а по некоторым данным, достигает 20% [1–3]. Известно, что риск последующего прерывания беременности увеличивается; при этом частота потери беременности после первого выкидыша составляет 13–17%, после двух самопроизвольных прерываний – 36–38%, после трех – 40–45%. Большая часть потерь происходит в I триместре гестации [3]. Причины привычного невынашивания беременности различны и зависят от многих факторов, действующих одновременно или последовательно. К ним относят генетические, анатомические, эндокринные, иммунные нарушения, а также нарушения в системе свертывания крови [4–15]. В последние годы внимание ученых привлекают иммунологические аспекты привычного невынашивания беременности, которые выявляются в различных звеньях иммунной системы и занимают первое место в этиологии необъяснимых репродуктивных потерь [3].
Известно, что женщины с привычным невынашиванием в анамнезе характеризуются осложненным течением последующей беременности (преждевременные роды, гестационный диабет, задержка роста плода, преждевременная отслойка нормально расположенной плаценты, гестационная артериальная гипертензия, преэклампсия, низкая оценка новорожденного по шкале Апгар) [16–20]. Поэтому у женщин с репродуктивными потерями отмечается неблагоприятный для плода исход беременности более чем в половине случаев, что обусловливает высокий уровень перинатальной заболеваемости и смертности [20].
Исследования последних лет показали, что на инвазию трофобласта влияет соотношение факторов, вызывающих апоптоз и предотвращающих его, а также регуляторные внутриклеточные механизмы, участвующие в патогенезе осложнений гестации [21–23]. Наиболее хорошо изучен апоптоз в результате взаимодействия белков системы Fas/CD95-FasL/CD178.
Fas – это мембранный белок, который имеет внеклеточный, трансмембранный и цитоплазматический домены [24]. Fas экспрессируется на тимоцитах, активированных Т- и В-лимфоцитах, фибробластах, гепатоцитах, кератиноцитах, миелоидных клетках, а также в небольшом количестве на поверхности клеток трофобласта, стромальных клеток эндометрия [24, 25] и активируется соответствующим антигеном – FasL, являющимся индуктором апоптоза.
Наиболее широко экспрессия FasL-молекул представлена в популяции мононуклеарных клеток [24, 25]. В ряде работ была доказана роль CD178 в развитии опухолевых, аутоиммунных заболеваний, преэклампсии [22, 24, 25]. Показано, что самопроизвольные выкидыши сопровождаются увеличением экспрессии CD178 на децидуальных лимфоцитах и CD95 во вневорсинчатом трофобласте [26].
В литературе отсутствуют данные об изменении содержания CD178+ моноцитов при угрозе прерывания и привычном невынашивании беременности в зависимости от ее исхода. Прогнозирование и последующая профилактика угрожающего позднего выкидыша позволят предотвратить различные осложнения гестационного периода и неблагоприятные исходы беременности [27].
Цель исследования – сравнить содержание CD178+ мононуклеарных клеток в периферической крови у женщин с угрозой прерывания в I триместре и привычным невынашиванием в анамнезе и у женщин без угрозы прерывания беременности.
Материалы и методы
В условиях клиники ФГБУ «НИИ МиД им. В.Н. Городкова» Минздрава России и женских консультаций г. Иваново проведена проспективная оценка течения беременности и перинатальных исходов у 80 женщин. Основную группу составили 50 беременных с угрозой прерывания ранних сроков и привычным невынашиванием в анамнезе. Контрольную группу составили 30 женщин с физиологическим течением беременности и неотягощенным репродуктивным анамнезом. В исследование были включены пациентки с одноплодной беременностью. Критерии исключения: индуцированная беременность, декомпенсированная соматическая патология, многоплодие.
Для исследования относительного содержания CD178+ к 3 мл гепаринизированной крови добавляли 3 мл «Среды 199» и выделяли обогащенную популяцию мононуклеарных клеток стандартным методом скоростного центрифугирования. Суспензию клеток дважды отмывали физиологическим раствором и доводили их концентрацию до 1×106 кл/мл с последующим добавлением 20 мкл моноклональных антител анти-CD178, конъюгированных с фикоэритрином. Клетки отмывали, фиксировали в 0,5 мл фиксирующего раствора CellFixTM (BD Biosciences, Belgium) и определяли относительное (процентное) количество CD178+ моноцитов и лимфоцитов на проточном цитометре FACScanto (Becton Dickinson, USA).
Статистический анализ
Проверка нормальности распределения проводилась с помощью критерия Шапиро–Уилка и равенства дисперсий, определенного с помощью критерия Левина. Количественное описание величин с нормальным распределением выполнялось с помощью подсчета среднего арифметического (М) и стандартного отклонения (SD). Статистическая значимость различий определялась с помощью параметрического t-критерия Стьюдента. Если распределение отличалось от нормального, выполнялся подсчет медианы, верхней и нижней квартили (Ме (Q1; Q3). Проверку статистических гипотез об отсутствии межгрупповых различий количественных признаков осуществляли с помощью непараметрических критериев Манна–Уитни, Колмогорова–Смирнова, Вальда–Вольфовица. Для показателей, характеризующих качественные признаки, указывали абсолютное число и относительную величину в процентах. Для оценки значимости распределения качественного признака между группами применяли критерий χ2 Пирсона или двусторонний точечный критерий Фишера. Критический уровень значимости (р) при проверке гипотез принимали равным 0,05. Проводили расчет относительного риска (ОР) с 95% доверительным интервалом (95% ДИ). Для оценки диагностических методов вычисляли и анализировали следующие характеристики: чувствительность, специфичность, прогностическую ценность положительного результата теста, прогностическую ценность отрицательного результата теста, диагностическую точность метода. Чувствительность, специфичность, прогностическая ценность положительного результата и прогностическая ценность отрицательного результата теста были оценены при помощи ROC-анализа с вычислением площади под ROC-кривой (англ.: AUC – Area under ROC-curve). Диагностическая точность метода рассчитывалась по общепринятой формуле как доля истинных результатов среди всех результатов и выражалась в процентах. Для статистической обработки использовали программы Statistica for Windows 10.0, Microsoft Excel 2018, MedCalс и OpenEpi.
Результаты и обсуждение
Возраст женщин составил 29 (26;33), 26 (23,3;28,8) лет (по группам соответственно). При анализе связи угрожающего выкидыша и привычного невынашивания были выявлены следующие факторы: возраст (р<0,001), курение (ОР 1,52; 95% ДИ 1,14–2,04), употребление алкоголя (ОР 1,69; 95% ДИ 1,26–2,67), повторный брак (ОР 1,73; 95% ДИ 1,42–2,11), повышенный индекс массы тела (р=0,001), воспалительные заболевания органов репродуктивной системы (ОР 1,66; 95% ДИ 1,28–2,14), миома матки (ОР 1,71; 95% ДИ 1,41–2,08), внематочная беременность (ОР 1,65; 95% ДИ 1,39–1,98), повышение уровня гликемии плазмы (р<0,001), неразвивающаяся беременность (ОР 1,7; 95% ДИ 1,4–2,06), преждевременные роды (ОР 1,97; 95% ДИ 1,54–2,52). При этом у 7 (58,3%) женщин основной группы наблюдались спонтанные преждевременные роды, связанные с началом родовой деятельности, и у 5 (41,7%) – спонтанные преждевременные роды, связанные с дородовым излитием околоплодных вод. У 2 (16,7%) женщин основной группы преждевременные роды были очень ранними, у 2 (16,7%) – ранними, у 3 (25%) – преждевременные роды в сроке 31–33 недели 6 дней, у 6 (50%) пациенток произошли поздние преждевременные роды. Анамнестические, клинические данные и характеристика течения настоящей беременности представлены в таблицах 1 и 2.
Для уточнения механизма регуляции апоптоза у женщин с угрозой прерывания беременности в I триместре и привычным невынашиванием нами была проведена оценка мембранной экспрессии CD178+ молекул мононуклеарными клетками периферической венозной крови у пациенток исследуемых групп. Анализ результатов исследования показал более низкое относительное содержание CD178+ моноцитов (34,4 (7,1)%; 59,1 (10,4)%, р<0,001) и CD178+ лимфоцитов (21,1 (10,1)%; 40,4 (6,6)%, р<0,001) у женщин основной группы по сравнению с контрольной.
Нами также установлены особенности относительного количества CD178+ мононуклеарных клеток в основной группе женщин в зависимости от выраженности симптомов угрозы прерывания, таких как тянущие боли внизу живота, скудные кровянистые выделения из половых путей при угрожающем выкидыше, выраженные боли и кровянистые выделения из половых путей, открытие цервикального канала при начавшемся выкидыше. При сравнении пациенток с начавшимся выкидышем (n=18) с женщинами, имевшими клиническую картину угрожающего выкидыша (n=32), выявлено более низкое содержание CD178+ моноцитов (29,3 (5,2)%; 34,2 (7,3)%, р=0,017) и CD178+ лимфоцитов (11 (6,0)%; 26,9 (6,9)%, р<0,001) соответственно. При этом статистически значимых различий дальнейшего течения и исходов беременности при изучении данных подгрупп женщин выявлено не было (p>0,05 во всех случаях).
Для уточнения механизмов апоптоза в развитии угрозы прерывания беременности нами был проведен анализ результатов, характеризующих апоптоз-индуцирующую способность мононуклеарных клеток крови пациенток основной группы, в зависимости от течения настоящей беременности. Ретроспективно женщины основной группы (n=50) были разделены на две подгруппы, в зависимости от наличия таких осложнений гестации, как неразвивающаяся беременность ранних сроков, угрожающий поздний выкидыш, угрожающие преждевременные роды, дородовое излитие околоплодных вод, преждевременные роды, с последующим анализом относительного количества CD178+ моноцитов в данных подгруппах. Принимая во внимание, что у 7 (14%) пациенток основной группы диагностирована неразвивающаяся беременность ранних сроков, в дальнейшем проводилось наблюдение 43 женщин основной группы.
Мы установили, что у пациенток основной группы с развившимся угрожающим поздним выкидышем, проявляющимся болью внизу живота, скудными кровянистыми выделениями из половых путей, повышением тонуса матки, относительное содержание CD178+ моноцитов было ниже аналогичных показателей у женщин основной группы, не имевших данных осложнений (p<0,001). Полученные результаты приведены в таблице 3.
Анализ относительного содержания CD178+ лимфоцитов у пациенток основной группы в зависимости от осложнений течения настоящей беременности не выявил статистически значимых изменений (p>0,05 во всех случаях).
Обращает внимание выявленный нами результат снижения уровня CD178+ моноцитов в периферической венозной крови у беременных основной группы с развившимся угрожающим поздним выкидышем по сравнению с аналогичным показателем у женщин без него. Мы предположили, что данный показатель может быть использован как прогностический критерий развития угрожающего позднего выкидыша у женщин с угрозой прерывания в I триместре и привычным невынашиванием в анамнезе. Мы обследовали 43 беременных с угрозой прерывания на ранних сроках и привычным невынашиванием и выявили, что у 31 пациентки относительное количество CD178+ моноцитов было равным или менее 37,7%; при этом у 30 из них развился угрожающий поздний выкидыш. У 12 женщин относительное количество CD178+ моноцитов составило более 37,7%, и беременность у них протекала без признаков угрожающего позднего выкидыша. При этом ROC-анализ показал отличную диагностическую ценность при сравнении подгруппы женщин без угрожающего позднего выкидыша с подгруппой женщин с развившимся угрожающим поздним выкидышем – AUC=0,97 (95% ДИ 0,87–0,99). Чувствительность составила 100% (95% ДИ 88,3–100), специфичность – 92,3% (95% ДИ 63,9–98,7), прогностическая ценность положительного результата – 96,8% (95% ДИ 88–96,8), прогностическая ценность отрицательного результата – 100% (95% ДИ 77,4–100), точность – 97,6% (рисунок).
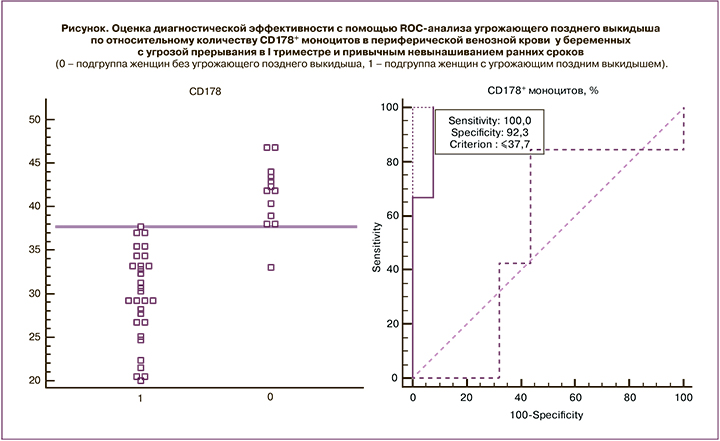
Точкой разделения (cut-off), соответствующей максимальным показателям чувствительности и специфичности для прогноза развития угрожающего позднего выкидыша, было значение 37,7%. Трактовка полученных результатов производится следующим образом: при относительном количестве CD178+ моноцитов ≤37,7% прогнозируется развитие угрожающего позднего выкидыша; при относительном количестве CD178+ моноцитов >37,7% прогнозируется отсутствие развития угрожающего позднего выкидыша.
Преимуществами способа являются высокая точность – 97,6%, чувствительность – 100% и специфичность – 92,3%, хорошая воспроизводимость, доступность метода, простота в интерпретации результатов обследования.
Полученные результаты указывают на перспективность исследований апоптоз-индуцирующей функции моноцитов на ранних сроках беременности с целью прогнозирования угрожающего позднего выкидыша.
Несмотря на накопленные данные, механизмы, лежащие в основе апоптоза плаценты, секреции специфических медиаторов и вазоактивных факторов до конца не расшифрованы.
Нормальное развитие плаценты подвергается нескольким последовательностям деления и дифференцировки клеток, после чего происходят инвазия клеток эмбрионального трофобласта в децидуальную оболочку и ремоделирование сосудистой сети для увеличения притока крови как к плаценте, так и к плоду. Затем происходит ремоделирование тканей с апоптотическими изменениями, которые приводят к дифференцировке клеток трофобласта [22, 23].
Кроме того, апоптоз способствует материнской иммунной толерантности к отцовским антигенам, экспрессируемым клетками трофобласта [5].
Считается, что моноциты и макрофаги необходимы для установления и поддержания беременности, поскольку они участвуют в разнообразных процессах, включая ремоделирование кровеносных сосудов, иммунную толерантность, иммуномодуляцию материнских децидуальных лимфоцитов и инициацию родов. Около 20–25% популяции децидуальных лейкоцитов на ранних сроках беременности участвуют в вышеперечисленных процессах, а также индуцируют апоптоз и удаление поврежденных клеток, устранение патогенных микроорганизмов [28]. Макрофаги и лимфоциты, поляризованные в подтип М2 и Т2, играют важную роль в поддержании иммунной толерантности на ранних сроках беременности, тогда как клетки, поляризованные в подтип М1 и Т1, могут способствовать прерыванию беременности [21, 23].
Система Fas-FasL является одним из наиболее важных индукторов апоптоза, и нарушения экспрессии одной из этих молекул может быть достаточно, чтобы повлиять на процессы апоптоза трофобласта и поставить под угрозу процесс имплантации или помешать развитию беременности.
Известно, что апоптоз клеток эндометрия способствует имплантации плодного яйца путем взаимодействия Fas, экспрессируемого клетками трофобласта, и FasL на моноцитах и лимфоцитах [28, 29]. Кроме того, макрофаги, экспрессирующие CD178, индуцируют апоптоз эндотелиальных и гладкомышечных клеток спиральных артерий матки, экспрессирующих CD95, что обеспечивает инвазию вневорсинчатого трофобласта в мышечный слой спиральных артерий матки с последующим расширением этих сосудов и обеспечением достаточного кровотока в плаценте, независимо от влияния сосудосуживающих факторов [28, 29, 30].
Вероятно, снижение уровня CD178+ моноцитов при угрозе прерывания беременности в I триместре может явиться одним из факторов, приводящих к нарушению процессов апоптоза, и обусловливать развитие угрожающего позднего выкидыша у женщин с привычным невынашиванием в анамнезе.
Заключение
Таким образом, снижение относительного количества CD178+ моноцитов у женщин с угрозой прерывания беременности ранних сроков и привычным невынашиванием в анамнезе относится к возможным патогенетическим факторам развития угрожающего позднего выкидыша.



