Лейомиома матки является наиболее распространенным заболеванием в структуре гинекологической патологии [1]. Она представляет собой доброкачественную, моноклональную, гормонально-зависимую опухоль, происходящую из гладкомышечных клеток тела или шейки матки. Данное заболевание диагностируется у 25–75% женщин репродуктивного возраста [1, 2].
Важную роль в развитии миомы матки играют как эстрогены, так и прогестерон, а также их рецепторы. Под воздействием прогестерона повышается синтез факторов роста, а эстроген увеличивает экспрессию их рецепторов [3]. Также развитие лейомиомы сопровождается нарушением процессов пролиферации, апоптоза, ангиогенеза [4].
Миома матки длительное время может протекать бессимптомно. Клинические проявления обычно коррелируют с локализацией, размерами и количеством узлов лейомиомы, сопутствующими дегенеративными изменениями в них. Наиболее часто встречающиеся симптомы: тянущие боли в нижних отделах живота, обильные менструации, нарушение функции соседних органов, невынашивание беременности и бесплодие (при отсутствии других причин) [2]. Дисфункциональные маточные кровотечения, характеризующиеся меноррагиями или менометроррагиями, встречаются примерно у 40–50% женщин репродуктивного возраста с миомой матки. Обильные менструации приводят к развитию анемии, снижению качества жизни, профессиональной и социальной активности пациенток [5]. Менометроррагии преимущественно наблюдаются при субмукозном расположении миоматозных узлов, а также при межмышечных узлах с центрипетальным ростом [1, 6]. Обильные менструальные кровотечения при лейомиоме имеют многофакторную этиологию. Вследствие роста узлов увеличивается и деформируется полость матки и поверхность эндометрия, нарушается сократительная способность миометрия. В связи с компрессией сосудов миоматозными узлами возникает венозный застой, расширение венозных сплетений в стенках матки в сочетании с усилением артериального кровоснабжения. Нередко возникают вторичные изменения в системе гемостаза, как следствие нарушения микроциркуляции в матке [7]. Недавние исследования показали, что в развитии патологических кровотечений, связанных с миомой матки, принимают участие нарушения процессов пролиферации, а также локальное воздействие вазоактивных факторов роста, меняющих синтез, экспрессию в эндотелиальных клетках сосудов лейомиом, что приводит к нарушению процессов ангиогенеза [8].
Наличие у пациенток миомы матки, сопровождающейся меноррагиями, по статистике является наиболее частым показанием к хирургическому лечению в гинекологической практике [9]. Единственным радикальным методом лечения миомы матки является гистерэктомия. Однако у женщин репродуктивного возраста необходимость в реализации репродуктивной функции преимущественно требует проведения органосохраняющих операций. Миомэктомия нередко сопряжена с техническими сложностями, связанными с размерами матки и миоматозных узлов, их локализацией, повышенной кровоточивостью тканей, а также со степенью развившейся постгеморрагической анемии. В связи с этим для оптимизации оперативного вмешательства у данной группы пациенток необходима предварительная предоперационная подготовка. Это особенно важно при проведении оперативного вмешательства, предполагающего комбинацию различных доступов, как, например, лапароскопия в сочетании с гистерорезектоскопией, выполняющаяся при множественной миоме матки с субмукозным расположением узла [10].
Медикаментозная подготовка к хирургическому лечению предполагает остановку кровотечения, уменьшение размеров миоматозных узлов и объема матки, повышение уровня гемоглобина. Перечисленные эффекты в дальнейшем создают оптимальные условия для выполнения операции с минимальной кровопотерей и травматичностью, а также дают возможность ускорить восстановление пациенток в послеоперационном периоде. На сегодняшний день препаратами, обладающими вышеописанными эффектами и использующимися в лечении миомы матки, являются агонисты гонадотропин-рилизинг гормона (а-ГнРГ) и улипристала ацетат (УА). Препараты из группы а-ГнРГ оказывают центральное действие, связываясь с ГнРГ-рецепторами гипофиза [11]. Под влиянием а-ГнРГ развивается гипоэстрогения, на фоне которой происходит уменьшение размера миоматозных узлов и, соответственно, объема матки, а также прекращение менструаций [12]. УА относится к группе селективных модуляторов прогестероновых рецепторов (СМПР) и обладает, главным образом, антипролиферативным и проапоптотическим эффектами на лейомиоциты. УА обратимо блокирует прогестероновые рецепторы в тканях-мишенях (тело и шейка матки, яичники, эндометрий, гипоталамус), имеет минимальное сродство к рецепторам андрогенов, эстрогенов и минералкортикоидов, подавляет экспрессию факторов роста и ангиогенеза [13]. В 2012 г. группой исследователей было проведено два мультицентровых рандомизированных клинических исследования (PEARL I, PEARL II), показавших высокую эффективность УА в лечении миомы матки. В обоих исследованиях было отмечено значительное уменьшение или прекращение обильных менструальных кровотечений, связанных с наличием лейомиомы, повышение уровня гемоглобина, уменьшение объема миоматозных узлов, отсутствие выраженных побочных эффектов [14, 15].
Цель исследования: повысить эффективность комплексного лечения пациенток репродуктивного возраста с миомой матки, сопровождающейся меноррагиями и анемией, с помощью предоперационной подготовки УА.
Материал и методы исследования
Обследованы 55 женщин репродуктивного возраста с миомой матки, сопровождающейся меноррагиями. Пациентки методом случайного отбора были разделены на 2 группы. Основную группу (I группа) составили 30 пациенток, которым перед оперативным вмешательством проводилась медикаментозная терапия СМПР – УА в течение 3 месяцев, а затем была произведена миомэктомия (средний возраст пациенток – 37,2±4,8 года). В контрольную группу (II группа) были включены 25 пациенток, которым оперативное вмешательство (миомэктомия) проводилось без предварительной медикаментозной терапии (средний возраст – 38,3±3,47 года). В обеих группах при наличии высокой степени анемии проводилась антианемическая терапия с использованием железа (III) гидроксид полимальтозата. Была проведена сравнительная оценка клинико-лабораторных данных в I (до и после лечения) и II группах. Также были проанализированы основные критерии течения операции и послеоперационного периода в двух группах.
Всем пациенткам на этапе первичного осмотра было проведено стандартное общеклиническое обследование, инструментальные и лабораторные исследования.
В обеих группах по перенесенным соматическим и гинекологическим заболеваниям, наследственности, аллергическому, акушерскому анамнезу, длительности наличия миомы матки, статистически значимых различий выявлено не было.
Клиническую эффективность УА оценивали по нескольким критериям:
- прекращение кровотечений;
- уменьшение объема матки и миоматозных узлов;
- повышение уровня гемоглобина в сыворотке крови;
- уменьшение сопутствующих симптомов.
Степень тяжести менструальной кровопотери определялась по графической шкале оценки кровопотери (pictorial blood loss assessment chart – PBAC) [16], в которой учитывалось количество использованных гигиенических средств защиты, наличие и размер сгустков, длительность кровотечений. Данная шкала была представлена в виде бланка, который был выдан всем пациенткам на этапе первичного осмотра. После полученных инструкций в срок очередной менструации женщины самостоятельно заполняли бланк. У пациенток I группы, помимо первичного осмотра, менструальная кровопотеря оценивалась в течение всего этапа проведения медикаментозной терапии. Сумма баллов >100 соответствовала менструальной кровопотере в объеме >80 мл, что определялось как меноррагия [16].
У пациенток I и II групп во всех случаях миома матки сопровождалась обильными менструациями. Длительность кровотечений в I группе в среднем составила 6,2±1,3 дня, во II группе – 5,9±1,7 дня. Средние показатели графической шкалы оценки кровопотери составили 334,8±80,1 и 367,3±84,7 в I и II группах соответственно (p=0,15).
Пациентки также предъявляли дополнительные жалобы. В основной группе болезненные менструации встречались в 53,3%, тянущие боли внизу живота – в 27%, утомляемость и слабость – в 57%, скудные кровянистые выделения из половых путей до и после менструации – в 17%, учащенное мочеиспускание – в 7%. Во II группе по наличию предъявляемых жалоб не было выявлено статистически значимых различий с результатами первой группы.
Ультразвуковое исследование (УЗИ) органов малого таза было выполнено с помощью продольных и поперечных сечений аппаратами сложного сканирования Brulle Kierre (Siemens, Германия), Aloka SSD-5000 (Япония) с использованием трансвагинального датчика с частотой 7,5 МГц и трансабдоминального с частотой 3,5 МГц. В основной группе в случаях множественной миомы матки динамическое наблюдение проводилось за наибольшим (доминантным) узлом. Узлы с центрипетальным ростом отмечались в протоколе исследования вне зависимости от их размеров.
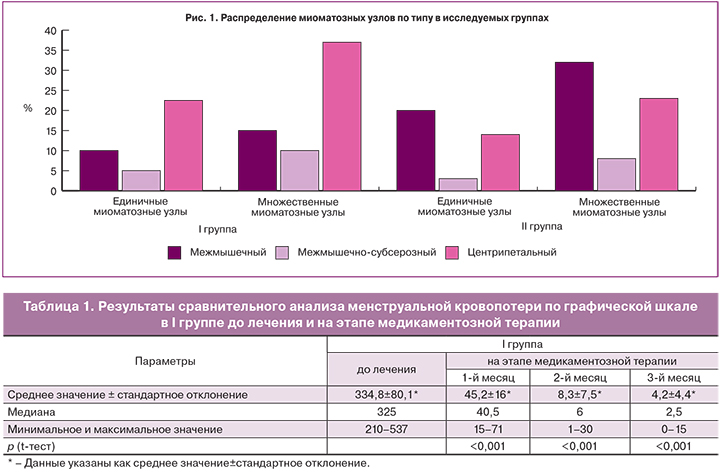
По данным УЗИ в I группе: в 63,4% было выявлено наличие миомы матки с центрипетальным ростом, доминантные межмышечно-субсерозные узлы встречались в 13,3%, межмышечные – в 23,3%. Размеры узлов колебались от 3,5 см до 12 см в диаметре (в среднем – 7,2±2,2 см). Объем матки в основной группе в среднем составил 397 см3.
По данным УЗИ во II группе по типу, размерам миоматозных узлов и объему матки не было выявлено достоверных различий (p>0,05). Размеры узлов были выявлены в пределах от 3,4 см до 11 см, в среднем – 7,1±2,09 см. Среднее значение объема матки в контрольной группе составило 323 см3.
По типу лейомиомы среди единичных миоматозных узлов в обеих группах преобладали узлы с центрипетальным ростом в I группе, межмышечные и центрипетальные узлы – во II группе. Множественная лейомиома в I группе в основном была представлена узлами с центрипетальным ростом и межмышечными миоматозными узлами – во II группе. Распределение миоматозных узлов по типам представлено на рис. 1.
У пациенток I и II группы по данным общего анализа крови была определена анемия легкой и средней степени тяжести. Средний уровень гемоглобина в I группе составил 93,5±13,7 г/л, во II группе – 100,2±13,4 г/л (p=0,206). Содержание тропных гормонов гипофиза, половых стероидов, кортизола было определено у 30 женщин основной группы и 20 женщин контрольной группы. Показатели в обеих группах находились в пределах возрастной нормы и не имели статистически значимых различий (p>0,05).
В целом, по данным анамнеза, клинического обследования, инструментальных и лабораторных исследований, в обеих группах не было выявлено статистически значимых различий.
Учитывая репродуктивный возраст женщин и настойчивое желание сохранить репродуктивную функцию, всем пациенткам было выполнено органосохраняющее хирургическое лечение в объеме миомэктомии лапароскопическим доступом (отделение оперативной гинекологии ФГБУ НЦАГиП им. В.И. Кулакова Минздрава России, руководитель отделения – акад. РАН, д.м.н., профессор Л.В. Адамян). Эндоскопические методы проводились по общепринятой методике с использованием соответствующей аппаратуры фирмы Karl Storz (Германия). Хирургическое вмешательство проводилась под общим наркозом с эндотрахеальной интубацией. Пациентки находились в положении Тренделенбурга. С целью ревизии полости матки и оценки состояния эндометрия проводилась гистероскопия. По показаниям выполнялась биопсия либо выскабливание слизистой полости матки. Лапароскопическая миомэктомия проводилась разработанным в отделении оперативной гинекологии НЦАГиП методом. В зависимости от локализации миоматозных узлов, на поверхности тела матки, по наиболее выпуклой части узла, производился разрез в поперечном либо косом направлении, с использованием игольчатого коагулятора. В миоматозный узел вводили штопор, либо захватывали его щипцами, и выделяли из ложа, послойно отсепарируя капсулу узла от неизмененного миометрия. При вылущивании узлов были использованы биполярный коагулятор, механические ножницы, манипулятор. На этапе извлечения узлов из брюшной полости была использована электромеханическая морцелляция, при возможности с предварительным погружением узла в контейнер. С целью восстановления целостности стенки матки на разрез накладывались швы в 1–2 слоя с помощью техники экстракорпорального завязывания узлов. Был использован рассасывающийся шовный материал (викрил либо v-loc). Как правило, проводилось срочное гистологическое исследование операционного материала.
 Статистический анализ полученных данных выполнялся с использованием программного обеспечения MS Office Excel и Statistica for Windows 10.0. Достоверность различий между двумя группами анализировалась с помощью определения критерия Стьюдента, а также непараметрического анализа по Манну–Уитни. Различия считались статистически значимыми при p<0,05.
Статистический анализ полученных данных выполнялся с использованием программного обеспечения MS Office Excel и Statistica for Windows 10.0. Достоверность различий между двумя группами анализировалась с помощью определения критерия Стьюдента, а также непараметрического анализа по Манну–Уитни. Различия считались статистически значимыми при p<0,05.
Результаты и обсуждение
В результате через 3 месяца после начала лечения в I группе у всех женщин отмечалось значительное уменьшение менструальных кровотечений уже в первый месяц медикаментозной терапии. Кровотечения останавливались через 4–7 дней с момента начала лечения; в среднем данный показатель составил 5,3±1,12 дня. У 26 женщин (86,7%) менструации полностью прекратились со второго месяца лечения. У 4 пациенток (13,3 %) во второй месяц приема препарата наблюдались скудные кровянистые выделения, соответствующие сроку очередной менструации, длительностью до 4 дней. На третий месяц терапии у этой группы пациенток также отмечалось отсутствие кровотечений.
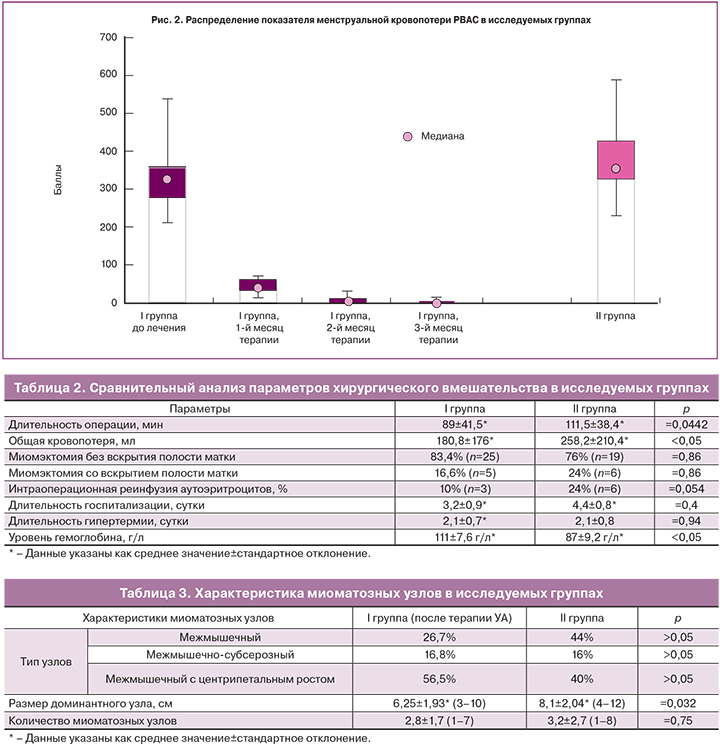
Сравнительная характеристика данных в I группе до и после лечения, полученных при анализе графической шкалы оценки кровопотери, представлена в табл. 1. На рис. 2 показано распределение баллов по графической шкале оценки кровопотери в I группе до и во время терапии, и во II группе. При анализе представленных результатов отмечено значительное снижение показателя PBAC уже в 1-й месяц медикаментозной терапии. Полученные результаты соответствуют данным других авторов [14, 15, 17].
На фоне медикаментозной терапии у большинства пациенток I группы был отмечен регресс сопутствующих симптомов. В большей степени женщины указывали на уменьшение тянущих болей в нижних отделах живота и отсутствие после проведенного лечения быстрой утомляемости, слабости. Из нежелательных явлений у 16,6% женщин (n=5) отмечались головные боли, у 10% (n=3) – болезненность молочных желез в первый месяц приема препарата, что при анализе было сопоставимо с группой контроля.
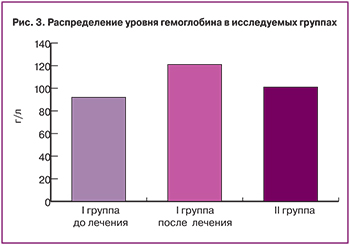
Повышение уровня гемоглобина в основной группе через три месяца после медикаментозной терапии отмечалось у 100% женщин: среднее значение составило 123,4±11,2 г/л при среднем значении 93,5±13,7 г/л до лечения (p<0,01), и 100,2±13,4 г/л – в группе контроля (p<0,01) (рис. 3).
При оценке гормонального статуса пациенток отмечалось снижение уровня ФСГ в среднем на 15% (4,6±3,5 МЕ/л), а также незначительное снижение ЛГ; эстрадиол (386±145,6 пмоль/л) и другие гормоны крови (прогестерон, тестостерон, пролактин, кортизол) были в пределах нормы. Следует отметить, что отсутствие гипоэстрогении и сопутствующих этому состоянию жалоб (приливы, эмоциональная нестабильность) у пациенток после терапии УА подтверждается проведенным многоцентровым исследованием, сравнивающим применение УА с лейпролида ацетатом [15].
Размер доминантных миоматозных узлов достоверно уменьшился практически у всех пациенток на 18% и составил в среднем 6,25±2,2 см (p<0,05; 95% ДИ 0,11–2,63). Тело матки в среднем имело объем 295,2 см3. Толщина эндометрия находилась в пределах нормы и составила в среднем 1,02±0,3 см, что не подтверждается данными мультицентровых исследований [14, 15].
Полученные выше результаты (остановка кровотечений, регресс сопутствующих симптомов, повышение уровня гемоглобина, уменьшение объема матки и миоматозных узлов) сопоставимы с результатами других авторов [14–16] и позволяют сделать вывод о клинической эффективности СМПР, УА.
В обеих группах женщинам была выполнена миомэктомия лапароскопическим доступом. У двух пациенток основной группы также имелся спаечный процесс в малом тазу, у одной пациентки – наружный генитальный эндометриоз с вовлечением брюшины и мелкая эндометриоидная киста яичника.
Во время операции оценивались: количество, размеры и локализация миоматозных узлов, особенности их энуклеации, общая кровопотеря, длительность операции, необходимость интраоперационной реинфузии аутоэритроцитов. В послеоперационный период были проанализированы продолжительность госпитализации, длительность гипертермии, уровень гемоглобина на вторые сутки после операции. Был проведен сравнительный анализ данных показателей в обеих группах. Параметры интраоперационного и послеоперационного периода указаны в табл. 2.
Как видно из табл. 2, в I группе отметилось снижение длительности операции (p=0,0442). Объем кровопотери в среднем в I группе составил 180,8±176 мл, в группе контроля – 239,2±221,8 мл (p>0,05). Миомэктомия без вскрытия полости матки была выполнена в 83,4% случаев (n=25) в I группе и в 76% (n=19) в группе контроля, что не было статистически значимым (p=0,86). В I группе интраоперационную реинфузию провели 3 пациенткам (10%), во II группе – 6 пациенткам (24%). Размеры узлов среди этих женщин в обеих группах колебались от 8 до 12 см, общая кровопотеря – от 500 до 750 мл (p>0,05). При вылущивании узлов в обеих группах в большинстве случаев отсутствовали трудности в определении границ между миоматозными узлами и неизмененным миометрием.
Длительность госпитализации в I группе составила в среднем 3,2±0,9 суток, во II группе – 4,4±0,8 суток (p=0,4). В обеих группах в продолжительности послеоперационной гипертермии достоверных различий выявлено не было (p=0,94). Уровень гемоглобина на вторые сутки после операции был статистически значимо выше в I группе пациенток (p<0,05).
При сопоставлении интраоперационной характеристики миоматозных узлов в I и II группах был выполнен сравнительный анализ среднего значения размера доминантных миоматозных узлов, их типа и количества. Эти данные представлены в табл. 3.
При сравнительном анализе интраоперационной характеристики миоматозных узлов в исследуемых группах, представленном в табл. 3, отмечено статистически значимое уменьшение размера доминантных миоматозных узлов в I группе (p=0,032). По количеству и типу узлов достоверных различий в группах выявлено не было.
Заключение
Проведенное исследование позволяет сделать выводы о целесообразности применения УА в сочетании с железосодержащими препаратами в качестве предоперационной подготовки к реконструктивно-пластическому вмешательству у пациенток репродуктивного возраста с миомой матки, сопровождающейся меноррагиями и анемией. На фоне медикаментозной терапии прекращались обильные менструальные кровотечения, отмечалось стойкое повышение уровня гемоглобина. Отмечено уменьшение размера миоматозных узлов и объема матки. Все вышеперечисленное создало благоприятные условия для применения эндоскопического доступа во время хирургического вмешательства. Выявлено достоверное уменьшение интраоперационной кровопотери и длительности операции. В послеоперационном периоде отмечалось снижение продолжительности пребывания пациенток в стационаре, а также определялся статистически значимый более высокий уровень гемоглобина в I группе по сравнению с контрольной группой.



