Полипы эндометрия (ПЭ) занимают первое место среди внутриматочной патологии у пациенток пожилого возраста (39,2–69,3%) [1, 2]. В большинстве случаев они являются диагностической находкой при ультразвуковом исследовании органов малого таза и протекают бессимптомно [3, 4], но в то же время преобладают среди причин маточных кровотечений в постменопаузе. Известно, что ПЭ являются распространенной находкой с частотой от 16 до 54% у женщин с кровотечением в постменопаузе [2, 5–8].
Результаты многочисленных исследований дают основание рассматривать эту патологию как особую и неоднородную в пато- и морфогенетическом отношении группу. Этиология ПЭ не установлена, а механизмы патогенеза остаются полностью не раскрытыми.
Вопрос о клеточном источнике развития ПЭ остается открытым. Хотя в формировании ПЭ, скорее всего, принимают участие резервные клетки базального слоя эндометрия (стволовые клетки?), доказательств того, что они являются источниками развития ПЭ не получено. По данным J. Fletcher, полипы эндометрия возникают из моноклональных разрастаний генетически поврежденных стромальных клеток эндометрия, с вторичным вовлечением поликлональных доброкачественных желез посредством стромально-эпителиальных взаимоотношений, которые до сих пор не до конца изучены [9]. Хромосомный анализ стромы полипов выявил в большинстве случаев клональные транслокации включающие в себя регионы 6р21-22, 12q13-15 или 7q22 [10].
Современная теория патогенеза ПЭ основана на механизмах эстрогенной стимуляции эндометрия. Основными регуляторными гормонами в эндометрии являются эстроген и прогестерон, которые могут действовать прямо, путем взаимодействия с соответствующими рецепторами, или косвенно, через факторы роста и их регуляторы. Известны стимуляторы и блокаторы этих процессов, которые интегральны и сложно скоординированны в различные фазы менструального цикла с участием аутокринных и паракринных механизмов [11].
Одним из доказательств теории эстрогенной стимуляции является факт отсутствия ПЭ у девочек до наступления менархе [12], другими – обнаружение в них рецепторов к половым гормонам, а также четко установленная взаимосвязь между приемом препаратов, влияющих на стероидные рецепторы (тамоксифен, заместительная гормональная терапия) и частотой выявления ПЭ [13–16].
В то же время у женщин в постменопаузе механизмы патогенеза недостаточно изучены, а гипотеза эстрогенной стимуляции в развитии ПЭ в постменопаузе может рассматриваться как парадоксальная. У женщин в постменопаузе, не получающих заместительную гормональную терапию или терапию тамоксифеном, ПЭ не связаны с высоким уровнем системных стероидов. Рецепторы к эстрогену в постменопаузальном эндометрии постепенно снижаются с возрастом, а наличие эстрогеновых и прогестероновых рецепторов (ЭР и ПР) в эпителиальных клетках, по данным некоторых исследований, определяет толщину эндометрия [17]. В данном случае встает вопрос, связано ли возникновение ПЭ с местными, очаговыми модификациями стероидных рецепторов? По-видимому, изучение роли стероидных рецепторов в патогенезе ПЭ в постменопаузе является весьма важным аспектом [18, 19].
Целью нашего исследования стало изучение экспрессии ЭР и ПР в эпителиальных и стромальных клетках полипов эндометрия и окружающего их эндометрия у женщин в постменопаузе.
Материал и методы
А. Материал исследования:
Всего в исследовании включены 114 женщин, из них в основную группу – 96 морфологически подтвержденных случаев ПЭ. Поскольку в литературе отсутствует общепринятая классификация ПЭ, нами была принята рабочая классификация в соответствии с рекомендациями W.G. McCluggage [20], по которой были определены 2 группы: аденоматозные (11 случаев) и фиброзно-железистые ПЭ (85 случаев). В группу сравнения были отобраны 18 пациенток в постменопаузе (более 10 лет) без патологии эндометрия, которым было проведено оперативное лечение по поводу пролапса гениталий.
Перед включением в исследование у каждой пациентки получено информированное согласие на участие. Исследование одобрено этическим комитетом ФГБУ Научный центр акушерства, гинекологии и перинаталогии им. академика В.И. Кулакова Минздрава России.
Критерии включения в основную группу: постменопауза более 10 лет, наличие ПЭ на фоне атрофичного эндометрия (простая или кистозная атрофия).
Критерии включения в группу сравнения: постменопауза более 10 лет, атрофичный эндометрий (простая или кистозная атрофия).
Критерии исключения для всех групп: прием гормонально активных препаратов (заместительная гормональная терапия, тамоксифен) в анамнезе, прием нестероидных противовоспалительных средств в течение последних 6 месяцев, гиперпластические процессы эндометрия, аденокарцинома эндометрия, сопутствующие миома матки и аденомиоз, хронический эндометрит, опухоли яичников.
Б. Методы исследования:
На I этапе исследования был проведен анализ акушерского, гинекологического и соматического здоровья пациенток с ПЭ, наблюдавшихся и пролеченных в инновационном отделении малоинвазивных технологий ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России (в течение 3 лет).
На II этапе всем пациенткам с подозрением на ПЭ проводилась диагностическая гистероскопия, с оценкой структуры эндометрия по общепринятой методике [21]. При подтверждении диагноза ПЭ проводилось гистерорезектоскопическое локальное удаление его в монополярном режиме, взятие биоптата из окружающего эндометрия и раздельное диагностическое выскабливание полости матки и цервикального канала.
На III этапе было проведено морфологическое и иммуногистохимическое (ИГХ) исследование полипов и окружающего эндометрия. Для ИГХ подобраны пациентки, сопоставимые по основным клиническим параметрам (возраст, длительность постменопаузы, индекс массы тела (ИМТ), наличие сахарного диабета, симптома кровотечения). I группу составили пациентки с аденоматозными полипами (АП – 11 случаев), II – с фиброзно-железистыми полипами (ФЖП – 17 случаев), группу сравнения – с атрофичным не полипоидным эндометрием (контрольный эндометрий – КЭ, 18 случаев).
ИГХ-реакции проводились на серийных парафиновых срезах толщиной 4 мкм, расположенных на стеклах, покрытых L-полизином. Демаскировка антигенов для ИГХ проводилась в ретривере с использованием цитратного буфера (рН 6,0) и при мощности 600 Вт. В качестве первичных антител использовали кроличьи моноклональные антитела к ЭР (клон SP1 «DAKO») и ПР (клон Y85 «DAKO»). Для метки вторичных антител использовали авидин-биотиновый комплекс (АВК KIT, DAKO). Ставились положительные и отрицательные контрольные реакции. В качестве отрицательного контроля брали образцы исследуемых срезов, которые подвергались стандартной процедуре ИГХ, но без добавления первичных антител. Положительный контроль для каждого антитела выбирали в соответствии со спецификациями от фирмы производителя.
Экспрессию стероидных рецепторов оценивали по методу гистологического счета H-Score по формуле S=1a+2b+3c, где a – % слабо окрашенных ядер, b – % умеренно окрашенных ядер, c – % сильно окрашенных ядер. При этом интенсивность коричневой окраски от бледно-окрашенных ядер до интенсивно окрашенных ядер оценивалась по рекомендации McClelland и соавт. [22].
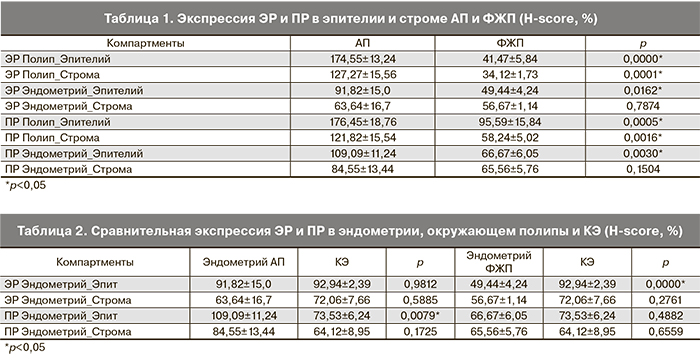
Оценивалась экспрессия рецепторов в ядрах эпителиальных и стромальных клеток полипа и окружающего его эндометрия (рис. 1б, в, г, д см. на вклейке). Также сравнительная оценка проведена между экспрессией каждого рецептора клетками эпителия и стромы между эндометрием, окружающим каждый из гистотипов полипов, и контрольным эндометрием.
Далее, мы провели сравнительный анализ экспрессии ЭР и ПР с учетом наличия или отсутствия симптома кровотечения у пациентки, а также больных с рецидивом ПЭ и без рецидива в каждой группе полипов. Под «рецидивирующим АП» понимались случаи АП у пациенток, имевших ФЖП в анамнезе.
Статистическая обработка проводилась с помощью SPSS17 Statistics 17.0. Статистический анализ проводился непараметрическим методом с помощью U-критерия Манна–Уитни. Для установления корреляции между структурными изменениями и уровнем экспрессии рецепторов в паренхиме и строме использовался коэффициент линейной корреляции Пирсона. Критический уровень достоверности нулевой статистической гипотезы принимали равным 0,05.
Результаты исследования
Возраст пациенток варьировал от 58 до 86 лет и в среднем составил 69,04±6,7 года. Средний возраст начала менструаций составил 13,78±1,57 года. Возраст наступления менопаузы у больных с ПЭ варьировал от 40 до 57 лет, а средний возраст менопаузы составил 49,68±3,68 года. Длительность постменопаузы варьировала от 10 до 40 лет, составляя в среднем 19,36±7,07 года. Из 96 пациенток с ПЭ 20 (20,83%) предъявляли жалобы на кровяные выделения из половых путей. Средний ИМТ составил 30,54±5,32 кг/м2. Избыточная масса тела наблюдалась у 39 (40,62%) больных, ожирение I степени – у 32 (33,3%), II степени – у 9 (9,38%) больных и III степени – у 5 (5,21%) больных. Рецидив ПЭ был отмечен в 16 случаях (16,67%). В 12,5% ПЭ располагались в трубных углах, в 75% – в стенках полости матки, в 4,2% – в дне и в 8,3% – в перешеечной области.
При морфологическом исследовании АП были построены из гиперплазированных тубулярных железистых структур, расположенных среди фиброзной стромы (рис. 1а см. на вклейке). ФЖП при микроскопическом исследовании были представлены разрастаниями фиброзной ткани с включением в него желез, нередко кистозно-трансформированных (рис. 1г см. на вклейке). При наличии симптома кровотечения отмечались дисциркуляторные расстройства.
При ИГХ-исследовании в эпителии АП экспрессия ЭР была статистически значимо выше, чем в строме полипов (p=0,008) и в эпителии окружающего их эндометрия (р=0,007). В строме АП экспрессия ЭР была значимо выше, чем в строме окружающего эндометрия (р=0,021). Окружающий АП эндометрий характеризовался более высокой экспрессией ЭР в эпителии, чем в строме (р=0,018) (рис. 2а). Экспрессия ПР в эпителии АП также была значимо выше, чем в строме полипов (р=0,012) и в эпителии окружающего их эндометрия (р=0,028). Различия в экспрессии ПР в строме АП и окружающего эндометрия не достигали статистической значимости (р=0,05). Окружающий АП эндометрий характеризовался более высокой экспрессией ПР в эпителии, чем в строме, однако эта разница также была статистически незначима (р=0,0592) (рис. 2б). Разница в экспрессии ПР и ЭР в одинаковых компартментах АП и окружающего их эндометрия не была статистически значимой.

Единственной статистически значимой разницей в содержании ЭР в ФЖП была более низкая экспрессия ЭР в строме полипов, чем в строме окружающего их эндометрия (р=0,0003) (рис. 2в). Экспрессия ПР в эпителии ФЖП была значимо выше, чем в строме (р=0,003). Другие отличия не достигали статистической значимости (рис. 2г).
При сравнении экспрессии ЭР и ПР в одинаковых компартментах ФЖП и окружающего их эндометрия выявлено, что и в эпителии, и в строме полипов, и в эпителии окружающего их эндометрия экспрессия ПР была статистически значимо выше (p=0,036, р=0,001 и р=0,0309 соответственно). В строме эндометрия, окружающего ФЖП, статистически значимой разницы в экспрессии рецепторов не выявлено.
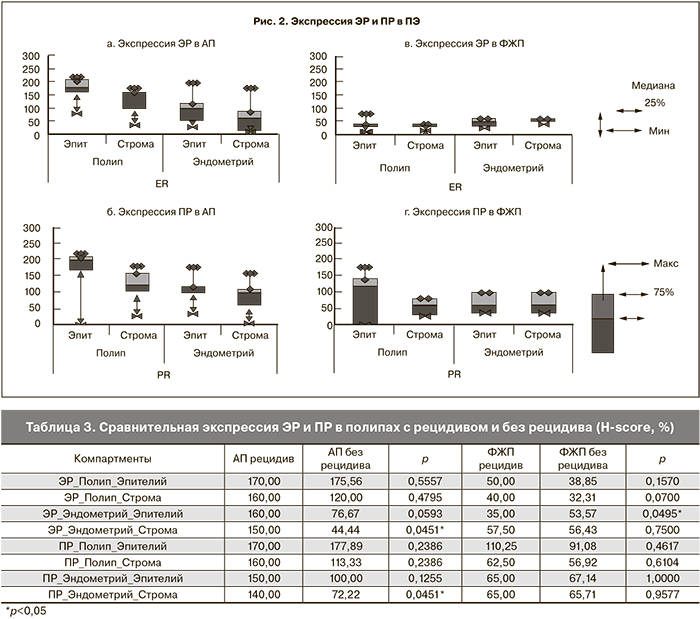
При сравнении ИГХ-особенностей АП и ФЖП, а также сравнении окружающего их эндометрия с контрольным эндометрием (табл. 1 и 2) установлено, что экспрессия ЭР в эпителии и строме АП значительно выше, чем в эпителии и строме ФЖП (р<0,00001 и р=0,0001 соответственно). В эпителии эндометрия, окружающего АП, экспрессия ЭР также была выше, чем в эпителии эндометрия, окружающего ФЖП (р=0,016). Строма окружающего эндометрия не отличалась по содержанию ЭР в обеих группах. В эпителии и строме эндометрия, окружающего «рецидивирующие АП», экспрессия ЭР была выше, чем в соответствующих компартментах АП без рецидива (р=0,059 и р=0,045 соответственно). А в случае рецидивирующих ФЖП экспрессия ЭР в эпителии эндометрия, окружающего такие типы полипов, была ниже, чем таковая при ФЖП без рецидивов (р=0,049) (табл. 3).
При сравнении эндометрия, окружающие полипы по содержанию ЭР, статистически значимая разница была получена только в случае сравнения эпителия эндометрия, окружающего ФЖП, и эпителия КЭ, где было выявлено значительное снижение ЭР в первом случае (р<0,0001) (рис. 3а).
Экспрессия ПР в эпителии и строме АП была значительно выше, чем в эпителии (р<0,0005) и строме ФЖП соответственно (р=0,0016). В эпителии эндометрия, окружающего АП, экспрессия ПР также была выше, чем в эпителии эндометрия, окружающего ФЖП (р=0,003). Строма окружающего две группы ПЭ по содержанию ПР не отличалась. В строме эндометрия, окружающего рецидивирующие АП, экспрессия ПР была выше, чем в соответствующем отделе АП без рецидива (р=0,045). Соответствующие отделы полипов и эндометрия при наличии или отсутствия симптома кровотечения статистически не отличались.
При сравнении эндометрия, окружающие полипы, статистически значимая разница была получена только в случае сравнения эпителия эндометрия, окружающего АП и эпителия КЭ, где было выявлено более высокая экспрессия ПР в первом случае (р<0,0079; рис. 3б).
Обсуждение
Исследования полипов у больных репродуктивного возраста показали, что в отличие от железистого компонента полипов, в стромальном компоненте содержится меньше ПР, чем ЭР. Считается, что это делает полипы нечувствительными к циклическим гормональным изменениям и препятствует децидуализации стромы полипа с последующим менструальным отторжением [19].
Thijs и соавт. (2000) [23], проанализировав ПЭ и аутологичный эндометрий у 24 женщин постменопаузе, установили, что эпителиальные клетки в отношении ЭР и ПР окрашивались более интенсивно, чем стромальные клетки в обеих тканях, что соответствует результатам других исследований [24], в том числе и нашего. С другой стороны, они выявили, что стромальные клетки полипов окрашивались более слабо, чем стромальные клетки окружающего эндометрия. Более того, ими отмечена высокая экспрессия ЭР по сравнению с ПР в стромальных клетках [23], что не соответствует результатам нашего исследования, где при АП разницы в экспрессии ЭР и ПР выявлено не было, а в случае ФЖП экспрессия ПР была значимо выше в эпителии и строме полипов, и в эпителии окружающего их эндометрия.
Одним из основных источников эстрогенов у женщин в постменопаузе может служить жировая ткань, что подтверждается наличием корреляции между повышенной массой тела, жировой тканью и высоким уровнем эстрогенов, описанной во многих ранних исследованиях [25]. Некоторые ученые показали, что пациенты с ПЭ имеют более высокий ИМТ [26]. Belisario и соавт. (2006) установили связь ИМТ и экспрессии ЭР и ПР в эпителиальных и стромальных клетках ПЭ и эндометрия у женщин в постменопаузе, не применяющих гормональную терапию [24]. Мы выявили умеренную положительную корреляцию ИМТ с симптомом кровотечения (r=0,508; р<0,0001), однако связь между ИМТ и экспрессией ЭР и ПР не была отмечена.
Аналогично нашим результатам по АП в некоторых исследованиях была отмечена более высокая экспрессия ЭР и в эпителии, и в строме полипов эндометрия, в сравнении с эпителием и стромой окружающего эндометрия [24]. Слизистая эндометрия, окружающего полип, была исключительно атрофичной во всех случаях и показала значимо более низкую экспрессию ЭР среди пациенток с более высоким ИМТ. Авторы выдвигают предположение, что в данных случаях, возможно, сыграл роль высокий сывороточный уровень эстрогенов, являясь причиной уменьшенной продукции ЭР в окружающем эндометрии, но не в ПЭ. Это может указывать на автономную, клоновую пролиферацию клеточных элементов полипов, не зависящую от системных эстрогенов. Значимо высокий уровень ЭР в железах полипов может указывать на то, что они являются последствием более высокой пролиферации [24].
Наши данные полностью соответствуют результатам Sant’Ana de Almeida и соавт. (2004), которые выявили более сильную экспрессию ЭР и ПР в эпителии полипов, чем в эпителии окружающего эндометрия и более сильную экспрессию ЭР в строме полипов, чем в строме окружающего эндометрия [18]. Более высокая экспрессия стероидных рецепторов в эпителии полипов, чем в окружающем эндометрии, дает основания предполагать более высокую чувствительность этих структур к стероидным гормонам, что обусловливает возможность их роста на фоне невысокого локального уровня эстрогенов и при атрофичном окружающем эндометрии.
Наличие стероидных рецепторов в стромальных клетках необходимо для действия эстрогена и прогестерона. Гипотеза регуляторной роли перигландулярной субпопуляции стромальных клеток, которая, в контакте с базальной мембраной, оказывает влияние на рост и дифференциацию тканей может объяснить развитие ПЭ [27]. В нашем исследовании экспрессия рецепторов эстрогена в строме полипов была выше, чем в строме окружающего эндометрия, таким образом, поддерживая идею трофического паракринного взаимодействия между клетками стромы и эпителия, где индукция эпителиальной эстрогенной пролиферации происходит посредством стромальных рецепторов эстрогена [18]. Эти данные подтверждают современную теорию гистогенеза ПЭ из стромы эндометрия [9].
По результатам, полученным в ходе нашего исследования, объяснить пролиферативную активность в эндометрии, окружающем ФЖП посредством только эстрогенного воздействия не представляется возможным, так как отмечается достоверное снижение экспрессии ЭР в сравнении с контрольным не полипоидным эндометрием. А в эндометрии, окружающем АП, показатели ЭР приближаются к КЭ, что может говорить о важной роли эстрогенного влияния.
Более высокая экспрессия ПР в эпителии и строме АП, чем в эпителии и строме ФЖП, может объяснить более высокую чувствительность АП к лечению гестагенами. По аналогичным показателям ФЖП прослеживается отсутствие чувствительности к гестагенам. Такая же тенденция присуща окружающему эндометрию данных полипов: окружающий АП эндометрий отличается более высокой экспрессией ПР в сравнении с эндометрием ФЖП.
Несмотря на наличие нескольких исследований ПЭ посвященных изучению рецепторного статуса, четко прослеживаются разнонаправленные результаты, полученные в ходе исследований. По нашему мнению, это происходит, в частности, из-за того, что во всех известных нам исследованиях не учитывался такой важный параметр полипов, как гистологический тип. Выявленная в ходе нашего исследования значительная разница в рецепторном статусе АП и ФЖП эндометрия доказывает, что эти типы отличаются не только по морфологическому строению, но и по молекулярным параметрам. Четкое понимание патогенеза разных типов полипов может привести к усовершенствованию дифференцированного подхода к их лечению.
Проведенная нами работа имеет некоторые ограничения, связанные с изучением ограниченного спектра рецепторов, участвующих в формировании ПЭ, однако позволяет обосновать необходимость дальнейших исследований, направленных на совокупный анализ маркеров пролиферации и апоптоза в эндометрии.
Заключение
Наше исследование выявило, что АП и ФЖП эндометрия отличаются экспрессией рецепторов к половым гормонам в их стромальном и эпителиальном компонентах. Также определена существенная разница между эндометрием, окружающим каждый из данных гистотипов полипов, который в свою очередь отличается более высокой экспрессией ЭР и ПР в сравнении с контрольным эндометрием, что следует учитывать при выборе лечебной тактики и объема деструкции эндометрия при данной патологии.



