Стратегической задачей акушерства является внедрение инновационных медико-биологических технологий для изучения механизмов развития осложненной беременности и перинатальной патологии. К числу таких технологий относятся постгеномные исследования, в частности протеомный анализ, дающий представление о совокупности белков исследуемой ткани и создающий качественно новые возможности для системных поисков молекулярных маркеров патологического процесса [1–3].
Одной из лидирующих акушерских причин, приводящих к перинатальной патологии, является преэклампсия, патогенез которой до настоящего времени остается недостаточно изученным [4–6]. В то же время именно модификация экспрессии таких полифункциональных молекул, как белки, играющих ключевую роль во всех клеточных процессах, может служить инициирующим фактором в сложной цепи нарушений, приводящих к развитию этого осложнения беременности.
Поскольку развитие гестации связано с глубокими биохимическими преобразованиями не только в организмах матери и плода, но и в плаценте, осуществляющей тесную взаимосвязь между ними, изучение последней может дать чрезвычайно ценную информацию о механизмах развития акушерской патологии и патогенезе заболеваний новорожденного. Однако данные о протеомном спектре плаценты, особенно об экспрессии ее регуляторных белков, при преэклампсии малочисленны и неоднозначны [7, 8].
В связи с вышеизложенным целью настоящей работы стало изучение протеомного профиля плаценты при физиологически протекающей беременности и преэклампсии.
Материал и методы исследования
В проспективное исследование были включены 32 женщины в возрасте 23–32 лет (в среднем 25,5±0,4 года), у 15 из которых беременность и роды протекали без осложнений (контрольная группа), у 17 беременность осложнилась преэклампсией (основная группа). Степень преэклампсии оценивали, используя международную классификацию МКБ-10. Пациентки основной группы по уровню артериального давления и протеинурии, а также наличию и степени выраженности отеков, соответствовали коду O14.0 – преэклампсия (нефропатия) средней тяжести. В контрольной группе 7 женщин (46,7%) были первобеременными и первородящими. У 8 (53,3%) имели место два и более прерывания беременности по желанию женщины. У 3 пациенток (20%) в анамнезе наблюдались воспалительные заболевания органов малого таза. В основной группе первобеременные и первородящие составили 41,2% (7 женщин), у 10 (58,8%) повторнобеременных и повторнородящих имели место два и более прерывания беременности по желанию женщины. У 35,5% (6 женщин) в анамнезе были воспалительные заболевания органов малого таза. По возрасту, индексу массы тела, времени наступления менархе, регулярности цикла, паритету беременностей и родов, экстрагенитальной и гинекологической патологии обследуемые группы беременных были сопоставимы. Критериями исключения из исследования были декомпенсированные формы соматических заболеваний, многоплодная беременность, тяжелые формы преэклампсии, отсутствие информированного согласия женщины участвовать в исследовании. Для большей объективности полученных данных деление на группы проводили до биохимического исследования плаценты.
Материалом исследования служили 32 плаценты, взятые сразу после родов в сроки 39–40 недель. Средняя масса плацент в контрольной группе составила 420±38 г (диаметр 18–20 см), в основной – 530±40 г (диаметр 22–24 см). Микроскопические исследования выявили в плацентах женщин основной группы наличие участков кальциноза, фиброза, гиперваскуляризацию ворсин, мелкие межворсинчатые кровоизлияния и лимфоцитарную инфильтрацию. В последах пациенток контрольной группы видимых изменений материнской и плодовой поверхностей не обнаружено, в ряде случаев отмечались небольшие участки фибриноидных масс, умеренная гиповаскуляризация, незначительные лимфоцитарные инфильтрации децидуальной ткани.
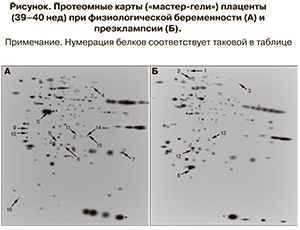 Протеомные карты плацентарной ткани получали с помощью высокоразрешающего двумерного электрофореза в полиакриламидном геле (приборы Protein IEF Cell и Protean II xi Multi-Cell, «Bio-Rad», США) с последующим окрашиванием белков азотнокислым серебром [9]. При анализе фореграмм использовали пакет программ PDQuest («Bio-rad», США). После вырезания белкового пятна из геля и процедуры трипсинолиза идентификацию белков проводили методом времяпролетной масс-спектрометрии с матрично-ассоциированной лазерной десорбцией/ионизацией (matrix-assisted laser desorption/ ionization time-of-flight mass spectrometry – MALDI-TOF-MS) [10]. Масс-спектры триптических пептидов получали на масс-спектрометре Autoflex II («Bruker», Германия) и анализировали с использованием опции Peptide Fingerprint программы Mascot MS Search (Matrix Science, США) и баз данных NCBI и Swiss-Prot, принимая точность определения массы ионов равной 0,01% и допуская возможность модификации цистеина акриламидом и окисление метионина. Достоверность идентификации рассчитана по покрытию аминокислотной последовательности белка совпадающими пептидами.
Протеомные карты плацентарной ткани получали с помощью высокоразрешающего двумерного электрофореза в полиакриламидном геле (приборы Protein IEF Cell и Protean II xi Multi-Cell, «Bio-Rad», США) с последующим окрашиванием белков азотнокислым серебром [9]. При анализе фореграмм использовали пакет программ PDQuest («Bio-rad», США). После вырезания белкового пятна из геля и процедуры трипсинолиза идентификацию белков проводили методом времяпролетной масс-спектрометрии с матрично-ассоциированной лазерной десорбцией/ионизацией (matrix-assisted laser desorption/ ionization time-of-flight mass spectrometry – MALDI-TOF-MS) [10]. Масс-спектры триптических пептидов получали на масс-спектрометре Autoflex II («Bruker», Германия) и анализировали с использованием опции Peptide Fingerprint программы Mascot MS Search (Matrix Science, США) и баз данных NCBI и Swiss-Prot, принимая точность определения массы ионов равной 0,01% и допуская возможность модификации цистеина акриламидом и окисление метионина. Достоверность идентификации рассчитана по покрытию аминокислотной последовательности белка совпадающими пептидами.
Сравнительный анализ протеомных карт осуществляли по виртуальным интегрированным «мастер-гелям» двумерных электрофореграмм плаценты (программа PDQuest). Статистическую обработку данных осуществляли с использованием лицензионного пакета программ Statistica (версия 6.0. фирмы StatSoft. Jnc.) и Excel-2007. Достоверность различий между сравниваемыми группами для каждого белка отличия определяли с помощью χ2-критерия и четырехпольных таблиц сопряженности, используемых при анализе качественных признаков. Результаты оценивали как статистически значимые при p<0,05.
Результаты исследования и обсуждение
Проведенный двумерный электрофорез позволил установить значительную гетерогенность протеомного профиля плаценты, которая проявляется в достаточно сложном электрофоретическом спектре (200–230 электрофоретических фракций в диапазоне молекулярных масс от 12 до 80 кДа и изоэлектрическими точками 3,0–10,0) (рисунок). Результаты исследования представлены в виде таблицы, включающей идентифицированные с помощью времяпролетной масс-спектрометрии белки с указанием их молекулярных масс, изоэлектрических точек и номеров в базе данных Swiss-Prot (таблица).
Среди идентифицированных экспрессирующихся протеинов плаценты особое место занимают белки, ответственные за дифференцировку, пролиферацию клеток, апоптоз, а также обладающие антиоксидантными, антикоагуляционными свойствами, функциями шаперонов и трансдукторов клеточной сигнализации. Проведенный анализ позволил определить белки различной клеточной и субклеточной локализации, большая часть которых характерна для внутриклеточных органелл и цитоплазмы, меньшую часть составляют белки мембран и цитоскелета, причем значительное число из них обнаруживаются в обеих группах женщин.
В то же время сопоставление белкового состава плаценты при нормальной беременности и осложненной преэклампсией позволило выявить различную частоту обнаружения ряда белков (белки отличия). Так, при преэклампсии обнаружено снижение экспрессии 21 белка (с молекулярной массой 15—154 кДа и изоэлектрическими точками 4,0—9,1) по сравнению с контрольной группой, из которых нами идентифицировано 8. К этим белкам относятся цитоплазматический актин 1, две изоформы α-тропомиозина, субъединица 2 комплекса Arp 2/3 (actin-related protein — актин-подобный белок), играющие важную роль в поддержании функций цитоскелета. Немышечные изоформы актина входят в состав цитоплазматических структур в виде микрофиламентов, которые участвуют в передаче сигнала с поверхности клетки в ядро, а также в регуляции экспрессии генов путем реакций реорганизации хроматина [11]. В свою очередь, α-тропомиозин, связываясь с актиновыми филаментами, обеспечивает миграцию клеток, цитокенез, процессы клеточной пролиферации и апоптоза [12]. Субъединица 2 комплекса Arp 2/3, соединяясь с другими структурными полипептидами, составляет центральное звено в передаче ряда важных внеклеточных сигналов, в том числе сигнала, вызывающего ядерную полимеризацию актина [13]. Резкое снижение продукции этого белка может сопровождаться угнетением регуляции транскрипции РНК-полимеразой II, которую комплекс Arp 2/3 осуществляет в физиологических условиях [14].
В белковом паттерне плаценты при преэклампсии не обнаружены также две изоформы 20S протеасомы (α-субъединица 6-типа), осуществляющей специфический протеолиз, ответственный за интенсивность катаболической фазы плацентарного метаболизма [15] и фосфолипид-связывающий мембранный белок аннексин А4, который участвует в регуляции таких процессов как гомеостаз кальция, адгезия, экзоцитоз, дифференцировка трофобласта, функционирование зрелых ворсин [16]. Помимо этого роль аннексина А4 в обеспечении проницаемости клеточных мембран может быть причиной нарушения трансмембранных процессов при снижении его экспрессии. Несомненный вклад в ухудшение молекулярно-клеточных механизмов регуляции метаболических процессов в плаценте при преэклампсии вносит также угнетение экспрессии 60S кислого рибосомального белка, необходимого для осуществления процессов трансляции [17].
Снижение в плаценте экспрессии вышеуказанных белков, выполняющих различные регуляторные функции, очевидно, имеет большое значение в развитии основных функциональных проявлений преэклампсии.
Развитие преэклампсии, кроме того, сопровождается появлением дополнительных 9 белков отличия (идентифицировано 7) с молекулярной массой 15–105 кДа и изоэлектрическими точками 4,8–7,9.
Повышенная экспрессия при преэклампсии пероксиредоксина-4 и митохондриальной аконитатгидратазы играет важную роль в модификации свободнорадикальных процессов и редокс-статуса плаценты [18]. Митохондриальный фермент аконитатгидратаза влияет на интенсивность образования первичных активных форм кислорода при окислительном стрессе, сопровождающем, как известно, развитие преэклампсии [19]. Усиление данных реакций происходит путем изменения степени восстановления электронов дыхательной цепи в митохондриях плаценты.
Что касается пероксиредоксина-4, относящегося к семейству многофункциональных тиолсодержащих пероксидаз, то этот белок может также выполнять сигнальную функцию, регулируя пути клеточной трансдукции благодаря способности к редокс-чувствительным конформационным переходам [20]. Возможность глубоких изменений в указных процессах подтверждают наши данные о динамике в плаценте ДНК-связывающей активности NF-kB, который является редокс-регулируемым транскрипционным фактором [21]. ДНК-связывающая активность NF-kB в плаценте женщин с беременностью, осложнившейся преэклампсией, повышена в среднем на 20% (9,73 ед/мг белка) по сравнению с таковой при физиологической беременности (7,78 ед/мг белка), что, по-видимому, приводит к редокс-зависимой регуляции транскрипции генов, ответственных за синтез провоспалительных цитокинов, хемокинов, белков адгезии и впоследствии к развитию эндотелиальной дисфункции.
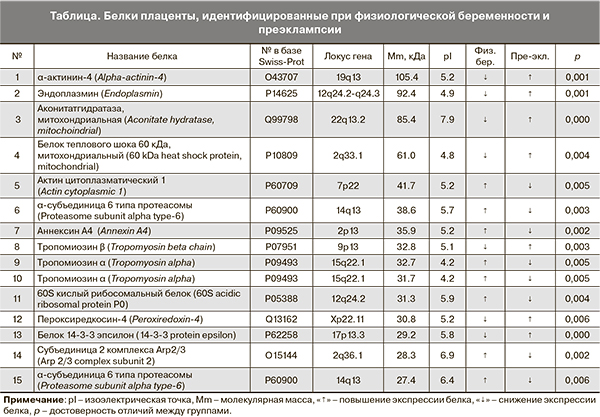
Негативное действие на состояние метаболических процессов в ткани плаценты оказывает также повышение при преэклампсии продукции α-актинина-4, образующего с ядерным фактором NF-kB мультимолекулярный комплекс, который принимает участие в усилении экспрессии проапоптических генов [22].
Появление белка 14-3-3 эпсилон, относящегося к семейству важных многофункциональных белков, модулирует эффекторное влияние таких биорегуляторов, как трансформирующий фактор роста-β и фактор некроза опухолей-α, что может приводить к усилению процессов апоптоза [23]. К числу белковых молекул с усиленной экспрессией при преэклампсии относится митохондриальный белок теплового шока 60 (Hsp60) и эндоплазмин – кальций-связывающий белок, которые являются молекулярными шаперонами, контролирующими процессы ремоделирования нативного состояния регуляторных белков [24, 25]. Роль такой динамики продукции этих белков при осложненной преэклампсией беременности, возможно, имеет компенсаторный характер и направлена на поддержание корректного фолдинга ряда белков, в том числе индуцибельных ферментов.
В таблице также приведена совокупность генов, обеспечивающих экспрессию выявленных нами белков отличия плаценты (данные анализа в интегрированных базах данных – GeneSorter, UCSC GenomeBrowser, Unigene), которая может составить генетическую карту предрасположенности к нарушению функционально-метаболической полноценности плаценты и предрасположенности к развитию изучаемого осложнения гестации.
Изменение экспрессии белков плаценты при преэклампсии находит свое отражение и в модификации их спектра в околоплодных водах, для которых плацента является основным источником полипептидов [26]. Причем выявленные нами изменения обнаруживаются уже во втором триместре гестации и сохраняются в третьем триместре [27]. Эти данные позволяют с большой долей вероятности полагать, что нарушение продукции многих белков в плаценте имеет место не только в конце беременности, но и на более ранних ее сроках.
Заключение
Таким образом, материалы настоящего исследования свидетельствуют о том, что развитие преэклампсии происходит на фоне изменения плацентарной продукции ряда регуляторных белков. Поскольку именно белки реализуют информационную программу клеток, результаты проведенного протеомного анализа позволяют расширить наши представления о молекулярных механизмах развития преэклампсии, по-прежнему занимающей одно из ведущих мест в структуре материнской и перинатальной заболеваемости.



