Большое значение в развитии патологических состояний во время беременности отводится недифференцированной дисплазии соединительной ткани (нДСТ). Различные проявления данной патологии могут быть причиной осложненного течения беременности, родов и раннего неонатального периода 1, 2].
Одними из частых осложнений течения беременности при нДСТ являются плацентарная недостаточность, хроническая гипоксия плода и/или задержка его развития [3, 4–6].
По данным ряда авторов [2–7], у пациенток с признаками нДСТ рождаются дети с более низкими массо-ростовыми показателями и с более низкой оценкой состояния по шкале Апгар, чем у детей, матери которых не имеют каких-либо фенотипических признаков проявления нДСТ. Так, по мнению А.В. Клеменова и соавт. [8], у матерей с нДСТ различной степени тяжести достоверно чаще рождаются дети с задержкой внутриутробного развития. Следует отметить, что синдром задержки роста плода рассматривают как массу плода при рождении ниже десятого процентиля для данного срока беременности.
Учитывая вышеизложенное, интерес представляет возможность предикции задержки роста плода у беременных с нДСТ.
Цель исследования: создание математической модели для прогнозирования задержки роста плода у пациенток с нДСТ.
Материал и методы исследования
Проведено когортное проспективное исследование, в которое была включена 201 беременная женщина. Всем пациенткам оценивали степень выраженности нДСТ с использованием модифицированной балльной шкалы (таблица).
Критериями включения пациенток были: наличие признаков нДСТ, возраст от 18 до 45 лет, одноплодная доношенная беременность. Критерии исключения: дифференцированные формы ДСТ, тяжелая экстрагенитальная патология, многоплодная беременность.
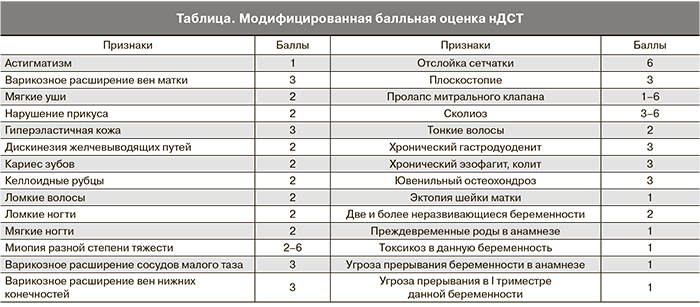
У всех включенных в исследование женщин был проведен анализ акушерско-гинекологического анамнеза и соматического здоровья, а также изучение здоровья новорожденных.
При оценке показателей физического развития новорожденных пользовались перцентильной шкалой Фентона [9]. В соответствии с данной шкалой, в качестве нормального развития принимали показатели в пределах от 10 до 90 перцентилей. Критерием задержки развития плода является снижение массо-ростовых показателей, входящих в интервал ниже 10 перцентилей для соответствующего гестационного возраста.
На основании перцентильной оценки массы новорожденных было проведено разделение пациенток на 2 группы в зависимости от массы новорожденных, их роста и гестационного срока при родоразрешении. Основная группа сформирована из 63 женщин, дети которых оценивались от 3 до 10 перцентилей. Группу сравнения составили 138 пациенток, дети которых вошли в интервал от 10 перцентилей и более. Следует отметить, что часть пациенток не были обследованы на наличие гестационного сахарного диабета, в связи с чем решено этих пациенток не включать в отдельную группу.
Выделение ДНК проводилось по методу R. Higuchi 10]: 0,5 мл крови (в качестве антикоагулянта взятой на EDTA) смешивали в 1,5 мл микроцентрифужных пробирках типа Эппендорф с 0,5 мл лизирующего раствора, состоящего из 0,32 М сахарозы, 10 мМТрис-HCl рН 7,5, 5 мМMgCl, 1% тритона Х-100, центрифугировали в течение 1 мин. при скорости 10 000 об/мин. Супернатант удалялся, а осадки клеточных ядер два раза отмывали указанным буфером. Последующий протеолиз проводили в 50 мкл буферного раствора, содержащего 50 мМ Cl, 10 мМТрис-HCl рН 8,3, 2,5 мМ MgCl, 0,45% NP40, 045% Tween 20 и 250 мкг/мл протеиназы К при 37°С в течение 20 мин. Инактивация протеиназы К проходила при 98°С в течение 20 мин. Полученные образцы ДНК хранили при -20°С до типирования. Концентрация ДНК, определенная на ДНК-минифлуориметре («Ноеfer», США), в среднем составляла 50–100 мкг/мл.
Статистическая обработка данных выполнена на персональном компьютере с помощью пакета прикладных программ Statistica for Windows 10.0 (StatSoftInc, США). Все полученные количественные клинико-анамнестические, лабораторные и инструментальные данные обработаны методом вариационной статистики. Встречались дискретные и бинарные типы данных.
Связь между изучаемыми показателями оценивалась по результатам корреляционного анализа с вычислением коэффициента корреляции Пирсона (R) или Спирмена (r) и последующим установлением его значимости по критерию t.
Эффективность различных моделей оценивались при помощи ROC-анализа с подсчетом чувствительности (Se=а/(а±с)) и специфичности (Sp=d/(b±d)). Точки отсечки предложенной модели определялась при максимальной чувствительности и специфичности.
Результаты исследования и обсуждение
 Для определения вклада клинико-анамнестических данных в развитие задержки роста плода было проведено изучение анамнеза, клинической характеристики и течения настоящей беременности исследуемых беременных. Анализ массо-ростовых соотношений у обследованных беременных отклонений от популяционных норм не выявил, средняя масса тела в основной группе составляла 61,2±2,3 кг, средний рост 166,3±4,1 см, в контрольной группе – 61,0±2,2 кг и 170,1±3,9 см соответственно. Массо-ростовой коэффициент составил 22,2 и 21,1 соответственно.
Для определения вклада клинико-анамнестических данных в развитие задержки роста плода было проведено изучение анамнеза, клинической характеристики и течения настоящей беременности исследуемых беременных. Анализ массо-ростовых соотношений у обследованных беременных отклонений от популяционных норм не выявил, средняя масса тела в основной группе составляла 61,2±2,3 кг, средний рост 166,3±4,1 см, в контрольной группе – 61,0±2,2 кг и 170,1±3,9 см соответственно. Массо-ростовой коэффициент составил 22,2 и 21,1 соответственно.
При изучении состояния здоровья исследуемых беременных с анализом соматического и гинекологического анамнеза и степенью тяжести нДСТ, было выявлено, что в основной группе медиана выраженности нДСТ была выше, чем в группе сравнения, и составила 9 баллов против 7.
При анализе структуры заболеваний ЛОР-органов у пациенток основной группы превалировал фарингит – 17,5% (OR=11,8; CI=2,7-51,3), острый и хронический отит – 7,9% (OR=2,5; CI=1,1-20,1) и 11,1% (OR=5,3; CI=1,1-30,7) соответственно. По другим заболеваниям достоверных различий выявлено не было. Также интерес представляет изучение заболеваний сердечно-сосудистой системы. Было установлено, что частота пролапса митрального клапана, нейроциркуляторной дистонии и варикозной болезни в основной группе была выше, чем в группе сравнения, и составила 17,5% (OR=1,9; CI=0,5-4,9), 34,9%, (OR=1,9; CI=1,1-7,2) и 50,8% (OR=1,9; CI=1,1-7,9) соответственно. Миопия в основной группе встречалась у каждой 3-й пациентки и составила 38,1%, с превалированием миопии средней – 14,3% (OR=1,7; CI=1,1-12,1) и высокой степени – 12,7% (OR=2,3; CI=1,2-6,9). Частота миопии слабой степени в основной группе была ниже и составила 11,1% (OR=0,6; CI=0,3-1,5). При изучении патологии органов мочевыделительной системы у пациенток основной группы достоверно чаще диагностировался хронический цистит – 20,6% (OR=2,8; CI=1,3-5,9). Анализ заболеваний желудочно-кишечного тракта выявил, что у пациенток основной группы достоверно чаще встречалась желчнокаменная болезнь, частота которой составила 7,9% (OR=3,8; CI=1,1-13,6).
У каждой второй пациентки основной группы в анамнезе было абдоминальное родоразрешение, частота которого составила 46,0% (OR=7,1; CI=2,3-29,2). Различий в частоте самопроизвольных родов по группам не выявлено (27,3 и 25,9% соответственно). Следует обратить внимание на достоверные различия по наличию в анамнезе неразвивающихся беременностей и абортов, составившие 17,5% (OR=2,6; CI=1,4-3,9) и 27,0% случаев (OR=2,1; CI=1,2-5,1) соответственно по группам. В основной группе внематочная беременность диагностировалась в 6 раз чаще и составила 9,5% (OR=7,1; CI=1,4-58,3).
Таким образом, несмотря на сопоставимость по исходной клинической характеристике обследованных пациенток, анализ последней установил более высокую частоту отягощенного акушерского и гинекологического анамнеза у пациенток основной группы.
При изучении течения I триместра настоящей беременности у пациенток достоверных различий не выявлено. Однако в основной группе угрозу прерывания беременности отмечали в 1,5 раза чаще – 42,9% (OR=1,5; CI=0,8-3,6). Анализ течения II триместра выявил достоверное увеличение у данных пациенток частоты угрозы прерывания беременности – 39,7% (OR=1,7; CI=1,1-4,8), с формированием истмико-цервикальной недостаточности в 8 (14,2%) случаях, требующей хирургической коррекции. В основной группе в 3 раза чаще диагностировали плацентарную недостаточность, что можно объяснить критериями включения в исследование. Также в основной группе достоверно чаще отмечали обострение хронического пиелонефрита при беременности – 9,5% (OR=9,1; CI=2,4-76,8).
Следует отметить, что наиболее информативным был анализ III триместра беременности. В основной группе пациенток достоверно чаще отмечали угрозу преждевременных родов – 23,8% (OR=2,0; CI=1,1-3,9) и гипоксию плода – 27,0% (OR=2,6; CI=1,3-5,1), а также преэклампсию – 7,9% (OR=1,7; CI=0,6-4,1) и патологию околоплодных вод – 19,0% (OR=1,4; CI=0,6-2,6). При этом частота многоводия составила 7,9% (OR=1,3; CI=0,3-3,2), а маловодия – 11,1% (OR=1,3; CI=0,1-3,1).
В зарубежных исследованиях отмечено [11, 12], что наиболее частыми причинами рождения детей с низкими массо-ростовыми показателями являются обострение инфекционных заболеваний во время беременности и развитие плацентарной недостаточности. Опираясь на указанные данные, мы проводили анализ полиморфизмов ряда генов провоспалительных цитокинов: интерлейкина IL1 (-31 T>C), IL6 (-174 C>G) и IL10 (592 >C), а также полиморфизма генов роста сосудов эндотелия, таких как VEGFA (936 C>T) и VEGFA (-634 >C).
При анализе генотипа IL1 (-31 T>C) было выявлено, что генотип T/T достоверно чаще встречался в основной группе – 63,5% (OR=2,4; CI=1,1-5,9). Также проводили анализ встречаемости аллеля Т в изучаемых группах, выявляли достоверное увеличение частоты встречаемости данного аллеля в основной группе, которое составило 79,4% (OR=2,4; CI=1,3-4,8).
При анализе полиморфизма IL6 (-174 C>G) было выявлено, что генотип C/C достоверно чаще встречался в основной группе – 39,7% (OR=2,6; CI=1,2-6,5). Частота генотипа G/G была ниже и составила 17,5% (OR=0,6; CI=0,1-1,1). При анализе встречаемости аллеля G было установлено достоверное увеличение частоты до 79,4% (OR=2,2; CI=1,1-5,1).
При анализе полиморфизма гена IL10 (592 A>C) было выявлено, что генотип C/C достоверно чаще встречался в группе сравнения 17,7% (OR=0,6; CI=0,2-0,9). Следует отметить, что распределение аллелей в группах статистически не отличалось между собой.
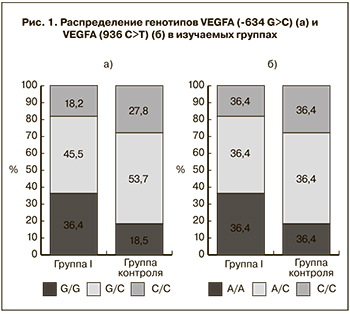
Кроме того, выявляли достоверные различия в группах при изучении генотипа VEGFA (-634 G>C). Было установлено, что генотип G/G достоверно чаще встречался в основной группе – 36,5% (OR=2,5; CI=1,2-5,7). Также была выявлена более высокая частота носительства аллеля G – 79,4% (OR=1,7; CI=1,1-4,8), распределение генотипа представлено на рис. 1.
При анализе генотипа VEGFA (936 C>T) в основной группе генотип T/T отсутствовал. При изучении встречаемости аллелей было выявлено, что аллель C встречается чаще в основной группе – 84,1% (OR=2,4; CI=1,1-5,7). Учитывая полученные результаты для определения факторов риска задержки роста плода при доношенном сроке беременности, проводили корреляционный анализ, включающий клинико-анамнестические и молекулярно-генетические данные. При этом была установлена взаимосвязь между массой плода при рождении со следующими показателями: прямая слабая зависимость с выраженностью балльной оценки нДСТ (R=0,2; p<0,05); прямая слабая зависимость с угрозой прерывания во II триместре беременности (R=0,2; p<0,05); прямая слабая зависимость с обострением хронических заболеваний органов мочевыделительной системы во II триместре беременности (R=0,2; p<0,05), прямая средняя зависимость с угрозой преждевременных родов (R=0,3 p<0,05), прямая средняя зависимость с задержкой развития плода (R=0,4; p<0,05). Анализ взаимосвязи массы плода от результатов молекулярно-генетических исследований выявил слабую обратную зависимость с генотипом VEGFA: -634 G>C (R=-0,3; p<0,05) и прямую слабую зависимость с генотипом VEGFA: 936 C>T (R=0,2; p<0,05).
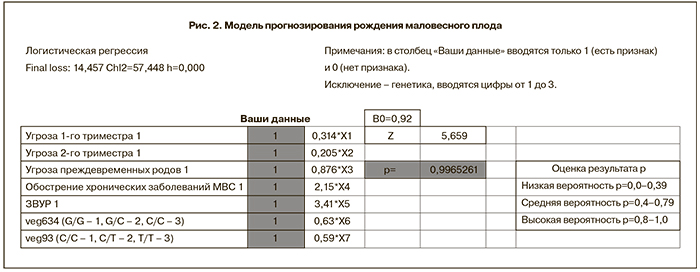
Применив метод бинарной логистической регрессии, с учетом клинико-анамнестических и молекулярно-генетических данных, определяли вероятность развития рождения ребенка с низкими массо-ростовыми показателями по формуле:
P = 1/(1±e-z)
где е – основание натурального логарифма и имеет значение 2,71828182845904;
z=0,93 ± 0,314*Х1 ± 0,205*Х2 ± 2,15*ХЗ ± 0,876*Х4 ± 3,41*X5 ± 0,63*Х6 ± 0,59*Х7;
где X1 – выраженность балльной оценки нДСТ (0 – выраженность баллов от 0 до 9 включительно; 1 – 10 баллов и выше), X2 – угроза прерывания во втором триместре, X3 – обострение хронических заболеваний мочевыделительной системы, X4 – угроза преждевременных родов, X5 – задержка роста плода, X6 – полиморфизм гена VEGFA: -634 G>C (G/G кодируется как 1, G/C – 2, C/C – 3), X7 – полиморфизм гена VEGFA: 936 C-T (C/C кодируется как 1, C/T – 2, T/T – 3).
Используя 90 и 10% перцентили, определяли границы степени вероятности рождения маловесного плода.
На основании этого были сформированы 3 группы пациенток:
- с низкой вероятностью (р≤10%): z=0,0-0,4;
- с умеренной вероятностью (р составил от 10 до 90%): z=0,4-0,8;
- с высокой вероятностью: z=0,8-1,0.
На основе программы Excel была создана модель прогнозирования рождения маловесных детей. Факторы риска вводятся в соответствии с его наличием (0 – отсутствует фактора, 1 – фактор присутствует). Данная модель имеет чувствительность 72% и специфичность 78%. Образец модели представлен на рис. 2.
Заключение
Таким образом, на основании проведенного исследования и совокупного применения молекулярно-генетических и статистических методов создана модель прогнозирования задержки роста плода у беременных с нДСТ, которая может быть использована в клинической практике для улучшения перинатальных исходов.



