Гнойно‐септические заболевания послеродового периода остаются одной из актуальных проблем современного акушерства во многих странах. Послеродовой эндометрит (ПЭ) является наиболее распространенной формой послеродовой инфекции и вместе с тем одной из основных причин развития генерализованных форм инфекционного процесса, обусловливающих материнскую смертность [1–3]. Частота эндометрита после самопроизвольных физиологических родов составляет 1–5%, после патологических – 15–20%, после кесарева сечения – свыше 20% [4], у женщин с высоким инфекционным риском она достигает 80,4%. Даже при проведении антимикробной профилактики в родах частота данного осложнения остается достаточно высокой (от 0,06 до 10,6% после родов и от 8,8 до 35,3% после кесарева сечения) [1, 5–7].
Согласно современным данным, основными причинами роста частоты ПЭ являются изменение видового состава микробной флоры, возникновение агрессивных форм бактериальной инфекции, перераспределение значимости предрасполагающих факторов в связи с увеличением числа оперативных вмешательств в родах, широкое внедрение антибиотиков и нередко их нерациональное использование. Использование антибиотиков при лечении инфекционной патологии в акушерстве позволило добиться снижения частоты тяжелых форм гнойно‐воспалительных заболеваний, но на современном этапе одной из центральных проблем антимикробной терапии стала антибиотикорезистентность [8–10].
Высокая частота инфекционных осложнений послеродового периода и резистентность патогенной микрофлоры к проводимой терапии требуют разработки новых подходов к профилактике ПЭ.
Цель исследования: снижение частоты ПЭ у родильниц группы инфекционного риска на основе изучения патогенной флоры и иммунологических тестов с применением внутриматочного введения сорбента.
Материал и методы исследования
В исследование были включены 117 беременных высокого инфекционного риска, которые в послеродовом периоде были разделены на 2 группы: I – основная (n=49) и II – группа сравнения (n=68). Группы были сопоставимы по возрасту, данным соматического и акушерско-гинекологического анамнеза. Рандомизация производилась по четным и нечетным числам госпитализации в стационар.
Критериями включения служили добровольное информированное согласие пациенток, наличие хронического и острого многоводия на этапе беременности, обострение генитальных и экстрагенитальных заболеваний инфекционной природы во время беременности. Критериями исключения из данной группы были здоровые беременные, пациентки с активным течением специфических инфекционных (туберкулез, вирусные гепатиты B, C) и венерических (сифилис, гонорея, хламидиоз) заболеваний.
Родильницам основной группы в послеродовом периоде для профилактики инфекционных осложнений внутриматочно вводился формованный сорбент одновременно с внутривенным введением антибиотика. Размер пористого углеродного аппликатора: длина 6 см, ширина 1 см, толщина 1 см. В группе сравнения проводилась только традиционная антибиотикопрофилактика послеродовых гнойно-септических осложнений.
Формованный сорбент произведен ФГБУ науки Институт проблем переработки углеводородов Сибирского отделения РАН (директор – доктор химических наук, профессор, член-корреспондент РАН В.А. Лихолобов). Регистрационное удостоверение № ФСР 2008/03492 от 1 марта 2010 года – изделие медицинского назначения, разрешено к производству и продаже на территории Российской Федерации. Токсикологическое заключение № 219-08 от 28.08.2008: не токсичен, стерилен, апирогенен, отвечает требованиям нормативной документации. В качестве местного аппликационного средства сорбции использовался в абдоминальной хирургии [6], в акушерской практике применяется впервые. Исследование одобрено этическим комитетом, выписка из протокола № 51 от 10.10.2012.
Оценка микрофлоры родовых путей у пациенток проводилась методом полимеразной цепной реакции (ПЦР): аспираты из полости матки (реагенты и оборудование ООО «Литех», ООО «Интерлабсервис», «ДНК-технология», Москва). Микробиологическое исследование проводилось по стандартной методике, а также с использованием коммерческих тест-систем Genitalsystem и MycoplasmaSystemPlus (производство компании «Liofilchem», Италия). Материалом для исследования служило отделяемое влагалища, цервикального канала, аспират из полости матки. Забор материала осуществлялся в асептических условиях. При проведении аспирата из полости матки использовались стерильные проводники в виде силиконовой трубки, исключающие возможность загрязнения пробы вагинальной и цервикальной микрофлорой.
Определение субпопуляционного состава лимфоцитов проводилось на проточном цитофлюориметре Cytomics FC 500 с пробоподготовкой образцов на станции TQ-Prep (оборудование компании «Beckman-Coulter», США), а содержание цитокинов – методом иммуноферментного анализа на тест-системах производства компаний ООО «Протеиновый контур» (Санкт-Петербург) и ЗАО «Вектор-Бест» (Новосибирская обл.).
Электронная микроскопия проводилась в Государственном научном центре вирусологии и биотехнологии «Вектор» методом атомно-силовой микроскопии (Solver P47Bio, NT-MDT, Россия) в полуконтактном режиме. Зонды NSG 30 производства фирмы NT-MDT, радиус острия 10 нм.
Статистическая обработка материала осуществлялась с помощью пакета прикладных программ STATISTIСA-6, стандартных математических таблиц Microsoft Excel. Для характеристики показателей, посвященных ретроспективному анализу историй родов беременных, использовались: непараметрический дисперсионный анализ Краскела–Уоллиса, однофакторный дисперсионный анализ для независимых выборок и статистика Кульбака. Для статистической обработки иммунологических исследований дополнительно был использован тест Манна–Уитни. Для отбора наиболее информативных признаков был использован точный критерий Фишера. Информативность каждого из диагностических коэффициентов рассчитывалась по формуле Кульбака.
Результаты исследования и обсуждение
Проведенный анализ гинекологических заболеваний у родильниц группы инфекционного риска показал, что наиболее часто встречались воспалительные заболевания органов малого таза – у 49,6% наблюдаемых; острый вагинит был отмечен у 38,5%; цервицит – у 23,9%; перенесенные оперативные вмешательства на маточных трубах зарегистрированы у 8,5%; нарушения менструального цикла – у 7,7%; миома матки – у 3,4%; бесплодие в анамнезе встречалось у 3,4% женщин.
Среди экстрагенитальной патологии у данной группы пациенток преобладали анемии (59,0%); на втором месте по частоте были хронические воспалительные заболевания мочевыводящих путей (27,4%); ожирение (17,1%); артериальная гипертензия (10,3%); патология щитовидной железы (5,1%); сахарный диабет в 2,6% случаев.
При проведении сонографического исследования во время беременности были выявлены следующие маркеры внутриутробного инфицирования: маловодие диагностировалось в 42,9% случаев; нарушение плодово-плацентарного кровотока – в 39,5%; многоводие – в 17,9%; утолщение плаценты, превышающее соответствующие нормативы для данного срока беременности, выявлялось в 15,5%; пиелоэктазия у плода – в 9,5%; гиперэхогенный кишечник у плода – в 9,5%; гидроцефалия – в 1,7%; наличие кальцинатов в печени плода выявлено в 1,7% случаев.
Наиболее частым осложнением течения беременности у наблюдаемых пациенток была рецидивирующая угроза прерывания (46,7%), которая сочеталась с воспалительными изменениями во влагалище. На втором месте по частоте было преждевременное излитие околоплодных вод (42,7%). Преэклампсия разной степени тяжести встречалась у 41,9% наблюдаемых, в том числе в сочетании с задержкой роста плода в 26,5% случаев. Обострение инфекционных заболеваний мочевыводящих путей отмечено у 17,9% беременных.
Исследование вагинального биотопа у наблюдаемых пациенток на этапе беременности показало преобладание следующих микроорганизмов: Enterococcus (faecalis, faecium) – 33,9%; E. coli – 27,4%; Staphylococcus (epidermidis, haemolyticus, chromogenes) – 17,4%; дрожжеподобные грибы рода Candida – 15,8%; Ureaplasma urealyticum – 12,7%; сочетание возбудителей наблюдалось у 83,2%. В цервикальном канале наблюдался рост тех же возбудителей: Enterococcus (faecalis, faecium) – 28,2%; E. coli – 22,5%; Ureaplasma urealyticum – 10,3%. Обострение вирусной инфекции отмечалось у 33% наблюдаемых. При исследовании методом ПЦР отделяемого цервикального канала во время беременности были выявлены следующие возбудители: вирус Эпштейна–Барр – 17,2%; вирус простого герпеса (ВПГ) 6-го типа – 8,0%; ВПГ 1-го типа – 4,6%; ВПГ 2-го типа – 2,3%; цитомегаловирус – 2,3%; ротавирус – 2,3%.
При оценке иммунного статуса у беременных были получены данные, свидетельствующие о напряжении клеточного звена иммунитета, которые проявлялись в изменении соотношения лимфоцитов с фенотипом CD3+CD16+56+, CD3+4+ и CD3+8+ (р=0,001) при сниженном иммунорегуляторном индексе (р=0,0040) на фоне повышения активности провоспалительных цитокинов (интерлейкина (ИЛ)-1β и фактора некроза опухоли (ФНО)) (р=0,0001). У 33% беременных с активацией вирусной инфекции отмечается более высокий уровень Т-NK клеток (р=0,001), что по нашему мнению свидетельствует об усиленной киллерной активности лимфоидных клеток.
Всем пациенткам перед родоразрешением проводилась санация родовых путей местными антисептиками.
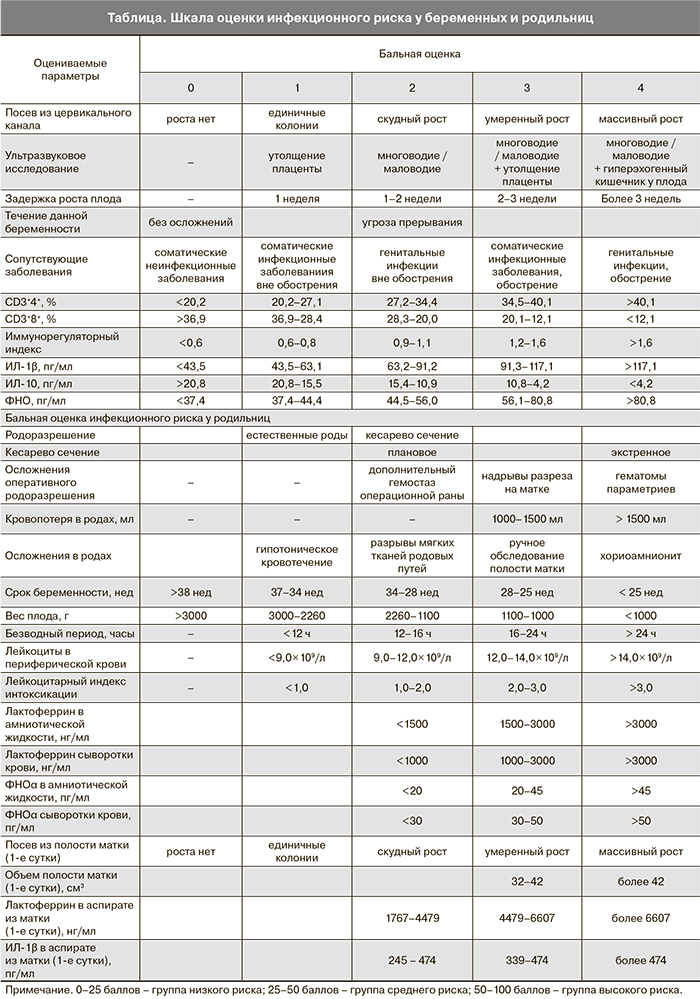
В послеродовом периоде, в первые сутки, проводился посев из полости матки с целью оценки наличия патогенной микрофлоры. По результатам первичных посевов в течение 24 ч оценивалась степень обсемененности полости матки.
По результатам первичных посевов пациентки обеих групп были сопоставимы: в основной группе массивный рост патогенной микрофлоры определялся в 67,3% случаев, умеренный – в 26,5%, скудный – в 6,1%; в группе сравнения массивный рост определялся в 55,9% случаев, умеренный – в 27,9%, скудный – в 16,2%. При этом в 29,9% случаев определялась Ureaplasma urealyticum; в 23,1% случаев – Staphylococcus (haemolyticus, chromogenes); на третьем месте по частоте выявлялся Enterococcus faecalis – 16,2%; E.coli составила 7,7%; Corynebacterium – 6,8%; Mycoplasma hominis 6,8%; Enterobacter cloacae – 2,6%; Klebsiellа и Pseudomonas aeruginosa – 1,7%.
В основной группе моноинфекция встречалась в 37,5% случаев; в группе сравнения – в 36,8%. Наиболее часто наблюдались ассоциации Enterococcus и Ureaplasma urealiticum (12,5%), Enterococcus и Staphylococcus (8,1%), Enterococcus и Candida (6,8%), Enterococcus и E. coli (2,7%).
При проведении проб на чувствительность к антибиотикам была выявлена высокая частота резистентности патогенной флоры: Enterococcus faecalis в 66,7% случаев проявлял устойчивость к азитромицину, в 47,6% – к бензилпенициллину и ко-тримоксазолу, в 42,8% – к доксициклину. Staphylococcus haemolyticus в 72,2% случаев проявлял резистентность к бензилпенициллину, в 66,7% – к эритромицину, в 55,6% – к офлоксацину и в 33,3% – к цефотаксиму. Ureaplasma urealyticum в 74,5% проявляла устойчивость к джозамицину, в 29,5% – к кларитромицину, в 22,9% – к эритромицину и в 14,8% была резистентна к клиндамицину.
На основе полученных данных была разработана шкала прогноза инфекционного риска (таблица), основанная на подсчете индивидуального количества баллов с учетом данных анамнеза, сонографического исследования, показателей иммунореактивности, как во время беременности, так и в родах [7], бактериологического исследования. При составлении шкалы использовался последовательный анализ, который основывается на теореме Т. Байеса.
В послеродовом периоде родильницам основной группы проводилась комплексная профилактическая терапия: традиционная антибиотикопрофилактика и внутриматочные аппликации формованного сорбента. Сорбент в полость матки вводился трехкратно. Длительность однократной аппликации составила 24 ч, после чего использованный сорбент извлекался и вводился новый. В то же время в группе сравнения проводилась только традиционная антибиотикопрофилактика.
Антибиотикопрофилактика в обеих группах проводилась цефалоспоринами II поколения (цефуроксим) по схеме: 1,0 г антибиотика внутривенно капельно однократно за 30 мин до начала родоразрешения [11].
У родильниц основной группы проводилось три контрольных посева из полости матки после извлечения каждого сорбента. После извлечения первого сорбента через 24 ч у 21,7% пациенток сохранялся массивный рост патогенной микрофлоры, у 43,5% был выявлен умеренный и у 34,8% – скудный рост микроорганизмов. После извлечения второго сорбента у 52,2% пациенток роста микрофлоры обнаружено не было, у 39,1% сохранялся умеренный и у 8,7% – скудный рост микрофлоры. В контроле посевов после извлечения третьего сорбента роста микроорганизмов не было выявлено в 100% случаев. У родильниц группы сравнения в контрольном посеве гравидарного эндометрия через трое суток после антибиотикопрофилактики патогенная микрофлора продолжала определяться у 66,2% родильниц.
Для подтверждения сорбционной способности формованного сорбента была проведена электронная микроскопия стержня сорбента после извлечения из полости матки.
При проведении электронной микроскопии было установлено, что большая часть поверхности стержня покрыта слоем органического материала, который, вероятно, образован микроорганизмами и выделяемыми ими продуктами, а также клеточным детритом. Рельеф слоя материала, покрывающего внешнюю поверхность стержня, аналогичен рельефу материала, покрывающего поверхность внутренних каналов сечения. На поверхности сорбента представлены микроорганизмы и их фрагменты преимущественно сферической (Ureaplasma urealyticum, Staphylococcus) и овоидной формы (Enterococcus, E. coli).
Проблема профилактики и лечения гнойно-воспалительных послеродовых заболеваний осложняется и тем, что накапливающиеся при воспалительном процессе в полости матки провоспалительные цитокины, а также токсины, выделяемые возбудителями, приводят к нарушению процессов местного гемостаза, снижению перфузии ткани и к дополнительному развитию гипоксии ткани, затрудняя регенерацию и эпителизацию эндометрия. В связи с этим проводилось определение уровня провоспалительных цитокинов и лактоферрина в аспирате из полости матки. Забор материала проводился до начала и после завершения профилактической терапии. Также оценивался объем полости матки, ультразвуковое исследование проводилось на 1-е и 3-и сутки послеродового периода.
При анализе полученных данных отмечено достоверное (р=0,01172) снижение активности острофазового белка лактоферрина в 1,3 раза и провоспалительного цитокина ИЛ-1β в 2,3 раза (р=0,01252) в аспирате из полости матки у пациенток основной группы в сравнении с аналогичными показателями группы сравнения. Уровень ИЛ-6 в группах значимо не изменялся. Показатели количества лейкоцитов и лейкоцитарного индекса интоксикации периферической крови после проведенного профилактического лечения одинаково снижались в обеих группах. В основной группе после использования формованного сорбента отмечено уменьшение объема полости матки в 1,2 раза, в то время как при применении традиционной антибиотикопрофилактики имело место уменьшение объема полости матки в 1,05 раза.
Выводы
- В развитии гнойно-воспалительных заболеваний у родильниц группы инфекционного риска наибольшее значение имеет микст-инфицирование, при котором ведущая роль в формировании патологии принадлежит бактериальной грамположительной микрофлоре с высоким уровнем антибиотикоустойчивости, в результате чего традиционная антибиотикопрофилактика оказывается малоэффективной.
- Для беременных группы инфекционного риска доказано наличие напряжения иммунной системы вследствие перенесенных во время беременности воспалительных заболеваний генитального тракта или обострения соматических хронических инфекционных заболеваний.
- После проведения традиционной антибиотикопрофилактики, несмотря на снижение лейкоцитов и лейкоцитарного индекса интоксикации в периферической крови, в посевах из полости матки продолжает определяться патогенная микрофлора более чем в 50% случаев, и в то же время сохраняется высокая активность местных провоспалительных цитокинов, что свидетельствует о риске развития отсроченного, вялотекущего эндометрита.
- Предложенный способ профилактики ПЭ у родильниц с инфекционным риском с помощью внутриматочного введения формованного пористого углеродного сорбента является более эффективным по сравнению с традиционным подходом и позволяет снизить частоту ПЭ.



