Каждая прервавшаяся беременность оказывает негативное влияние на состояние репродуктивной системы, что приводит к повторяющимся ранним репродуктивным потерям. Кроме того, неуклонный рост частоты ранних потерь беременности ставит данную медицинскую проблему в разряд социальных [1, 2]. Риск развития самопроизвольного состоявшегося выкидыша (СВ) и неразвивающейся беременности (НБ) значительно повышается при активации инфекционного процесса у беременной женщины, наличии иммунодефицитных состояний, генетически детерминированных тромбофилиях, развитии ауто- и аллоиммунных процессов, нарушениях иммунобиологической гестационной толерантности, эндокринопатиях и др. [3, 4].
Согласно Международной статистической классификации болезней 10-го пересмотра (1995), под НБ понимают гибель эмбриона или раннего плода с длительной задержкой его в полости матки (шифр О02.1). В структуре репродуктивных потерь доля НБ составляет 10–20%, а среди самопроизвольного прерывания беременности на ранних стадиях – 30–50% [5, 6].
Некоторыми авторами СВ и НБ объединяются понятием эмбриоплацентарная недостаточность [7, 8].
По мнению других исследователей, общий данный термин трактуется более широко и включает в себя, помимо СВ и НБ, патологические состояния, связанные с пролонгированием беременности (плацентарная недостаточность, преэклампсия) [9, 10]. Учитывая связь нарушений процессов имплантации с большими акушерскими синдромами, уместно было бы выделить этап, предшествующий клинической реализации СВ, НБ, плацентарной недостаточности и другим осложнениям, и определить его как «эмбриоплацентарная дисфункция» (ЭПД). Различные клинические варианты эмбриоплацентарной недостаточности обусловлены генетическим кодом, характером повреждающих эндогенных и экзогенных факторов. В общем виде проявления нарушений процессов эмбриогенеза в виде ЭПД можно рассматривать как донозологический этап, предшествующий клинической реализации эмбриоплацентарной недостаточности, включающей CВ и НБ.
Зная причины и патогенез ЭПД, можно целенаправленно проводить патогенетическое лечение и реабилитацию пациенток группы высокого риска по эмбриоплацентарным потерям в догестационном периоде. Низкая эффективность восстановительного лечения после НБ обусловлена отсутствием информативной диагностики причины НБ и поздним началом реабилитационных мероприятий без учета единых патогенетических механизмов нарушения гомеостаза [11, 12]. Поиск эффективных и патогенетически обоснованных программ восстановления репродуктивного здоровья в послеабортном периоде может стать одним из резервов снижения материнской заболеваемости и благоприятного вынашивания следующей беременности [13, 14].
Цель исследования: разработка комплексной программы профилактики потери беременности ранних сроков у женщин на основе выявленных патогенетических особенностей развития данной патологии.

Материал и методы исследования
На первом этапе исследования для выявления патогенетических особенностей потери беременности ранних сроков обследованы 170 беременных женщин в сроке 7–12 недель гестации, которые были разделены на две группы в зависимости от исхода беременности: I группу составили 138 женщин с НБ, которым произведено инструментальное удаление частей плодного яйца (диагноз НБ подтверждали результатами ультразвукового исследования); II группу – 32 женщины с клинической картиной начавшегося СВ, которым не удалось сохранить беременность. Критерии отбора: срок беременности 7–12 недель, первичное невынашивание беременности, отсутствие анатомических причин невынашивания беременности, тяжелой соматической и генетической патологии. Контрольную группу составили 30 здоровых женщин, прервавших беременность путем медицинского аборта в сроке от 7 до 12 недель.
Клиническое и лабораторное обследование проводили до начала терапии и инструментального удаления НБ или изгнания плодного яйца при СВ. Всем женщинам проведено определение в крови содержания маркеров воспалительной реакции – интерлейкина (ИЛ)-1β, ИЛ-6, фактора некроза опухоли (ФНО)-α, интерферона (ИФН)-γ, С-реактивного белка (СРБ), ИЛ-4 и ИЛ-10 (противовоспалительные цитокины); маркеров функциональной активности эндометрия – α2-микроглобулина фертильности (АМГФ, гликоделин), лептин (синтезируется адипозоцитами, плацентой, желудком, мышцами и влияет на секреторную трансформацию эндометрия, функциональное состояние плодовой и материнской частей плаценты, энергетический баланс репродуктивной системы); маркеров сосудисто-эндотелиальных и гемостазиологических нарушений – фактора роста плаценты (ФРП), лимфоцитов с фенотипом CD95+ (Л CD95+), общего IgЕ (маркер эндотелиальной дисфункции, фактор регуляции сосудисто-эндотелиальной проницаемости, универсальный эффектор иммунного ответа), фибронектина (ФН), Д-димера, растворимых фибрин-мономерных комплексов (РФМК). Уровни ИЛ-1β, ИЛ-6, ФНО-α, ИФН-γ, ИЛ-4, ИЛ-10, СРБ, лептина, общего IgE, ФРП, АМГФ в сыворотке крови, плазменную концентрацию ФН определяли методом ИФА с применением наборов реагентов (ООО «Протеиновый контур»; «Вектор-Бест»; DSL (USA); «Диатех-Э»; «P/D systems»; «Pharmacia diagnostika»; «АМГФ–Фертитест», ИФА-ФН, ЗАО «НВО-Иммунотех»). Для иммунофенотипирования Л СD95+ использовался метод лазерной проточной цитометрии (цитометр Becton Dickinson FACS Calibur, компьютерная программа Cell Quest Pro). Уровень Д-димера определяли методом ELISA (ЗАО «Биохиммак»), РФМК – с применением РФМК-теста (ООО «Технология-Стандарт»). Для верификации диагноза проводилось гистологическое исследование абортивного материала.
На втором этапе исследования проведена клиническая апробация комплексной программы ведения женщин с НБ, включающей реабилитационные мероприятия после несостоявшегося выкидыша и догестационную подготовку. Обследованы и пролечены 138 женщин после прерывания НБ, которые были разделены на две группы в зависимости от характера проводимых реабилитационных мероприятий в послеабортном периоде. I группу составили 88 женщин с НБ в анамнезе, которым сразу после прерывания беременности и обследования проводилось восстановительное лечение по индивидуальной программе реабилитационных мероприятий с учетом этиологического фактора, включающее антибактериальную терапию с учетом чувствительности выделенного микробного агента, восстановление биоценоза, иммуномодулирующие средства (виферон, неовир) в течение 10 дней, энзимотерапию (вобэнзим) в течение 1 месяца, гормонотерапию (дюфастон) в течение 3 месяцев, исключение медико-социальных факторов риска НБ, индивидуальное лечение экстрагенитальной патологии. Общая продолжительность восстановительного лечения составляла 3 месяца. II группу составили 50 женщин с НБ в анамнезе, получавших традиционное послеабортное лечение, включающее антибактериальные и противовоспалительные средства. Лабораторное обследование проводилось в динамике восстановительного лечения через 14 дней и 3 месяца после прерывания беременности.
За 3 месяца до планируемой беременности подготовка к последующей с учетом индивидуальных особенностей репродуктивного статуса проведена у женщин I группы (n=88). Комбинация лекарственных средств подбиралась с учетом выявленных этиологических факторов НБ, результатов восстановительного лечения, а также включала препараты, улучшающие метаболизм (актовегин по 1 драже 3 раза в сутки, витамин Е по 400 МЕ в сутки в течение 1 месяца), гормонотерапию (дюфастон по 10 мг 2 раза в сутки во вторую фазу менструального цикла). Всем беременным групп сравнения назначался витаминно-минеральный комплекс, содержащий фолиевую кислоту.
Третий этап исследования, проведенный с целью оценки течения и исходов беременности у женщин второго этапа, включал обследование 128 беременных женщин с высоким риском невынашивания, имеющих в анамнезе одну НБ. 10 женщин (7,2%) из 138 наблюдаемых на втором этапе выбыли из дальнейшего наблюдения по причине отсутствия наступления беременности. В зависимости от характера реабилитационной программы и мероприятий в догестационном периоде были сформированы две клинические группы сравнения: I группу составили 85 беременных женщин с НБ в анамнезе, которым проведена комплексная программа реабилитационных мероприятий и прегравидарная подготовка – с учетом индивидуальных особенностей репродуктивного статуса; II группу – 43 беременные женщины с НБ в анамнезе, которым в послеабортном периоде проведено традиционное противовоспалительное лечение без последующей индивидуальной догестационной подготовки.
 У всех женщин была ранняя постановка на учет в связи с беременностью. В динамике I триместра гестации в сроки 5–7 и 8–12 недель всем беременным групп сравнения проведено полное общеклиническое, биохимическое, бактериоскопическое, бактериологическое, гемостазиологическое, иммунологическое исследования. В крови беременных женщин определяли маркеры воспалительной реакции, функциональной активности эндометрия, сосудисто-эндотелиальных и гемостазиологических нарушений.
У всех женщин была ранняя постановка на учет в связи с беременностью. В динамике I триместра гестации в сроки 5–7 и 8–12 недель всем беременным групп сравнения проведено полное общеклиническое, биохимическое, бактериоскопическое, бактериологическое, гемостазиологическое, иммунологическое исследования. В крови беременных женщин определяли маркеры воспалительной реакции, функциональной активности эндометрия, сосудисто-эндотелиальных и гемостазиологических нарушений.
В случае лабораторной диагностики ЭПД проводилось превентивное лечение, которое включало энзимотерапию (вобэнзим по 3 табл. 3 раза в сутки в течение 3 недель), препараты магния (магне В6 по 2 табл. 3 раза в сутки в течение 1 месяца), антиоксиданты (витамин Е по 400 МЕ в сутки в течение 1 месяца), гестагены (дюфастон по 10 мг 2 раза в сутки до 20 недель гестации). Данный этап позволил оценить клиническую эффективность программы восстановительного лечения после НБ, обосновать проведение профилактики ранних репродуктивных потерь в период гестации.
Статистическая обработка данных была произведена с помощью программ MedCalc statistical software 14 и OriginPro 8.1. Анализ на нормальность распределений значений был проведен с помощью критериев Шапиро–Вилка и Лиллифорс. Результаты подвергали статистической обработке с использованием параметрических (среднее арифметических величин (М) и их среднее квадратическое отклонение (М±δ), критерий Фишера–Стьюдента (t)) и непараметрических (медиана (Ме) и межквартильный интервал (LQ – нижний (25-й) квартиль, HQ – верхний (75-й) квартиль), U-критерий Манна–Уитни, коэффициент ранговой корреляции Спирмена (k)) критериев. Критический уровень достоверности нулевой статистической гипотезы принимали равным 0,05. Информативность диагностических исследований оценивалась чувствительностью, специфичностью, предсказательной ценностью положительного и отрицательного результатов, диагностической точностью; оценка эффективности профилактических мероприятий объективизировалась стандартами доказательной медицины [15].
Результаты исследования и их обсуждение
Полученные в ходе исследования данные свидетельствуют о том, что частота НБ с 1990 г. по 2015 г. в популяции женщин увеличилась в 3,5 раза и составила 6,3% (среди имевших беременность) и имеет устойчивую тенденцию к росту (по данным медицинской документации лечебных учреждений городского округа Самара). При этом частота СВ в 1990 г. была 6,3%, к 2015 г. увеличилась в 1,5 раза и составила 9,5% (НБ:СВ – 1:1,5) (рис. 1). Следовательно, НБ от всех женщин с невынашиванием беременности ранних сроков в 2015 г. составила 40% (в 1990 г. – 22,2%). Согласно мнению ряда исследователей, рост частоты НБ за последние 25 лет связан со снижением устойчивости эмбриоплацентарного комплекса к повреждению при значительном увеличении количества действующих факторов риска [16, 17].
Средний возраст женщин с НБ составил 26 (2,5) лет, с СВ – 25 (3,0) лет, контрольной группы – 24 (2,2) года (P<0,05). Индекс массы тела в указанных группах статистически значимо не отличался и составил менее 25.
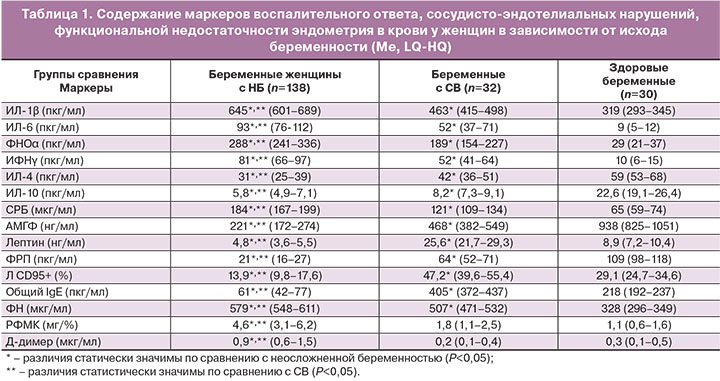
Результаты лабораторного тестирования показали, что у беременных с НБ, СВ имеется общая закономерность изменений маркеров воспалительного ответа. Причем при НБ изменения имеют более выраженный характер. Анализ уровней провоспалительных цитокинов, СРБ показал статистически значимую разницу (P<0,05) в их содержании при НБ и СВ, несмотря на общую тенденцию к повышению: при НБ средние значения ИЛ-1β, ИЛ-6, ФНО-α, ИФН-γ, СРБ увеличены, по сравнению с СВ, в 1,4, 1,6, 1,5, 1,5 и 1,4 раза соответственно (табл. 1).
 Анализ содержания противовоспалительных цитокинов показал их статистически значимое (Р<0,05) снижение по сравнению с физиологической беременностью (ИЛ-4 в 1,8 раза при НБ и 1,4 раза при СВ; ИЛ-10 – в 3,5 раза и 2,6 раза соответственно). Выявленные закономерности свидетельствуют о переключении иммунного ответа матери в сторону Th1-доминирования, что, с учетом повышения концентрации СРБ, укладывается при НБ, СВ в синдром системного воспалительного ответа (ССВО), характерный для 100% беременных с ранними репродуктивными потерями.
Анализ содержания противовоспалительных цитокинов показал их статистически значимое (Р<0,05) снижение по сравнению с физиологической беременностью (ИЛ-4 в 1,8 раза при НБ и 1,4 раза при СВ; ИЛ-10 – в 3,5 раза и 2,6 раза соответственно). Выявленные закономерности свидетельствуют о переключении иммунного ответа матери в сторону Th1-доминирования, что, с учетом повышения концентрации СРБ, укладывается при НБ, СВ в синдром системного воспалительного ответа (ССВО), характерный для 100% беременных с ранними репродуктивными потерями.
Анализ содержания маркеров сосудисто-эндотелиальных нарушений выявил статистически значимые различия между беременными с НБ и с СВ. Оценка уровня ФРП при НБ показала более значительное (в 3,2 раза) снижение значения параметра по сравнению с беременными с СВ (Р=0,008), что можно объяснить патологическим изменением эмбриона и параэмбриональных структур, сопровождающимся снижением выработки сосудисто-эндотелиального фактора регуляции пролиферации эндотелиальных клеток, васкуло- и ангиогенеза в плаценте [18].
Количественная оценка общего IgE выявила разнонаправленность его динамики при НБ и СВ (снижение в 3,6 раза при НБ и повышение в 1,8 раза при СВ) по сравнению с группой физиологической беременности. Снижение общего IgE при НБ можно объяснить повышенным образованием комплексов IgE-антиген с локализацией в сосудистой стенке эмбрио- или фето-плацентарного комплекса [10, 19].
Анализ содержания готовых к апоптозу иммуноцитов показал увеличение данного показателя в 1,6 раза у беременных с СВ по сравнению с физиологической беременностью (Р=0,02), что свидетельствует о выраженной индукции трофобластом экспрессии сигнальных молекул апоптоза (FasR) на иммунокомпетентных клетках. При НБ отмечается снижение уровня Л CD95+ в 2,2 раза по сравнению с нормой (P=0,009). Разнонаправленность изменений содержания в крови Л СD95+ при НБ и СВ можно объяснить различной степенью повреждения трофобласта: при НБ трофобласт, вследствие более глубокого повреждения, теряет защитные механизмы, в частности способность индуцировать апоптоз активированных лимфоцитов с целью их селекции; при СВ защитные механизмы цито- и синцитиотрофобласта ранней плаценты сохраняются вплоть до стадии начавшегося аборта.
Отмечена общая закономерность повышения содержания ФН у беременных с различным исходом I триместра, наиболее выраженное у беременных с НБ. Согласно полученным данным, выявленные закономерности при НБ по маркерам сосудисто-эндотелиальных и гемостазиологических нарушений, укладываются в синдром эндотелиальной дисфункции (СЭД), характерный в 100% наблюдений при данной патологии.
Проведенный анализ маркеров функциональной активности децидуальной оболочки матки у беременных групп сравнения выявил более значительное снижение АМГФ при НБ по сравнению с СВ (Р=0,026) – на 75 и 48% соответственно от уровня АМГФ при физиологической беременности. Интересная закономерность выявлена у женщин с патологией I триместра беременности по содержанию лептина. Отмечена разнонаправленность уровней пептидного гормона по сравнению с физиологической беременностью, статистически значимое (P=0,035) повышение лептина при СВ в 2,9 раза и его снижение (P=0,018) при НБ в 1,9 раза. Изменение содержания лептина при СВ, на наш взгляд, связано с усилением компенсаторно-приспособительных реакций, мобилизацией энергетического баланса, стимуляцией роста ворсин хориона и ангиогенеза ранней плаценты при угрозе прерывания беременности, протективным действием на децидуальную оболочку. Выраженное снижение лептина при НБ свидетельствует о декомпенсации в эмбрио- или фето-плацентарной системах. Данные изменения характеризуют синдром функциональной недостаточности эндометрия (ФНЭ), выявленный у всех женщин с несостоявшимся абортом.
Корреляционный анализ между показателями ССВО (ИЛ-1β, ИЛ-6, ФНО-α, ИФН-γ, СРБ) и ФНЭ (АМГФ, лептин) у беременных с НБ показал наличие сильной и средней силы отрицательной корреляционной связи (k от -0,62 до -0,91). Данное обстоятельство можно объяснить тем, что увеличение провоспалительных цитокинов сопровождает альтернативные изменения в эндометрии при НБ и способствует сдвигу клеточного метаболизма в эндометрии [2, 16, 20].
Корреляционный анализ между указанными провоспалительными цитокинами и гемостазиологическими изменениями у женщин с НБ показал наличие сильной положительной ассоциативной связи между маркерами ССВО и ФН (k от 0,83 до 0,95), что объясняется патофизиологическим влиянием повышенного содержания провоспалительных цитокинов на коагуляционный потенциал крови [4, 21].
Наличие сильной отрицательной ассоциативной связи между маркерами ССВО и показателями эндотелиальной дисфункции (ФРП, общий IgE, Л CD95+) объясняется цитотоксическим действием повышенных концентраций провоспалительных цитокинов на сосудистый эндотелий, стимуляцией цитокинами поликлональной В-клеточной активации с повышенной выработкой иммуноглобулинов класса реагинов (общий IgE), активационно-регулирующим действием ФНО-α на апоптоз иммунокомпетентных клеток через систему FasR-FasL и функциональное состояние эндотелиальной системы, угнетающим действием провоспалительных цитокинов на выработку ФРП с последующим нарушением ангио- и васкулогенеза [8, 18, 22, 23].
Наличие сильной положительной ассоциативной связи (k от 0,81 до 0,92) между показателями СЭГД (ФРП, общий IgE, Л CD95+) и ФНЭ (АМГФ, лептин) и сильной отрицательной связи (k от -0,85 до -0,93) между АМГФ, лептином и уровнями ФН, ФНОα свидетельствует о нарушении функционального состояния эндометрия в условиях измененной гемоциркуляции вследствие эндотелиально-гемостазиологической дисфункции. Корреляционный анализ между показателями нарушенного состояния системы гемостаза – ФН, РФМК, Д-димером показал наличие сильной ассоциативной связи (k от 0,79 до 0,92), что свидетельствует об активации свертывающей системы крови. Сходная связь отмечена в группе женщин с СВ (k от 0,74 до 0,83). Указанная выраженная связь маркеров гемокоагуляции позволяет рассматривать ФН в качестве универсального показателя, отражающего и динамику РКМФ, Д-димера.
Следовательно, характер изменений гомеостаза при несостоявшемся аборте свидетельствует о более выраженных механизмах повреждения по сравнению с СВ. Выявленные общие патогенетические механизмы при НБ объясняются наличием у всех беременных выраженного повреждения плодного яйца вплоть до его гибели, длительным его нахождением в полости матки, повреждением трех эндотелиальных поверхностей – эмбриоплацентарного эндотелия, эндотелия сосудов матки, эндотелия трофобласта, формирующихся с ранних сроков беременности, патологическим формированием эмбрио- и фето-плацентарного комплекса на фоне исходной ФНЭ. Лабораторный мониторинг синдромов ССВО, СЭГД и ФНЭ позволяет рассматривать их в качестве индикаторов клинико-патогенетических вариантов эмбриоплацентарной недостаточности (СВ, НБ), отражающих распад функциональной системы «мать – ранняя плацента – эмбрион (плод)», резкое нарушение васкуло- и ангиогенеза, дисметаболические, дисгормональные процессы, энергетический дисбаланс в репродуктивной системе. Диагностическое значение выделенных синдромов характеризуется высокими показателями тестов клинической эпидемиологии – чувствительности, специфичности, точности, прогностической ценности положительного и отрицательного результатов: 87, 82, 85, 89, 86%.
Результаты обследования показали, что в качестве возможной доминирующей причины НБ в 56% наблюдений была инфекция, в 44% – мультифакторная тромбофилия, в 10% – приобретенная гипергомоцистеинемия, в 38% – эндокринные нарушения, в 24% – мужской фактор, сочетание причинных факторов отмечено в 72% наблюдений. Вне зависимости от причинного фактора потери беременности выделенные при НБ патогенетические синдромы (ССВО, СЭГД, ФНЭ) диагностировались у всех женщин.
Для оптимизации врачебной тактики в интергенетическом периоде и улучшения гестационных исходов при последующих беременностях разработана и апробирована комплексная программа ведения женщин с НБ. Лечебные мероприятия после НБ проводятся с учетом репродуктивных планов женщины и результатов обследования.
Программа ведения женщин после НБ включает:
I. Восстановительное лечение с учетом репродуктивных планов женщины и результатов обследования.
- Персонифицированно подобранный метод прерывания беременности (кюретаж полости матки, вакуум-аспирация содержимого полости матки, медикаментозное прерывание беременности) – важный фактор благоприятного течения послеабортного периода.
- Диагностика причины НБ (при необходимости начинается до прерывания НБ), включающая оценку инфекционных факторов, гормонального профиля, наличия наследственных тромбофилий, ауто- и аллоиммунных факторов, маточного фактора, отцовского фактора, медико-социальных факторов риска, консультации (по показаниям) терапевта, эндокринолога, генетика, гематолога, андролога, иммунолога, физиотерапевта.
- Исходная количественная объективизация маркеров ведущих патогенетических механизмов повреждения при НБ: маркеры ССВО (ИЛ-1β, ИЛ-6, ФНО-α), маркеры СЭГД (ФРП, общий IgE, Л CD95+, СРБ, ФН), маркеры ФНЭ (АМГФ, лептин).
- Программа реабилитации:
- начало комплексного восстановительного лечения сразу после прерывания беременности с учетом единых патогенетических механизмов НБ (ССВО, СЭГД, ФНЭ) вне зависимости от причинного фактора потери беременности;
- исходная количественная объективизация маркеров ведущих патогенетических механизмов повреждения при НБ и динамический лабораторный контроль эффективности восстановительного лечения (маркеры ССВО, СЭГД, ФНЭ);
- периконцепционная подготовка: через 6 месяцев после потери беременности (догестационный этап, ведение на ранних сроках беременности).
Комплексное восстановительное лечение включает: антибактериальные средства с учетом чувствительности микробного фактора; восстановление биоценоза; энзимотерапия (вобэнзим); иммуномодулирующие средства (виферон, неовир); противовоспалительные средства (нестероидные противовоспалительные средства); гормональные средства (дюфастон, утрожестан); терапия с учетом этиологического фактора; исключение медико-социальных факторов риска невынашивания; контрацепция в случае отсутствия планирования беременности.
II. Догестационная подготовка с учетом индивидуальных особенностей доминирующего причинного фактора НБ, метаболическая терапия (актовегин, витамин Е), гормонотерапия (дюфастон), комплекс витаминов и минералов, фолиевая кислота.
III. Ведение на ранних сроках беременности.
- Профилактика потери беременности ранних сроков: гестагены (дюфастон в I–II триместрах); энзимотерапия (вобэнзим); препараты магния (магне В6); антиоксиданты (витамин Е); мероприятия с учетом доминирующего причинного фактора.
- Диагностика эмбриоплацентарной дисфункции – доклинического этапа ранних потерь беременности (ССВО, СЭГД, ФНЭ).
- Профилактика поздних гестационных осложнений (с учетом персонифицированного соматического и репродуктивного статуса).
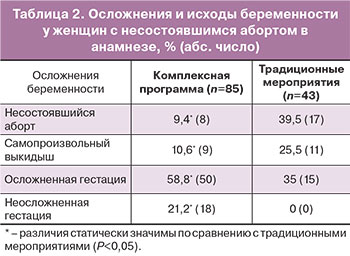
Эффективность комплексной программы восстановительного лечения у женщин с НБ в анамнезе, включающей трехэтапную профилактику рецидива ранних репродуктивных потерь – послеабортные мероприятия, прегравидарный этап и ведение на ранних сроках беременности, по сравнению с традиционными мероприятиями (антибиотики и противовоспалительные средства), подтверждают: снижение частоты ранних репродуктивных потерь при последующей беременности в 3,3 раза, неосложненное течение последующей беременности в 21,2% наблюдений, снижение частоты ПН на 36%, задержки роста плода на 28,8%, преждевременных родов на 10,7%, преждевременной отслойки нормально расположенной плаценты на 11,3%, оперативного родоразрешения на 32,7% (табл. 2). В целом применение разработанной программы увеличило благоприятные перинатальные исходы в 2,3 раза.
Заключение
За последние 25 лет отмечается значительный рост частоты НБ – в 3,5 раза с 1990 по 2015 г., что актуализирует разработку комплексной программы профилактики рецидива потери последующей беременности ранних сроков и ассоциированных с эмбрио- или фетоплацентарной дисфункцией больших акушерских синдромов. В генезе НБ, вне зависимости от доминирующего причинного фактора, важное значение имеют системный воспалительный ответ (дисбаланс в пользу провоспалительных цитокинов – ИЛ-1β, ИЛ-6, ФНО-α, ИФН-γ, повышение концентрации белков острой фазы воспаления) и эндотелиально-гемостазиологическая дисфункция (повышение уровня провоспалительных цитокинов, достоверное изменение содержания факторов гиперкоагуляции, апоптоза и альтерации сосудистого эндотелия – фибронектина, Д-димера, РФМК, Л СD95+, ФРП, общего IgE) на фоне функциональной недостаточности эндометрия (значительное снижение концентрации АМГФ, лептина). В диагностике НБ следует учитывать снижение уровня пептидного гормона лептина в 1,9 раза, лимфоцитов CD95+, экспрессирующих антиген активации запрограммированной клеточной гибели, в 2,1 раза по сравнению с референсным значением для соответствующего срока гестации.
Полученные в ходе исследования научные данные по механизмам формирования несостоявшегося аборта легли в основу программы ведения женщин с НБ в анамнезе, включающей лечебно-оздоровительный комплекс после прерывания НБ, догестационную подготовку и ведение ранних сроков последующей беременности, вторичную профилактику гестационных осложнений. Комплексная программа профилактики потери беременности ранних сроков у женщин с НБ в анамнезе снижает частоту ранних репродуктивных потерь в 3,3 раза, увеличивает частоту благоприятных перинатальных исходов в 2,3 раза.



