Преждевременные роды (ПР) представляют большой интерес для исследователей всего мира, поскольку и патогенез своевременной родовой деятельности, и, тем более, патогенез ПР остаются до конца не ясными. Кроме того, высокая заболеваемость и смертность недоношенных детей заставляют ученых искать новые патогенетические методы снижения частоты ПР. Именно поэтому понимание патогенеза преждевременной спонтанно начавшейся родовой деятельности очень важно.
Беременность – это процесс развития в матке полуаллогенного плода, который содержит антигены отца. В формирующейся системе мать–плацента–плод создается уникальная иммунологическая ситуация, позволяющая наполовину генетически чужеродной ткани плода «заселить» организм матери, не быть отторгнутым и развиваться в течение длительного срока.
Что известно в настоящее время об изменениях иммунной системы во время беременности:
- синцитиотрофобласт, образующий наружный слой ворсин плаценты, подвергается непосредственному воздействию материнской крови, но при этом он не экспрессирует HLA антигены I класса на своей поверхности и поэтому «не виден» иммунной системе матери;
- в трофобласте происходит выработка активных веществ, которые активируют и стимулируют апоптоз Т-лимфоцитов матери (например, белок В7Н1, IDO);
- клетки трофобласта вырабатывают регуляторные белки для системы комплемента (CD46, CD55, CD59), и это помогает защищать эмбриональные ткани от цитотоксичных материнских антител;
- в матке изменяется субпопуляция клеток иммунной системы: появляется большое количество децидуальных макрофагов с противовоспалительной активностью (М2 фенотип), которые, в свою очередь, секретируют иммуносупрессивные факторы, что снижает воспалительные реакции в системе мать–плацента–плод. При ПР, преэклампсии (ПЭ) и плацентарной недостаточности, наоборот, наблюдается активация макрофагов;
- прогестерон стимулирует выработку противовоспалительных цитокинов в клетках плаценты (например, интерлейкин (ИЛ)-10); кроме того, он способен подавлять иммунный ответ матери и изменять баланс Тh1/Тh2-хелперов в сторону противовоспалительного состояния Тh2 и блокировать синтез фактора некроза опухоли (ФНО).
Следует заметить, что все эти изменения носят именно локальный характер, и во время беременности отсутствует генерализованная иммуносупрессия материнского организма [1].
Многие иммунологи считают беременность противовоспалительным состоянием, тогда как при повышении концентрации цитокинов происходят самопроизвольные выкидыши и другие осложнения беременности. Так, повышение ИЛ-6 в шеечновагинальном секрете и в околоплодных водах ассоциируется с ПР [2]; высокие уровни ИЛ-1β и ФНО также связаны с высоким риском ПР [3].
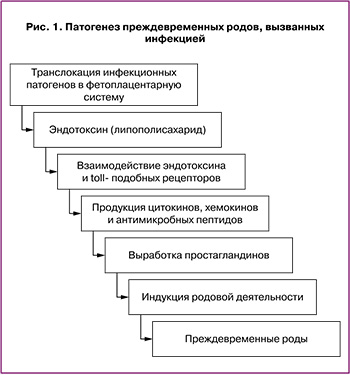 Toll-подобные рецепторы (TLRs) являются одним из компонентов врожденного иммунитета. Эти рецепторы расположены на поверхности и в цитоплазматических гранулах различных клеток организма. Больше всего TLRs экспрессируют моноциты и макрофаги. У человека выделено 10 видов TLRs, для каждого вида определены их лиганды, которыми являются бактериальные компоненты (липополисахариды, липотейхоевые кислоты, флагеллин и др.), а также нуклеиновые кислоты бактерий и вирусов. В результате распознавания лигандов TLRs генерируется активационный сигнал, что приводит к выработке провоспалительных цитокинов (ФНО, ИЛ), таким образом, реализуется процесс воспаления. От того, какие и в каком количестве TLRs преобладают на поверхности клеток данной структуры или ткани, может зависеть и выраженность процесса воспаления.
Toll-подобные рецепторы (TLRs) являются одним из компонентов врожденного иммунитета. Эти рецепторы расположены на поверхности и в цитоплазматических гранулах различных клеток организма. Больше всего TLRs экспрессируют моноциты и макрофаги. У человека выделено 10 видов TLRs, для каждого вида определены их лиганды, которыми являются бактериальные компоненты (липополисахариды, липотейхоевые кислоты, флагеллин и др.), а также нуклеиновые кислоты бактерий и вирусов. В результате распознавания лигандов TLRs генерируется активационный сигнал, что приводит к выработке провоспалительных цитокинов (ФНО, ИЛ), таким образом, реализуется процесс воспаления. От того, какие и в каком количестве TLRs преобладают на поверхности клеток данной структуры или ткани, может зависеть и выраженность процесса воспаления.
В настоящее время различными исследованиями подтверждена роль TLRs в патогенезе ПР, связанных с наличием инфекционного агента [4]. Известен патогенетический путь отторжения плодного яйца посредством активации TLRs эндотоксинами различных бактерий, что и приводит к преждевременному прерыванию беременности (рис. 1) [5].
Однако в ⅓ случаев ПР точно установить причину не удается – это так называемые спонтанные ПР [6]. В связи с этим в настоящее время для предотвращения преждевременного прерывания беременности используют не столько патогенетическое, а скорее, симптоматическое лечение.
Цель данного исследования – установить возможный патогенетический механизм спонтанных ПР посредством активации TLRs. Для этого были изучены экспрессия генов рецепторов TLR2, TLR4 и TLR9 эпителиальными клетками цервикального канала, а также секреция провоспалительных цитокинов (ФНО, ИЛ-6) в слизи цервикального канала у беременных женщин с угрозой спонтанных ПР.
Материалы и методы
Для исследования были выбраны 165 беременных женщин с одноплодной беременностью и угрожающими спонтанными ПР на сроках гестации 25–33 недели. Диагноз угрожающих ПР был установлен на основании жалоб пациенток на тянущие боли в нижних отделах живота и подтвержден повышенным тонусом матки и данными цервикометрии: укорочение шейки матки менее 20 мм. На этапе отбора были исключены женщины с присутствием инфекционного агента в шейке матке и во влагалище по данным бактериологического исследования влагалища и цервикального канала, а также пациентки с какими-либо другими осложнениями беременности (ПЭ, плацентарная недостаточность, инфекции, предлежание плаценты, сахарный диабет, пороки развития плода, преждевременное излитие околоплодных вод) – 119 (72,1%) женщин.
Кроме того, мы исследовали уровень провоспалительных цитокинов (ФНО и ИЛ-6) в шеечно-вагинальном секрете. У 4 пациенток были выявлены провоспалительные цитокины в цервикальном секрете без бактериального или вирусного агента. Они также были исключены из исследования. Таким образом, в исследование были взяты только 42 пациентки с клинической картиной угрожающих ПР с исключенным инфекционным фактором в шейке матке и влагалище, что позволяет отнести их к угрожающим спонтанным ПР. Контрольную группу составили 32 женщины с неосложненным течением беременности.
Для исследования экспрессии TLR-клетками эпителия цервикального канала после удаления слизи соскобы слизистой шейки матки собирали цитощеткой тип D модель 1 в отдельные стерильные эппендорфы. Из эпителиальных клеток на первом этапе выделяли РНК методом аффинной сорбции на частицах силикагеля с помощью набора «АмплиПрайм РИБО-сорб» компании «ИнтерЛабСервис» (РФ) строго в соответствии с протоколом. Далее проводили реакцию обратной транскрипции с помощью «Набора реагентов для проведения обратной транскрипции» («Синтол», РФ) строго в соответствии с протоколом. Праймеры для последовательностей исследуемых мРНК были подобраны с помощью программы Vector NTI 8,0 и синтезированы фирмой «Синтол». Праймеры и зонды для полимеразной цепной реакции в режиме реального времени (ПЦР-РВ) были смоделированы в компьютерной программе Vector NTI 8,0 в соответствии с последовательностями мРНК исследуемых генов (последовательности мРНК были взяты в базе GenBank) и синтезированы в фирме «Синтол» (РФ). Для проведения ПЦР был использован «Набор реагентов для проведения ПЦР-РВ в присутствии SYBR Green I» («Синтол», РФ) строго в соответствии с протоколом. После приготовления реакционных смесей пробирки помещали в амплификатор для ПЦР-РВ ДТ-96 («ДНК-технология», РФ). Режим реакции – 40 циклов (95°C 20 минут, 60°C 40 минут).
Определение цитокинов ИЛ-6 и ФНО в слизи цервикального канала производилось с помощью иммуноферментных наборов (по соответствующим приложенным регламентам) для количественного определения ИЛ-6 и ФНО: Human IL-6 Platinum ELISA и Human TNF alpha Platinum ELISA компании Thermo Fisher Scientific (США).
При статистическом анализе применяли компьютерную статистическую программу BioStat, а также программу Excel.
Для количественных данных, имеющих нормальное распределение, были рассчитаны среднее арифметическое (М) и стандартное отклонение (SD), которые представлены в формате M (SD). Качественные показатели представлены в абсолютных и в относительных (%) величинах. Для анализа качественных показателей использовали критерий χ² с поправкой Йетса.
Экспрессию генов TLRs оценивали в относительных единицах (ОЕ). Для каждого образца получали значение логарифма числа копий исследуемого гена и числа копий гена β-актина для нормировки результатов. Количество копий определяемого гена в дальнейшем пересчитывалось относительно 1 млн копий гена β-актина. ОЕ – это отношение количества копий по исследуемому гену (в нашем случае TLR2, TLR4 и TLR 9) к количеству копий по гену «домашнего хозяйства» (гену β-актина). При описании показателей использовали медианы (Ме) и квартили Q1 и Q3 в формате Ме (Q1; Q3). Для оценки статистической достоверности различий экспрессии генов в исследуемых группах использовали непараметрический критерий Манна–Уитни.
Статистически значимыми считались различия при уровне значимости р<0,05.
Результаты
Средний гестационный срок в обеих исследуемых группах не отличался и составил 28 недель с интервалами от 25 до 33 недель. Частота первородящих была в 2 раза выше в обеих группах, чем повторнородящих. У 14,3% женщин с угрозой ПР уже были в анамнезе ПР. У женщин с неосложненным течением беременности не было в анамнезе ПР (таблица).
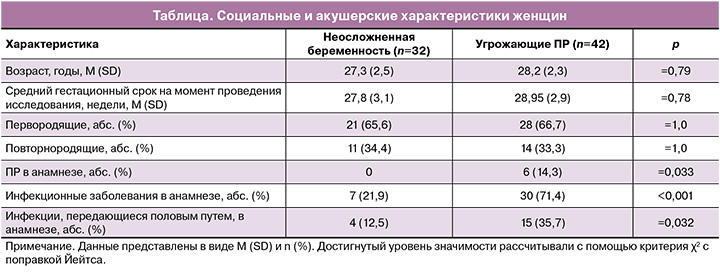
Нами выявлено статистически значимое отличие в частоте инфекционных заболеваний (хронический пиелонефрит, тонзиллит, цистит) в анамнезе у женщин с угрожающими ПР – частота в 3,26 раза выше, чем в группе сравнения (71,4 и 21,9%; р<0,001). Также у этих женщин почти в 3 раза чаще в анамнезе отмечены инфекции, передающиеся половым путем (35,7 и 12,5%; р=0,032).
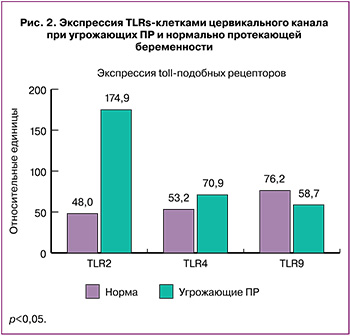 Полученные результаты экспрессии TLRs клетками цервикального канала представлены на рисунке 2. Нами было обнаружено, что экспрессия TLR2 возрастает в группе с угрозой ПР в 3,65 раза по сравнению с контрольной группой (174,9 (132,3; 1996,3) и 48,0 (33,7; 109,1); р=0,027). Экспрессия TLR4 также была увеличена в 1,33 раза в группе с угрозой ПР (70,9 (28,3; 116,9) и 53,2 (17,7; 111,3); р=0,072). При этом экспрессия TLR9 была в 1,6 раза ниже у женщин с угрозой ПР по сравнению с контрольной группой (58,7 (17,1; 100,4) и 76,2 (57,0; 112,6); р=0,12) (рис. 2).
Полученные результаты экспрессии TLRs клетками цервикального канала представлены на рисунке 2. Нами было обнаружено, что экспрессия TLR2 возрастает в группе с угрозой ПР в 3,65 раза по сравнению с контрольной группой (174,9 (132,3; 1996,3) и 48,0 (33,7; 109,1); р=0,027). Экспрессия TLR4 также была увеличена в 1,33 раза в группе с угрозой ПР (70,9 (28,3; 116,9) и 53,2 (17,7; 111,3); р=0,072). При этом экспрессия TLR9 была в 1,6 раза ниже у женщин с угрозой ПР по сравнению с контрольной группой (58,7 (17,1; 100,4) и 76,2 (57,0; 112,6); р=0,12) (рис. 2).
Обсуждение
Роль TLRs в запуске ПР при наличии инфекционного фактора известна и доказана. В задачу данного исследования входила оценка вовлеченности и роли TLRs в генезе ПР при отсутствии признаков инфекционного процесса и каких-либо иных причин для развития преждевременной спонтанной родовой деятельности – так называемых «спонтанных ПР». Именно поэтому из исследования были исключены женщины с другими осложнениями беременности, такими как ПЭ, плацентарная недостаточность, инфекции, предлежание плаценты, сахарный диабет, пороки развития плода, преждевременное излитие околоплодных вод.
Для исследования нами были выбраны 3 подвида TLRs: TLR2, TLR4 и TLR9. TLR2 и TLR4 – это рецепторы, расположенные на поверхности клеток, которые распознают бактериальный компонент. Также для изучения был выбран TLR9, являющийся внутриклеточным рецептором, который может активироваться нуклеиновыми кислотами.
В литературе встречается большое количество исследований, доказывающих роль TLR2 и TLR4 в патогенезе ПР, ассоциированных с инфекцией [7–9]. Именно поэтому нашей первой задачей был тщательный отбор пациенток для исследования и исключение у них инфекционного характера воспаления. На этапе отбора у 72,1% женщин с угрожающими ПР было выявлено присутствие инфекционного агента в шейке матке и во влагалище по данным бактериологического исследования. Полученные результаты позволяют сказать о том, что основной причиной большинства ПР является именно инфекция.
У 14,3% женщин с угрозой ПР уже были в анамнезе ПР, что является фактором риска этого осложнения [10].
У пациенток со спонтанными ПР была выявлена повышенная экспрессия TLR2 и TLR4 клетками цервикального канала в сравнении с женщинами с неосложненным течением беременности. Так, экспрессия TLR2 была повышена в 3,65 раза (174,9 (132,3; 1996,3) и 48,0 (33,7; 109,1); р=0,027), экспрессия TLR4 – в 1,33 раза выше (70,9 (28,3; 116,9) и 53,2 (17,7; 111,3); р=0,072). На основании полученных данных можно вынести суждение, что даже при исключении инфекционного фактора и отсутствии очевидного воспалительного процесса в шейке матки и во влагалище в генезе спонтанных ПР лежит воспалительный процесс, развивающийся в результате активации TLRs.
К сожалению, пока до конца остается непонятным, что активирует TLRs при спонтанных ПР. При анализе анамнестических данных нами обнаружена более высокая частота перенесенных инфекционных заболеваний (хронический пиелонефрит, тонзиллит, цистит) (71,4 и 21,9%; р<0,001), в том числе инфекций, передаваемых половым путем (35,7 и 12,5%; р=0,032), у пациенток с угрожающими ПР. И несмотря на то что эти инфекции были пролечены, что подтверждено данными последующего бактериологического и вирусологического исследований, возможно, мобилизация иммунной системы в прошлом приводит к ее более быстрой активации при беременности. Поскольку TLR2 и TLR4 являются рецепторами, реагирующими на бактериальные компоненты, то, возможно, повышение их экспрессии связано с наличием какого-либо скрытого инфекционного агента, не выявленного бактериологическими методами исследования. В то же время TLRs могут распознавать не только экзогенные структуры бактерий, но и реагировать на молекулы, высвобождающиеся при повреждении тканей: фибронектин [11], жирные кислоты, гем и другие [12].
При угрожающих TLRs нужно исключать инфекцию в шейке матки и во влагалище, которые, по результатам данного исследования, выявлены у 72,1% беременных с данным осложнением беременности. Лечение этих угрожающих TLRs должно включать антибактериальную терапию.
В оставшейся группе с исключенным инфекционным фактором целесообразно в терапию угрожающих ПР включать противовоспалительные препараты, поскольку проведенное нами исследование показало, что спонтанные ПР в своем патогенезе являются воспалительным процессом. Кроме того, в настоящее время ведутся исследования по использованию антагониста TLR4 для предотвращения и лечения спонтанных ПР [13]. Возможно, через некоторое время это позволит проводить патогенетическую терапию угрожающих спонтанных ПР и снизить их частоту.
Заключение
В генезе 72,1% ПР лежит воспалительный процесс, вызванный наличием инфекционного агента во влагалище и/или шейке матки.
Наличие ПР в анамнезе является фактором риска спонтанных ПР.
У женщин с угрожающими ПР значительно чаще в анамнезе встречаются инфекционные заболевания, а также инфекции, передаваемые половым путем.
Спонтанные ПР в своем патогенезе являются воспалительным процессом, запускаемым через активацию TLRs, в частности TLR2 и TLR4.
Учитывая активацию иммунной системы через TLRs при отсутствии инфекционного агента, следует думать об иных возможных причинах, запускающих процесс воспаления; например, ранее перенесенные и пролеченные инфекции, которые мобилизуют и активируют иммунную систему при беременности. Кроме того, возможна мобилизация иммунной системы молекулярными фрагментами, ассоциированными с повреждениями тканей (DAMPs).



