Репродуктивные потери при использовании вспомогательных репродуктивных технологий (ВРТ) занимают одно из ведущих мест в лечении бесплодия. На сегодняшний день как врачу амбулаторного звена, так и врачам-репродуктологам известно, что вне зависимости от анамнеза женщины она должна быть физиологически и психологически готова к беременности [1–3]. Отдельного внимания врачей-репродуктологов заслуживают пациентки с проблемой тонкого эндометрия, возникшей в результате многих причин.
К причинам нарушения имплантации и формирования тонкого эндометрия относятся:
- различные варианты внутриматочной патологии (внутриматочная перегородка, внутриматочные синехии, субмукозная миома матки, рецидивирующий полипоз, гиперпластические процессы) – как сами по себе, так и методы их лечения;
- тяжелые формы эндометриоза, аденомиоз;
- медикаментозное лечение (репродуктивно-токсическая терапия, химиотерапевтические препараты, цитостатики, некоторые гормональные препараты);
- аутоиммунные процессы [4–6].
Как известно, патогенез формирования «неполноценного», «тонкого» эндометрия заключается в нарушении взаимоотношения между экзо- или эндогенными эстрогенами и рецепторным аппаратом эндометрия. Как гипо-, так и гиперэстрогения одинаково плохо отражаются на толщине и качестве эндометрия. При гипоэстрогении не происходит формирования достаточного количества рецепторов к эстрогенам, в связи с чем эндометрий становится малочувствительным к эстрогенам и прогестерону [7–10]. Пациенток с гипоэстрогенией в практике репродуктолога около 40%. Это могут быть пациентки позднего репродуктивного возраста, пациентки после перенесенных операциях на яичниках, пациентки с идиопатическим ПНЯ (преждевременная недостаточность яичников). При гиперэстрогении высокие уровни эстрогенов подавляют рецепторы в эндометрии, что часто можно наблюдать в гиперстимулированном цикле.
Все это приводит к недостаточности формирования так называемого «имплантационного окна» – периода максимальной восприимчивости эндометрия, характеризующегося экспрессией рецепторов специфических генов и факторов роста, позволяющих прежде рефрактерному эндометрию предоставить возможность для нидации эмбриона.
Отдельной группой стоят пациентки, у которых проблемы тонкого эндометрия обусловлены предшествующими внутриматочными манипуляциями. Эффективность результатов экстракорпорального оплодотворения (ЭКО) и переноса эмбрионов (ПЭ) у пациенток зависит от многих факторов, так как тонкий эндометрий – лишь один из патогномоничных признаков гипоэстрогении. Например, у пациенток с оперативными вмешательствами на яичниках состояние эндометрия характеризуется различными изменениями как в гистологической структуре, так и в его рецептивности за счет нарушения экспрессии рецепторов стероидных гормонов, маркеров пролиферативной активности, нарушения формирования пиноподий. Таким образом, прегравидарная подготовка у пациенток с тонким эндометрием является ключевым фактором в подготовке к процедурам и методам лечения, направленным на достижение беременности. Для этого необходимо стремиться к нормализации состояния рецепторов эндометрия, синхронизации его фазовых изменений, восстановлению местного иммунитета и нормального кровоснабжения матки и эндометрия.
Обоснованными методами прегравидарной подготовки являются препараты, влияющие на физиологическое улучшение состояния репродуктивной системы и, в дальнейшем, на состояние плода, которые непосредственно препятствуют развитию как ранних, так и поздних осложнений во время оплодотворения, нидации и гестации беременности [11–14]. Необходимо помнить о важности приема препаратов фолиевой кислоты в прегравидарной подготовке, так как дефицит фолиевой кислоты во время беременности связан с множеством осложнений, включая не только врожденные дефекты, пороки развития и дефекты нервной трубки, но также самопроизвольные выкидыши и преждевременные роды [13].
Аминокислота аргинин играет важную роль в поддержке репродуктивного здоровья. Продемонстрированные в экспериментальных и клинических исследованиях позитивные эффекты аргинина на поддержку беременности связаны не столько с ролью аргинина как «строительного материала», сколько с другими биологическими факторами этой аминокислоты. В организме аргинин метаболизируется в оксид азота (II), орнитин и пролин, необходимые для поддержки ряда физиологических процессов во время беременности. Ингибирование синтетазы оксида азота нарушает оплодотворение яйцеклетки [15].

Орнитин и пролин существенны для синтеза полиаминов, регулирующих экспрессию генов и синтез белка в матке и плаценте. Аргинин регулирует функцию гипофиза и увеличивает маточный кровоток. Пероральный прием аргинина ускоряет рост плода при задержке внутриутробного развития (ЗВУР) плода [16, 17]. Поэтому дотации аргинина также способствуют поддержке нормального уровня артериального давления и снижают риск развития преэклампсии. В качестве препарата, содержащего компоненты, наиболее важные для прегравидарной подготовки женщин с тонким эндометрием, заслуживает внимание прегнотон. В его состав входят L-аргинин, фолиевая кислота, экстракт витекса священного, витамины Е, С, В2, В6 и минералы цинк, магний, селен, йод. Рекомендуется также назначение препаратов омега-3-полиненасыщенных жирных кислот (ПНЖК), которые на сегодняшний день представляют собой один из перспективных, но мало используемых резервов для прегравидарной подготовки. Омега-3-ПНЖК оказывают влияние и на плазменное звено гемостаза (активируют процессы фибринолиза, снижают уровень фибриногена), обладают иммуномодулирующим действием [18]. Доказано важное влияние витамина D на эндометрий. Он является регулятором эндометриальной экспрессии HOXA10, гена, критичного для процесса имплантации, который участвует во взаимодействии эмбриона и эндометрия с помощью различных молекулярных и цитокиновых механизмов [10, 12, 19–21].
Определено, что оптимальная толщина эндометрия на момент переноса эмбриона в полость матки должна составлять 8–12 мм. Абсолютное большинство исследований показывают, что эндометрий толщиной менее 8 мм является прогностически неблагоприятным фактором в отношении наступления и исхода беременности в циклах ВРТ, в частности ранней потери беременности и высокой частоты внематочной беременности [18, 22, 23].
Материал и методы исследования
В исследование были включены 145 пациенток с установленным диагнозом бесплодие в возрасте 25–42 лет, из них 125 имели оперативные вмешательства на яичниках, клинику тонкого эндометрия в анамнезе и наблюдались в отделении гинекологии с применением ВРТ Центральной клинической больницы РАН (Москва). У остальных 20 пациенток был диагностирован трубно-перитонеальный фактор бесплодия. У всех пациенток была проведена стимуляция суперовуляции с использованием агонистов и антагонистов ГнРГ в анамнезе. 125 пациенток с оперативными вмешательствами на яичниках в анамнезе были разделены на 2 группы.
Первая группа – ретроспективная, состоящая из 65 пациенток, которым не проводилась прегравидарная подготовка. Вторая группа – проспективная, состоящая из 60 пациенток. Данные пациентки получали прегравидарную подготовку к программам ВРТ в течение 2–3 мес., в виде специализированного комплекса прегнотон. Для коррекции дефицита витамина D пациентки получали препарат ультра-д в дозах от 1000 до 4000 МЕ в зависимости от лабораторных показателей, а также гормональную терапию, содержащую трансдермальный точно дозированный 17β-эстрадиол (дивигель) в режиме дозирования 1–2 мг/сутки с 1-го по 28-й день в комбинации с прогестероном с 14-го по 25-й день менструального цикла, в течение 2–3 месяцев.
Группу сравнения составили 20 пациенток с интактными яичниками и трубно-перитонеальным фактором бесплодия. Пациентки всех трех групп были сопоставимы по антропометрическим показателям. В ходе исследования всем женщинам было проведено тщательное клинико-лабораторное обследование, оценка овариального резерва, ультразвуковое исследование органов малого таза в I и II фазу менструального цикла.
Пациенткам в проспективной группе было выполнено иммуногистохимическое исследование эндометрия. Забор материала проводили в ожидаемом «окне имплантации» – на 7–10-й постовуляторный день 28-дневного менструального цикла. С помощью гистероскопии проводилась биопсия эндометрия либо, по показаниям, раздельное выскабливание слизистой оболочки цервикального канала и полости матки. Интенсивность иммуногистохимических реакций к α/β-рецепторам эстрогена и прогестерона в ядрах клеток эпителия желез и стромы определяли по методу гистологического счета H-score. Степень выраженности экспрессии рецепторов оценивали следующим образом: 0–10 баллов — отсутствие экспрессии, 11–100 — слабая экспрессия, 101–200 — умеренная экспрессия, 201–300 — выраженная экспрессия. Интенсивность иммуногистохимических реакций к белку Ki-67 рассчитывали в процентах (количество окрашенных ядер на 100 клеток).
Пациенткам с нарушением стероидной рецепции (RP и RE2) и пролиферативной активности (исследование белка Ki-67) проводили прегравидарную подготовку, включающую заместительную гормональную терапию в течение 2–3 месяцев до включения в программу ВРТ с целью повышения эффективности лечения. Показанием для назначения гормонотерапии было нарушение эхо-структуры эндометрия как в I, так и во II фазе менструального цикла (р=0,001) по данным ультразвукового исследования и стероидной рецепции (железы, строма) белка Ki-67. Стимуляция суперовуляции проводилась с использованием агонистов и антагонистов гонадотропин-рилизинг гормона. Были использованы препараты рекомбинантного фолликулостимулирующего гормона (ФСГ), препараты, содержащие рекомбинантный ФСГ и рекомбинантный лютеинизирующий гормон (ЛГ) и человеческие менопаузальные гонадотропины, содержащие в равных долях ФСГ и ЛГ.
Контроль эффективности стимуляции суперовуляции осуществляли с помощью оценки качества полученных ооцитов и эмбрионов и при динамическом обследовании, и при наблюдении. Оценку зрелости полученных ооцитов производили по состоянию комплексов ооцит-кумулюс. Оплодотворение проводилось методами ЭКО и интрацитоплазматической инъекции сперматозоида в яйцеклетку. На конечном этапе исследования осуществлялся анализ частоты наступления беременности.
Статистическая обработка результатов исследования проводилась с помощью программного пакета статистической обработки данных — IBM SPSS Statistics 10. Полученные цифровые результаты исследования обрабатывали методами вариационной статистики. Результаты исследования представлены в виде частот и процента допустимых либо как М (среднее) ± m (стандартная ошибка среднего значения). Различия между сравниваемыми величинами признавали достоверно значимыми при р<0,05.
Результаты исследования
Анализируя анамнестические данные, выявили, что длительность бесплодия в ретроспективной группе составила в среднем 5,6±0,4 года, в проспективной — 5,3±0,7 года, в контрольной — 4,1±0,77 года. Было обнаружено, что у большинства пациенток выявлены сочетанные факторы бесплодия. В ретроспективной и проспективных группах чаще выявлялось первичное бесплодие, в 40 (61,54%) и 31 (51,67%) случаях соответственно. Эндокринное бесплодие наблюдалось у большинства пациенток из ретроспективной – 49 (75,38%) и проспективной – 53 (88,33%) групп.
Менструальная функция не была нарушена ни у одной из пациенток. Средний возраст наступления менархе у пациенток всех трех группа был сопоставим (различия не достоверны, р=0,09), в ретроспективной группе он составил 12,9±0,5 года, в проспективной — 12,6±0,5 года, в контрольной — 12,6±0,7 года. У всех респонденток менструальный цикл установился сразу. При тщательном анализе было выявлено, что у большинства из них в проспективной и ретроспективной группах менструации были не обильными.
Достоверно чаще (р<0,0001) вне зависимости от возраста были выполнены органосохраняющие оперативные вмешательства на яичниках — цистэктомия и резекция. Причем в проспективной группе чаще проводилась цистэктомия (табл. 1).
Результаты морфологического исследования удаленных тканей играли важную роль в планировании дальнейшего комплекса мероприятий, направленных на преодоление бесплодного брака. Наиболее частой причиной оперативных вмешательств на яичниках были эндометриоидные кисты: 28 (43,08%) в ретроспективной и 33 (55,0%) в проспективной группах. Фолликулярные кисты были причиной хирургического вмешательства в 21,54 и 20,0% соответственно. Кисты желтого тела встречались у 21,54% пациенток в ретроспективной группе и 15% в проспективной группе. В остальных единичных случаях наблюдались дермоидная киста, простая киста, серозная цистаденома, муцинозная цистаденома, фиброма яичника.
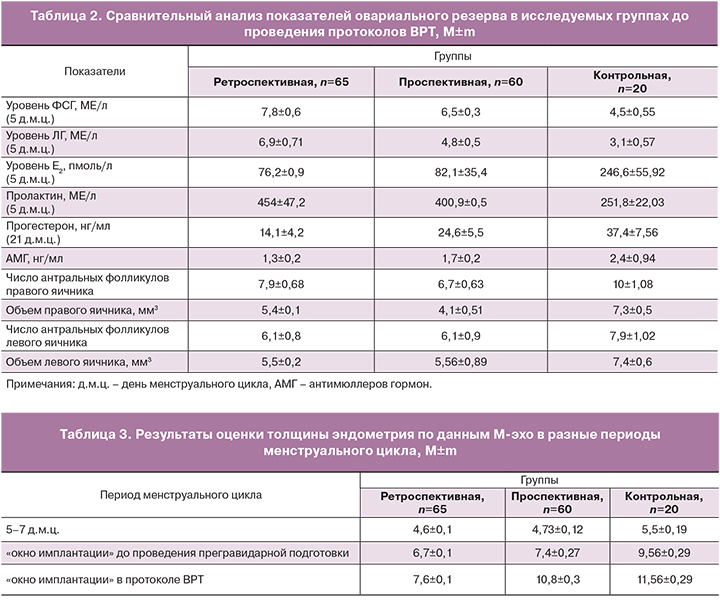
При оценке овариального резерва было выявлено его снижение в группах пациенток с оперированными яичниками. При лабораторном обследовании выявлены изменения в гормональном статусе у пациенток, перенесших оперативные вмешательства на яичниках. Также было отмечено повышение ФСГ и ЛГ, обусловленное снижением эстрадиола, а также пролактина. При оценке уровня прогестерона во II фазу менструального цикла выявлено, что у пациенток с оперированными яичниками чаще наблюдалась недостаточность лютеиновой фазы (табл. 2).
В результате проведенного иммуногистохимического исследования при бесплодии у пациенток с гипоэстрогенией было обнаружено, что уровень эстрогеновых рецепторов α (ЭРα) в железах в целом превышал нормальные показатели в 2,5 раза, а уровень этих рецепторов в строме был выше в 1,25 раза. Количество прогестероновых рецепторов (ПР) как в железах, так и в строме было ниже нормальных показателей. У пациенток с трубно-перитонеальным фактором бесплодия экспрессия ПР в железах была несколько повышена и равнялась 142,6±11,8 балла. Экспрессия ПР в строме достоверно уступала нормальным показателям (150,8±8,7 балла). А экспрессия ЭРα и в железах, и строме достоверно превышала норму – 155,6±11,3 и 125,6±9,8 балла соответственно. Достоверной разницы в экспрессии ПР в строме и ЭРα в железах при первичном и вторичном бесплодии не обнаружено, но при вторичном бесплодии эти показатели были несколько ниже, чем при первичном.
Учитывая полученные данные, пациенткам в проспективной группе с нарушением рецептивности эндометрия перед программами ВРТ осуществлялась нормализация микробиоценоза влагалища, также была проведена прегравидарная подготовка, включающая комплекс прегнотон, витамин D3 (ультра-д по 1000–4000 МЕ/сут) и гормональную терапию, содержащую трансдермальный точно дозированный 17β-эстрадиол (дивигель) в режиме дозирования 1–2 мг/сутки с 1-го по 28-й день менструального цикла в комбинации с прогестероном с 14-го по 25-й день, в течение 2–3 месяцев.
Анализ проведенных циклов ВРТ показал, что в ретроспективной группе суммарная доза гонадотропинов на цикл стимуляции составила от 1750 до 3450 МЕ, в среднем 2260,45±125 МЕ. В связи с тем, что в группе были пациентки с оперированными как правым, так и левым яичниками, а также с вмешательствами на обоих яичниках, количество фолликулов, полученных при трансвагинальной пункции, было приблизительно одинаковым (правый яичник – 3±0,64, левый яичник – 3,2±0,88 соответственно). Стимуляция овуляции проводилась в течение 11,3±1,25 дня. При трансвагинальной пункции фолликулов и аспирации их содержимого было получено 4,6±0,85 ооцитов (количество ооцитов стадии 2pn составило 2,5±0,74), из них зрелых 2±0,48 (М2). Количество эмбрионов при переносе – 1±0,15. В данной группе беременность наступила в 15,5% протоколов. У 55,5% женщин беременность завершилась родами. При анализе данных в проспективной группе было выявлено, что суммарная доза гонадотропинов на цикл стимуляции составила от 750 до 1525 МЕ, в среднем 1138,54±112,5 МЕ. В данной группе получено почти равное количество фолликулов при стимуляции суперовуляции: правый яичник – 4,6±0,59, левый яичник – 4,3±0,63. Стимуляция овуляции проводилась в течение 13,1±1,2 дня. При трансвагинальной пункции фолликулов и аспирации их содержимого было получено в среднем 6,3±0,86 ооцитов (количество ооцитов стадии 2pn составило 4,2±0,51). Из них зрелые М2 5,77±0,45. Количество эмбрионов при переносе 3,4±0,14. Беременность наступила в 31,7% протоколов. Показатель живорожденности составил 63,16%.
В группе контроля было проведено 20 протоколов стимуляции суперовуляции у 20 женщин. Суммарная доза гонадотропинов на цикл стимуляции составила от 1000 до 3375 МЕ, в среднем 1277,5±135,83 МЕ. В правом яичнике получено больше фолликулов (8,3±0,99). Стимуляция проводилась в течение 12,7±0,24 дня. В среднем было получено 9,7±1,35 ооцита, из них зрелые МII (7±0,92). Количество эмбрионов при переносе – 2,5±0,5. Беременность наступила в 35,0% протоколов. Родами завершилось 57,14% беременностей.
Также в проспективной группе толщина эндометрия после проведения курса прегравидарной подготовки с включением гормональной терапии составила 10,48±0,3 мм, что соответствует оптимальным значениям толщины эндометрия в «окно имплантации» согласно литературным источникам (табл. 3). Данные результаты показывают, что операции по поводу кист и доброкачественных образований яичников влияют на овариальный резерв, что подтверждается сниженным количеством полученных фолликулов и ооцитов. Но проведенная прегравидарная подготовка, включающая гормональную терапию эстрогенами и прогестагенами (точно дозированный 17β-эстрадиол + прогестаген) для подготовки эндометрия позволила увеличить процент наступления беременности в два раза в проспективной группе по сравнению с ретроспективной, процент наступления беременностей был близок к контрольной группе. Также обращает на себя внимание тот факт, что при проведении прегравидарной подготовки в протоколе ВРТ (проспективная группа) были использованы более низкие дозы гонадотропинов, получено большее число зрелых ооцитов и бластоцист по сравнению с ретроспективной группой, в которой не проводилась прегравидарная подготовка.
Заключение
Таким образом, включение препарата прегнотон в комплексную прегравидарную подготовку пациенток с тонким эндометрием в программах вспомогательных репродуктивных технологий позволяет улучшить результаты ЭКО и переноса эмбрионов. Подобный подход способствует увеличению процента наступления беременности и снижению риска осложнений, оказывая положительное влияние на перинатальные и младенческие потери.



