Врожденные пороки развития (ВПР) – структурные или функциональные аномалии, возникающие в период внутриутробного развития. ВПР принадлежит ведущая роль в структуре детской заболеваемости, инвалидности и младенческой смертности [1]. Они могут быть выявлены до рождения, сразу после рождения или в более старшем возрасте ребенка [2]. В период органогенеза, соответствующий первым 12 неделям беременности, эмбрион наиболее чувствителен к действию неблагоприятных факторов, которые могут влиять на формирование центральной нервной, сердечно-сосудистой, костной и мочеполовой систем, приводя к образованию ВПР [3]. В 2010 г. Всемирной ассамблеей здравоохранения принято постановление о том, что все государства-члены Всемирной организации здравоохранения должны содействовать первичной профилактике ВПР и укреплению здоровья детей, рожденных с данной патологией. Одной из главных задач в этом направлении является развитие научных исследований в области этиологии, диагностики и профилактики ВПР [4].
В настоящее время особое внимание уделяется состоянию углеводного обмена во время беременности [5, 6]. Сахарный диабет (СД) является глобальной эпидемией XXI в. По данным Международной федерации диабета за 2018 г., в мире зарегистрировано 463 млн человек, у которых был выявлен СД. Около 60 млн составляют женщины репродуктивного возраста [7]. В Архангельской области на начало 2019 г. зарегистрировано 47 тысяч пациентов с диагнозом СД [8]. Эпидемиологические исследования демонстрируют значимое повышение риска развития отдельных форм врожденных аномалий у новорожденных, матери которых страдали СД [3]. Механизм формирования ВПР у детей, рожденных от матерей с СД, до конца не ясен. Среди наиболее значимых факторов указываются колебания гликемии [9, 10], накопление кетоновых тел при декомпенсации углеводного обмена, усиление перекисного окисления с накоплением свободных радикалов, повышенная выработка инсулиноподобных факторов роста, нарушения липидного и белкового обмена [9]. Нельзя исключить и роль нарушения плацентарного кровотока из-за морфологических изменений стенок капилляров и артерий [11].
Проведенные ранее эпидемиологические исследования показали, что прегестационный СД является фактором риска таких нехромосомных ВПР, как пороки сердечно-сосудистой, мочеполовой, пищеварительной и центральной нервной систем [12]. По данным Европейской сети по изучению врожденных аномалий (EUROCAT), прегестационный СД у матери также увеличивает вероятность развития множественных ВПР [13].
Связь между гестационным СД и развитием ВПР менее изучена; в то же время результаты предыдущих исследований установили повышенный риск рождения детей с расщелиной губы и мягкого неба или только расщелиной губы, а также расщелиной твердого неба [14], ВПР центральной нервной системы [15], половых органов [16] при гестационном СД у матерей.
В связи с тем что и СД, и ВПР являются сравнительно редкими событиями с точки зрения эпидемиологии, оптимальным способом изучения связи между ними являются крупные популяционные исследования, к которым, в том числе, относят исследования, основанные на популяционных регистрах исходов беременностей. Подобные регистры, впервые организованные в ряде Скандинавских стран в 60-е гг. XX в., были внедрены в Мурманской и Архангельской областях Российской Федерации и в настоящее время продолжают оставаться ценным ресурсом для изучения редких исходов беременности, в том числе ВПР [17]. Изучение связи между СД и ВПР позволит оценить важность информации о СД для прогнозирования ВПР при разработке прогностических моделей для клинической практики в рамках развития персонифицированной медицины с применением технологий машинного обучения.
Цель исследования: произвести количественную оценку влияния прегестационного и гестационного СД у женщины на риск развития врожденных аномалий у ребенка.
Материалы и методы
Дизайн исследования и источники данных
Проведено историческое когортное исследование, основанное на данных регистров родов (РР) Архангельской (РРАО) и Мурманской областей (РРМО).
Базой исследования явились данные РРМО за 2006–2011 гг., РРАО – за 2012–2017 гг. За рассматриваемый период в двух региональных регистрах были зарегистрированы 134 884 исхода беременности.
РР является электронной базой данных, содержащей детальную информацию о здоровье всех беременных женщин и детей, родившихся на данной территории; его использование учитывает потенциальные факторы риска неблагоприятных исходов беременности, а также помогает оценивать эффективность применения стандартов оказания медицинской помощи в акушерстве и перинатальной медицине. Собираемая на регулярной основе информация используется для мониторинга качества работы службы родовспоможения и неонатологии, выявления причин патологических состояний и контроля качества выполнения принимаемых управленческих решений. РР содержит информацию обо всех исходах беременности в указанных выше регионах со сроком гестации 22 недели и более. Сбор данных для регистров осуществлялся медицинскими организациями родовспоможения согласно разработанной анкете, содержащей информацию о демографических данных родителей (возраст, образование, место работы), акушерском анамнезе, особенностях течения настоящей беременности и факторах образа жизни. Регистрационная карта РР содержит также блок информации о новорожденном, включающий антропометрические данные, оценку по шкале Апгар, статус при рождении и установленные во время пребывания в учреждении родовспоможения диагнозы, включая ВПР. Источником данных для заполнения регистрационной карты РР являлась первичная медицинская документация, а именно: обменная карта, история родов, история развития новорожденного [17].
В РР наличие у беременной СД подтверждалось соответствующим кодом Международной классификации болезней 10-го пересмотра (МКБ-10). Учитывая время возникновения гликемии по отношению к зачатию и критическим периодам онтогенеза, а также для обеспечения сравнимости результатов с проведенными ранее крупными международными исследованиями [13, 14, 16], все беременные, у которых был диагностирован СД, были разделены на 2 группы: беременные с диагностированным прегестационным СД (к ним относились беременные с установленными диагнозами, закодированными как E10-E11 по МКБ-10) и гестационным СД (код O 24).
Данные по ВПР были классифицированы в соответствии с группами пороков по МКБ-10: врожденные аномалии развития нервной системы (Q00–Q07), врожденные аномалии глаза, уха, лица и шеи (Q10–Q18), врожденные аномалии системы кровообращения (Q20–Q28), врожденные аномалии органов дыхания (Q30–Q34), расщелина губы и неба (Q35–Q37), другие врожденные аномалии органов пищеварения (Q38–Q45), врожденные аномалии половых органов (Q50–Q56), врожденные аномалии мочевыделительной системы (Q60–Q64), врожденные аномалии и деформации костно-мышечной системы (Q65–Q79), другие врожденные аномалии (Q80–Q89), хромосомные нарушения, не классифицированные в других рубриках (Q90–Q99).
Статистический анализ
Исследование было проведено в 2 этапа: на первом этапе с использованием данных о случаях ВПР с имеющимися в регистре диагнозами по МКБ-10 была рассчитана общая распространенность ВПР, а также распространенность ВПР по группам пороков в соответствии с МКБ-10 в зависимости от наличия или отсутствия СД у матери. При этом проведено сравнение частот ВПР в группах новорожденных у матерей без СД, с прегестационным СД (в нее вошли беременные, у которых информация о наличии СД 1 или 2 типа присутствовала в поле «Заболевания матери до беременности») и гестационным СД при помощи теста хи-квадрат (χ2) Пирсона. На данном этапе в исследование были включены все исходы беременности, записи о которых имелись в РР, по которым присутствовала информация о диагнозах матери до и во время беременности, а также информация о зарегистрированных ВПР с указанием диагнозов. Число наблюдений на данном этапе составило 134 013, или 99,4% всех исходов беременности в регистре.
На втором этапе с целью установления силы влияния СД матери на риск развития ВПР у новорожденного проведен регрессионный анализ при помощи метода логистической регрессии. Для оценки риска были рассчитаны грубые отношения шансов (ОШ) развития отдельных групп ВПР с 95% доверительными интервалами (ДИ) при использовании метода бинарной логистической регрессии: при этом наличие или отсутствие ВПР у новорожденного включалось в модель в качестве бинарной зависимой переменной, факт наличия СД у матери – в виде независимой. Учитывая тот факт, что ВПР являются редкими исходами, ОШ можно считать проксиоценкой относительных рисков (ОР). В дальнейшем, с целью исключения влияния потенциально вмешивающихся факторов (конфаундеров), которые могли бы исказить силу и направление взаимосвязи, был проведен многомерный логистический регрессионный анализ как в целом для всех ВПР, так и отдельно для каждой группы ВПР. Отбор потенциально вмешивающихся факторов был проведен на основании обзора литературы [13, 14, 16, 18]. Независимые переменные были проверены на наличие мультиколлинеарности: VIF для всех включенных в модель переменных находился в диапазоне от 1 до 5, что свидетельствовало об отсутствии выраженной мультиколлинеарности, требующей коррекции. Таким образом, в анализ в качестве бинарной зависимой переменной был включен факт наличия/отсутствия ВПР у новорожденного, а в качестве независимых – информация о наличии СД у матери (в виде категориальной переменной со следующими значениями: нет диагноза диабет, прегестационный диабет, гестационный диабет), данные о возрасте матери (менее 20 лет, 20–35 лет, старше 35 лет), индексе массы тела (менее 18,5 кг/м2, 18,5–24,99 кг/м2, 25 и более кг/м2), приеме фолиевой кислоты во время беременности, признаках злоупотребления алкоголем во время беременности, информация о курении во время беременности. В связи с тем что подходы к диагностике гестационного СД на протяжении рассматриваемого периода были изменены, была также выполнена коррекция на год рождения ребенка путем включения данной переменной в регрессионную модель. На данном этапе из анализа были исключены все исходы беременности, в отношении которых в регистре отсутствовала информация по переменным, включенным в анализ. Таким образом, число наблюдений, включенных в каждую из регрессионных моделей, составило 123 928 исходов беременности, по которым в базе регистра имелась информация по всем использованным для коррекции переменным. Это составило 91,9% от всех имеющихся в регистрах записей. В таблице 1 представлены данные о количестве и доле отсутствующих данных по каждой из изучаемых переменных. Следует отметить, что группы новорожденных с ВПР и без них значимо не отличались по доле отсутствующих данных (p для теста χ2=0,230).

Статистический анализ данных проводился при помощи ПО STATA 17.0 (Stata Corp., TX, USA).
Результаты
Среди всех исходов беременностей, имеющихся в объединенной базе РРМО и РРАО за период с 2006 по 2017 гг., зарегистрировано 4717 новорожденных с различными формами ВПР. Среди беременных, информация о которых внесена в данные регистры, было выявлено 3592 случая СД, из них в 364 случаях это был прегестационный СД (табл. 2). Из числа беременных с прегестационным СД 232 (63,7%) имели СД 1 типа.
Распространенность ВПР среди детей, рожденных женщинами с прегестационным СД, была статистически значимо выше по сравнению с распространенностью ВПР при других формах диабета у матерей и в сравнении с женщинами с нормальной гликемией (табл. 2). При сравнении распространенности по отдельным группам ВПР значимые различия в распространенности были выявлены для ВПР системы кровообращения, органов дыхания, аномалий мочевыделительной системы, а также группы других врожденных аномалий, включая множественные (табл. 3).
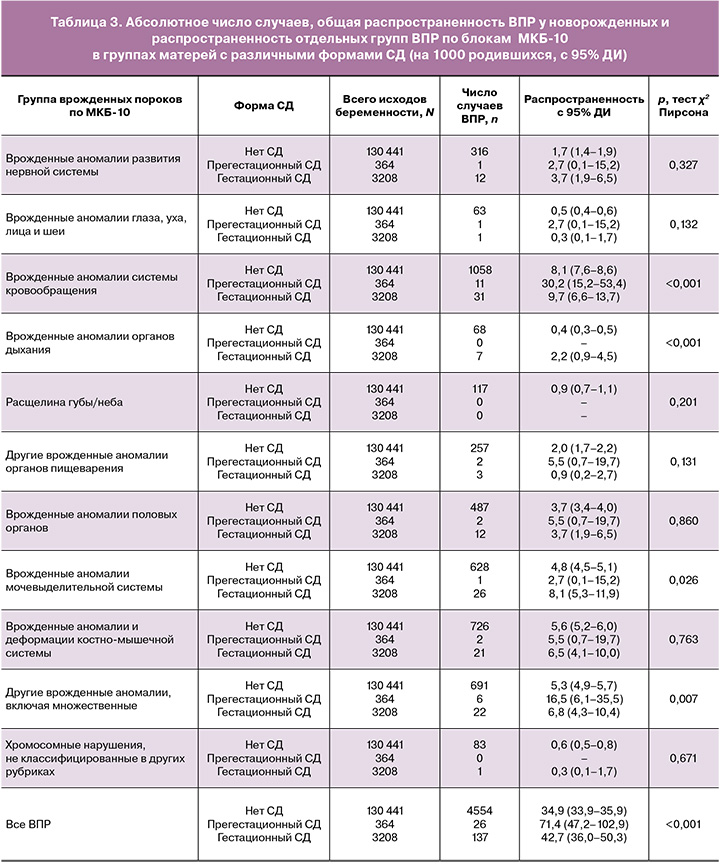
В ходе проведения моновариантного анализа взаимосвязи между наличием СД и риском развития ВПР, выраженным посредством ОШ, установлено, что наличие прегестационного СД (p<0,0001) и гестационного СД (p=0,014) значимо увеличивало риск развития ВПР у новорожденного. При анализе по отдельным группам ВПР наличие прегестационного СД повышало риск развития врожденных аномалий системы кровообращения (p<0,0001), риск развития врожденных аномалий глаза, уха, лица и шеи (p=0,044), риск развития ВПР из группы других аномалий (p=0,002). Наличие гестационного СД было связано с увеличением риска развития ВПР нервной системы (p=0,027), органов дыхания (p<0,0001) и аномалий мочевыделительной системы (p=0,014) (табл. 4).
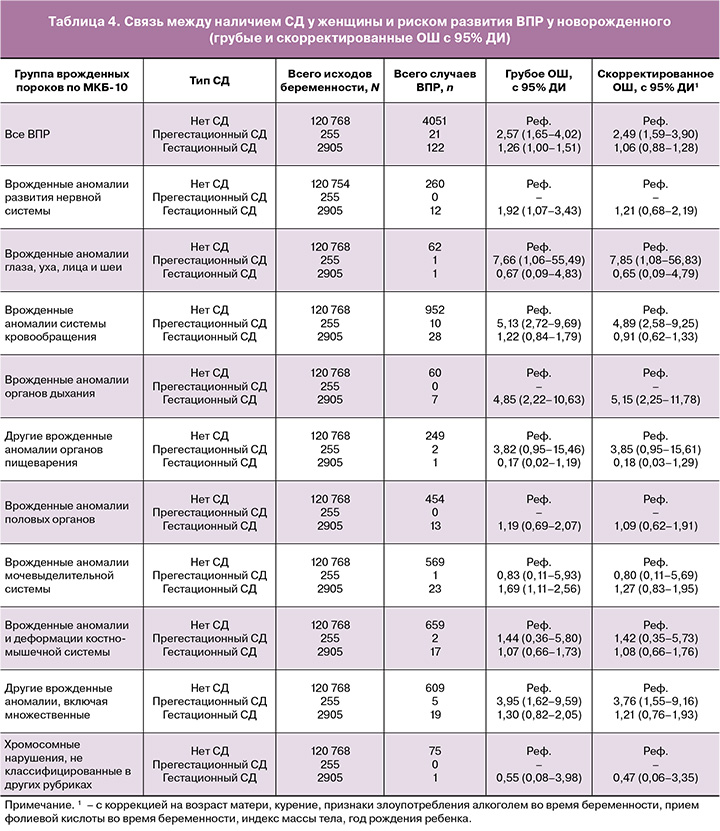
После коррекции на ряд потенциально вмешивающихся факторов (табл. 4) сохранялась статистически значимая взаимосвязь между прегестационным СД и риском развития ВПР в целом (p<0,0001), врожденными аномалиями глаза, уха, лица и шеи (p=0,042), врожденными аномалиями системы кровообращения (p<0,0001) и группой других врожденных аномалий (Q80–Q89) (p=0,004); при этом для гестационного СД статистически значимой оставалась его связь с повышенным риском развития ВПР органов дыхания (p<0,0001).
Обсуждение
Анализ данных РРАО и РРМО подтвердил, что прегестационный и гестационный СД являются независимыми факторами риска ВПР у ребенка. При этом у детей, рожденных от женщин с СД 1 типа, была установлена наибольшая распространенность ВПР. СД 1 типа у беременной ассоциировался с наиболее высоким риском возникновения у ребенка врожденных аномалий глаза, уха, лица и шеи, а также ВПР системы кровообращения и других ВПР из одноименной группы (Q80–Q89). Гестационный СД статистически значимо повышал риск развития врожденных аномалий дыхательной системы.
По данным предыдущих исследований, риск развития ВПР у плода у беременных с СД в 2–5 раз выше, по сравнению с общей популяцией [19]. У пациенток на инсулинотерапии риск увеличивается до 10–12% [19], что объясняет наибольшую распространенность ВПР у женщин с СД 1 типа, которые в 100% случаев получают инсулин [12]. Для больных СД 1 типа особенно характерно частое чередование гипер- и гипогликемии. В настоящее время широкое распространение получает использование помповой инсулинотерапии для минимизации колебаний гликемии, но в исследуемый период данное устройство было доступно очень ограниченному числу пациенток и в рассматриваемый нами период времени широко не применялось.
На развитие ВПР также оказывает влияние неудовлетворительный гликемический контроль в периконцептуальном периоде. По данным Федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр эндокринологии» Министерства здравоохранения Российской Федерации, только около 50% больных СД имеют уровень HbA1c менее 7%. С учетом того, что для большинства женщин репродуктивного возраста (младше 40 лет) целевым HbA1c является 6,5%, можно предположить еще меньшее число женщин с удовлетворительным контролем гликемии [20].
Гипергликемия до беременности и в I триместре беременности чаще наблюдается у женщин с СД 1 типа. Наличие гипергликемии в период времени, соответствующий формированию органов и систем плода, объясняет максимальную частоту ВПР в данной группе [21]. Одним из распространенных типов ВПР у новорожденных от матерей с СД 1 типа являются пороки сердечно-сосудистой системы. По нашим данным, женщины c прегестационным СД имели в 4,81 раза больший риск рождения ребенка с данной группой пороков, которые формируются в первые 3–7 недель гестации. Другие исследователи также отмечают большую частоту ВПР сердечно-сосудистой системы у детей женщин, страдающих СД 1 типа [22, 23]. Механизмы, объясняющие данные зависимости, изучены плохо. Работы на животных показали, что гипергликемия стимулирует окислительный стресс, при котором увеличивается количество окисленных радикалов кислорода и азота, что способствует возникновению генетических изменений и нарушений процессов апоптоза в клетках сердца [24]. С другой стороны, в условиях гипергликемии наблюдается изменение множества сигнальных путей в миокарде, например, таких, как усиление экспрессии трансформирующего фактора роста бета 1 (TGF-β1), что приводит к чрезмерному накоплению белков внеклеточного матрикса в тканях сердца. Кроме того, отмечается снижение уровня оксида азота, необходимого для правильного функционирования эндотелиальных клеток сердца. Снижение уровня оксида азота, в свою очередь, приводит к ингибированию других сигнальных путей [25]. Также была описана связь между высоким уровнем глюкозы и последующей плацентарной сосудистой дисфункцией из-за дисрегуляции фактора роста эндотелия сосудов с последующим влиянием на кардиогенез [24]. По данным литературы, наиболее распространенным вариантом ВПР являются аномалии сердечно-сосудистой системы, однако 20–30% данной патологии представлено транзиторной гипертрофической кардиомиопатией вследствие нестабильной гликемии во время беременности, что искусственно увеличивает количество случаев. Среди наиболее частой патологии – дисфункция митрального клапана и дополнительные и эктопические хорды в полости левого желудочка (70,1%); в 23,6% диагностируется пролапс митрального клапана без регургитации [12].
Гестационный СД наиболее часто диагностируется во II триместре беременности, когда основной этап онтогенеза завершен; поэтому наличие гестационного СД чаще увеличивает риск развития так называемых «малых» форм ВПР. Вероятность гипергликемии увеличивается с увеличением срока гестации, оказывая непосредственное негативное влияние на плод преимущественно во второй половине беременности [26]. В нашем исследовании женщины с гестационным СД имели повышенный в 4–5 раз риск рождения ребенка с врожденными аномалиями бронхолегочной системы. По данным литературы, эти ВПР являются достаточно редкими, составляя 5–18% всех ВПР. В доступной литературе объяснения возможных механизмов развития данных пороков ограничены; наиболее вероятным представляется увеличение экспрессии 10-го фактора роста фибробластов (Fibroblast growth factor 10, FGF10), приводящее к нарушению формирования бронхолегочной системы [9].
Другой группой врожденных аномалий, ассоциированных с гестационным СД, является патология мочевыделительной системы. В ранее проведенном на основании данных РРМО исследовании уже отмечался повышенный в 4,77 раза риск аномалий мочеполовой системы у новорожденных от матерей с прегестационным и гестационным СД, представляющих собой единую группу [27]. Среди возможных механизмов указываются гипергликемия матери, компенсаторная гиперинсулинемия во время беременности вследствие инсулинорезистентности, а также транзиторный гиперкортицизм у плода [28].
Необходимо отметить, что влияние СД во время беременности на плод в целом и на формирование отдельных его систем в частности остается не до конца изученным ввиду сложности интерпретации взаимосвязей и большого количества факторов, действующих на беременную женщину и плод.
Проведенное исследование является первым на территории Российской Федерации популяционным регистровым исследованием, изучившим связь между СД у беременных и риском возникновения ВПР у плода, используя данные более 134 тыс. наблюдений, из которых только 8% имели недостающие данные по переменным, включенным в анализ. Однако сила и значимость связей, выявленных в ходе данного исследования, демонстрирует важность СД как потенциального предиктора ВПР, который должен учитываться при отборе прогностических факторов развития ВПР при разработке систем принятия решения на основе методов машинного обучения и интеллектуальной обработки данных [29, 30].
Используемые в исследовании популяционные регистры охватывают более 99% родов, при этом доля недостающих данных по отдельным переменным не превышает 6%. Это обусловливает низкую вероятность ошибок отбора, что является преимуществом данного исследования. Вместе с тем исследование имеет ряд ограничений, связанных с вероятностью информационных ошибок и историческим изменением подходов к диагностике изучаемых состояний. Изменение диагностических подходов к определению гестационного СД может явиться причиной того, что в регистре, основанном на первичной медицинской документации, учтены не все случаи данного состояния в соответствии с действующими на данный момент диагностическими критериями, что может повлиять на результаты оценки взаимосвязи, в первую очередь в части ее недооценки. Подобная мисклассификация, вызванная повышением качества диагностики в последние годы ведения регистров, может быть характерна и для ВПР. В связи с недостаточной валидностью и высокой долей отсутствующих данных в настоящее исследование не была включена информация о проводимом лечении и, как следствие, степени контроля гликемии, что не позволило выполнить соответствующую коррекцию на указанные конфаундеры. В то же время мы считаем, что в отсутствие лабораторных данных об уровне гликированного гемоглобина, информация о получаемом лечении (диетотерапия, инсулинотерапия) не могла оказать существенного влияния на полученные результаты. Кроме того, следует отметить, что как в РРАО, так и в РРМО зарегистрированы случаи ВПР, диагностированные в период нахождения детей в учреждениях родовспоможения, то есть те аномалии, которые манифестировали в первые дни жизни ребенка.
Заключение
Прегестационный и гестационный СД увеличивают риск рождения детей с врожденными аномалиями; при этом у новорожденных от женщин с прегестационным СД отмечался значимо более высокий риск ВПР. Среди отдельных групп ВПР значимое увеличение риска отмечено для врожденных аномалий глаза, уха, лица и шеи; врожденных аномалий системы кровообращения; группы других врожденных аномалий, включая множественные. Гестационный СД в пять раз увеличивал риск рождения ребенка с ВПР органов дыхания.
Результаты исследования подтверждают важность адекватного контроля гликемии на этапе планирования беременности и во время наблюдения за ее течением для снижения риска неблагоприятных исходов для плода и ребенка. Данные о прегестационном и гестационном СД должны включаться в прогностические модели, разрабатываемые для определения риска развития врожденных аномалий.



