По оценкам Международной диабетической федерации (International Diabetes Federation), в 2021 г. распространенность сахарного диабета (СД) среди взрослого населения составила 9,3% (537 млн человек) и при сохранении такого темпа прироста достигнет 10,9% (783 млн) к 2045 г. [1]. СД осложняет течение 16,7% беременностей, из которых 10,6% приходится на прегестационные типы (СД 1 и 2 типов), 9,1% – на манифестный (впервые выявленный во время беременности) диабет, 80,3% – на гестационный СД (ГСД) [1]. Достижения последних лет в области акушерской диабетологии позволили пролонгировать беременность у женщин с СД и снизить частоту развития осложнений как со стороны матери, так и новорожденного [2]. Однако риски неблагоприятных исходов беременности, протекающей на фоне СД, все еще превышают таковые в общей популяции.
Достоверно доказано, что на фоне нарушения углеводного обмена у матери происходит избыточный рост плода с формированием его макросомии [3]. Макросомия связана с риском родового травматизма не только со стороны матери (глубокие разрывы тканей промежности, гипотоническое кровотечение, осложненное течение послеродового периода), но и со стороны новорожденного (дистоция плечиков (ДП), травмы плечевого сплетения, смещение шейного отдела позвоночника вследствие чрезмерной экстракции в родах, неврологическая патология). Макросомия плода может развиваться с пропорциональным увеличением всех фетометрических параметров (конституциональный тип) или с увеличением размеров груди и живота относительно размеров головки плода (асимметричный тип) [3].
Одним из самых частых осложнений вагинальных родов при макросомии плода является ДП, при которой после рождения головки плечо ребенка встречает препятствие в виде лобковой или крестцовой кости матери, и дальнейшее продвижение его туловища приостанавливается. Развитие данного осложнения характеризуется высоким риском интранатальной заболеваемости и смертности, а для его преодоления возникает необходимость в проведении дополнительных родовых маневров для успешного родоразрешения [2]. К наиболее значимым факторам риска развития ДП плода авторы относят макросомию плода, наличие СД и ожирения у матери [4–8].
Макросомия плода является важным фактором риска развития у него ДП в родах. Макросомией плода принято считать превышение им антропометрических показателей более 90-го перцентиля для срока гестации или массу ребенка при рождении более 4000 г. Исследование Overland E.A. et al. (2012) продемонстрировало прямую зависимость между массой плода и отношением шансов (ОШ) риска ДП: 3500–3999 г (OШ – 3,2), 4000–4499 г (ОШ – 17,2), 4500–4999 г (ОШ – 60,3), более 5000 г (ОШ – 176,52) [4]. Однако существуют сведения о том, что большая часть детей, родившихся массой более 4500 г, не имели подобного осложнения в родах, а в 48% случаев ДП возникала даже при массе плода менее 4000 г [5]. Не менее важным фактором риска ДП являются анамнестические данные о развитии ДП плода во время предыдущих родов. В случае наличия этого осложнения у матери в анамнезе частота ДП в 10 раз выше по сравнению с общепопуляционными показателями [5, 6].
Установлено, что независимым фактором риска развития ДП является не только макросомия плода, но и наличие СД у матери: ОШ 2,23 (95% доверительный интервал (ДИ) 2,00–2,48) [7, 8]. Повышение этого риска при СД связано с развитием у плода симптомокомплекса диабетической фетопатии (ДФ). При ДФ жировая ткань у плода скапливается неравномерно: большая ее часть локализуется в верхней половине туловища. Рост жировой ткани закономерно приводит к увеличению массы плода и в сочетании со скоплением жира преимущественно в области плечевого пояса обуславливает повышение риск возникновения ДП в родах.
Учитывая крайне неблагоприятное влияние ДП на перинатальные исходы, существует необходимость в разработке доступных моделей прогнозирования данного осложнения родов у женщин с СД.
Цель работы: провести анализ факторов риска ДП плода в родах у женщин с СД и оценить вклад установленных детерминант неблагоприятных акушерских и перинатальных исходов в реализацию данного осложнения.
Материалы и методы
Проведено ретроспективное когортное исследование на базе ФГБНУ «НИИ АГиР им. Д.О. Отта», Санкт-Петербург (Diabetes In Pregnancy StudY, DIPSY). План исследования и представление работы полностью соответствуют Руководству STROBE к описанию когортных исследований [9]. Проведение данного исследования одобрено локальным Этическим комитетом (выписка из протокола № 83 от 21.04.2017 г.).
Беременные с различными типами СД, родоразрешенные за 10 лет (2008–2017 гг., n=3261), составили следующие группы сравнения:
- 1 – СД 1 типа (n=506);
- 1a – получавшие постоянные подкожные инъекции инсулина (ППИИ) – 60 (11,86%);
- 1b – получавшие множественные инъекции инсулина (МИИ) – 446 (88,14%);
- 2 – СД 2 типа (n=229);
- 2a – получавшие диету – 95 (41,5%);
- 2b – получавшие инсулинотерапию – 134 (58,5%);
- 3 – ГСД (n=2387);
- 3a – получавшие диету – 1652 (69,2%);
- 3b – получавшие инсулинотерапию – 735 (30,8%);
- 4 – группа контроля (n=139).
Критерии включения в исследование (основные группы): наличие СД 1, 2 типов, ГСД; одноплодная беременность; согласие пациента на участие в программе исследования.
Критерии включения в исследование (контрольная группа): отсутствие нарушений углеводного обмена; отсутствие ожирения; одноплодная беременность; согласие пациента на участие в программе исследования.
Критерии исключения из исследования:
- заболевания, определяющие симптоматический диабет: тиреотоксикоз, гиперадренокортицизм, соматотропинома, феохромоцитома;
- тяжелая соматическая патология;
- онкологические заболевания;
- многоплодная беременность;
- отказ пациента от участия в программе исследования.
В качестве детерминант, определяющих риск ДП у женщин с СД, были выделены: масса плода, возраст пациентки, прегестационный индекс массы тела, гестационная прибавка массы тела, длительность заболевания СД (стаж), уровень гликированного гемоглобина в I триместре у женщин с прегестационными типами СД.
Статистический анализ
Статистическую обработку данных проводили с использованием SPSSV.23.0 (США). Параметры распределения выборки оценивались при помощи критерия Колмогорова–Смирнова. Для описания количественных данных, имеющих нормальное распределение, рассчитывалось среднее арифметическое (М) и стандартное отклонение (SD). Для выявления различий между группами применялся однофакторный дисперсионный анализ (ANOVA), для апостериорных сравнений – критерий Тьюки. При распределении признаков, отличающемся от нормального, данные рассчитывались в виде медианы (Me) и интерквартильного интервала в формате Me (Q1; Q3). Для сравнения групп по номинальным признакам применяли критерий χ². Применялся расчет ОШ с 95% ДИ для выявления связи признаков и воздействия изучаемого фактора на исход. Критический уровень значимости при проверке статистических гипотез принимался равным 0,05.
Результаты
Возраст женщин в исследуемых группах различался: больные с СД 2 типа были старше по сравнению с пациентками других групп. Наибольший возраст – 34,0 (5,2) года наблюдался у беременных с СД 2 типа на инсулинотерапии. Наименьший возраст был отмечен у беременных с СД 1 типа, получавших МИИ. При оценке индекса массы тела наибольшие значения наблюдались у женщин с СД 2 типа: на диете – 33,8 (6,6) кг/м2, на инсулинотерапии – 33,8 (6,2) кг/м2, а наименьшие – у обследуемых контрольной группы – 24,0 (3,1) кг/м2 (р<0,0001). Также этот показатель был достоверно выше у беременных с ГСД по сравнению с группой контроля (p<0,05). У беременных с СД 1 типа ожирение зарегистрировано в 16,7% (10/60) случаев при ППИИ и в 20,8% (93/446) – при МИИ, причем более тяжелые степени ожирения (II, III) встречались крайне редко – у 3,5% (16/446) пациенток, получающих МИИ. Распространенность ожирения у беременных с СД 2 типа была наибольшей: 62,1% (59/95) при коррекции диетой и 70,9% (95/134) – при инсулинотерапии, при этом более высокие степени ожирения (II, III) превалировали в этих подгруппах соответственно. У беременных с ГСД ожирение наблюдалось вдвое реже по сравнению с пациентками с СД 2 типа, частота тяжелых степеней ожирения не превышала 10% как при диетотерапии, так и при инсулинотерапии (р<0,0001). У 82,7% (115/134) женщин контрольной группы индекс массы тела не превышал 25 кг/м2 (табл. 1).
Развитие макросомии плода осложняло значимую долю беременностей на фоне СД. Каждая четвертая беременность у женщин с СД 1 типа (ППИИ – 26,7% (16/60); МИИ – 24,9% (111/446)), каждая пятая у пациенток с ГСД – 19,7% (326/1652) диетотерапия; инсулинотерапия – 21,4% (157/735), и каждая шестая у женщин с СД 2 типа – 17,9% (17/95) диетотерапия; инсулинотерапия – 15,7% (21/134) заканчивались рождением крупного плода (табл. 1).
Ультразвуковые признаки ДФ (антенатально) были установлены у 15,2–16,6% женщин с СД 1 типа. У пациенток с СД 2 типа и ГСД частота диагностики ДФ по данным эхографии наблюдалась не более чем в 10% случаев. При этом проявления симптомокомплекса ДФ постнатально были установлены в 4 раза чаще с наибольшей долей встречаемости у родильниц с СД 1 типа – 61% и СД 2 типа на инсулинотерапии – 37,3% (50/134) (табл. 1).
ДП плода чаще встречалась у рожениц с СД 2 типа: у 5,3% (5/95) получавших диетотерапию, у 3,0% (4/134) на инсулинотерапии. У пациенток с СД 1 типа частота ДП была выше в случае коррекции гипергликемии МИИ – 2,5% (11/446), чем при ППИИ – 1,7% (1/60). У женщин с ГСД ДП плода в родах наблюдалась у 1,4% (10/735) рожениц, получавших инсулинотерапию, и у 0,6% (10/1652) на диете (табл. 1).
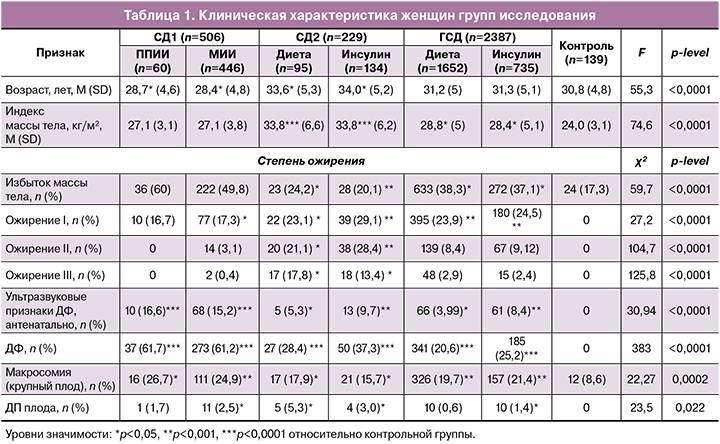
По данным нашего исследования, при наличии любого типа СД у беременной минимальная масса плода, при которой значимо повышается риск ДП, составляет 4250 г. Интересно, что у пациенток с СД 1 типа ОШ риска ДП резко повышалось уже при массе плода более 4500 г, а у пациенток с СД 2 типа и ГСД – при массе плода более 4750 г (рис. 1). Вместе с тем ОШ риска возникновения этого осложнения в родах у женщин, страдающих любым типом СД, увеличивалось в 5 раз при массе плода, превышающей 4750 г (ОШ 4,86; 95% ДИ 1,32–14,5) (табл. 2).
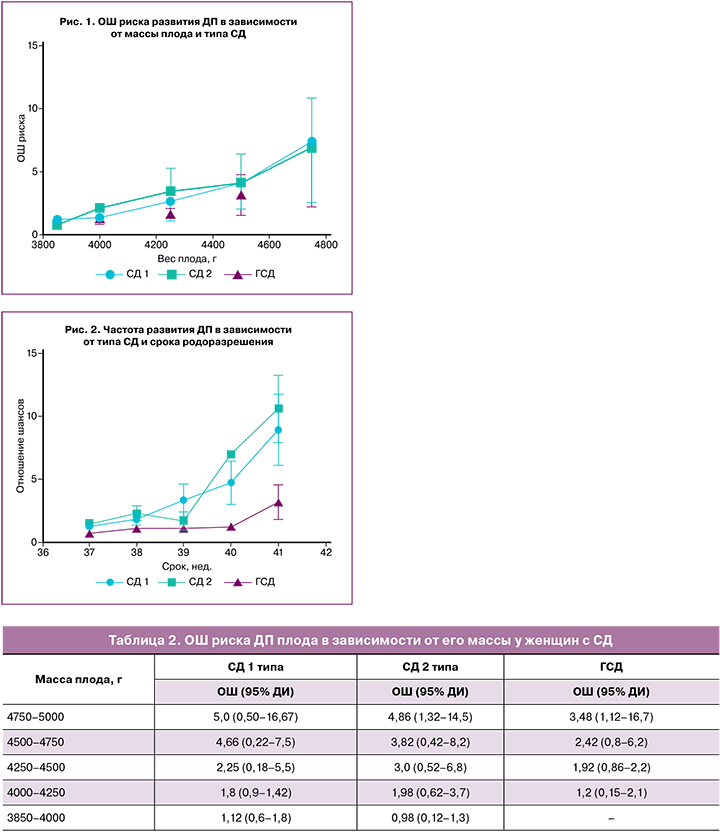
Известно, что риск развития ДП повышается с увеличением срока беременности, независимо от наличия других факторов. В нашем исследовании показано, что с увеличением гестационного срока более 40 недель у пациентов с прегестационными типами СД и более 41 недели у женщин с ГСД ОШ риска ДП драматично увеличивается в несколько раз, достигая наибольших значений у рожениц с СД 1 и 2 типов (рис. 2).
Следующим этапом исследования было определение вклада различных факторов риска в развитии ДП. В качестве ведущих детерминант были выделены: возраст женщины, прегестационный индекс массы тела, прибавка массы тела во время беременности, длительность заболевания СД (стаж), уровень гликированного гемоглобина в I триместре беременности у женщин с прегестационными типами СД.
Результаты исследования демонстрируют, что ОШ риска ДП плода в родах у женщин с СД 1 типа и ГСД повышается с увеличением возраста матери, достигая наибольших значений после 35 лет (табл. 3). Интересно, что для пациенток с СД 2 типа такая закономерность была менее характерна. Для женщин с СД 2 типа и ГСД (ОШ 1,88; 95% ДИ 0,83–9,5; ОШ 3,66; 95% ДИ 1,68–6,4) ожирение II и III степени являются значимыми факторами риска ДП. Гестационная прибавка массы тела более 15 кг у всех женщин с СД увеличивала риск развития ДП плода в 1,5 раза. При этом у беременных с СД 2 типа общая прибавка массы тела более чем на 20 кг повышает ОШ риска развития ДП в 6,2 раза (ОШ 6,2; 95% ДИ 1,12–29,6), а при ГСД даже общая прибавка массы тела более 25 кг увеличивает риск этого осложнения в 3,5 раза (ОШ 3,47; 95% ДИ 1,9–12,4) (табл. 3).

Повышенный уровень гликированного гемоглобина в I триместре у женщин с прегестационными типами СД являлся не менее значимым фактором риска ДП плода в родах. Наблюдалась прямая зависимость между повышением уровня гликированного гемоглобина и ОШ риска данного осложнения. Наибольшие значения ОШ наблюдались при показателях гликированного гемоглобина 7,1–7,5%: ОШ при СД 1 типа – 4,45 (95% ДИ 1,34–9,2), ОШ при СД 2 типа – 3,42 (95% ДИ 1,57–8,9) (табл. 3).
Длительность заболевания СД (стаж) не показала значимости в качестве валидного предиктора в отношении риска реализации ДП плода в родах, что может говорить о большей роли компенсации углеводного обмена во время настоящей беременности.
Обсуждение
ДП плода в родах – одно из наиболее грозных акушерских осложнений, которое может привести к гибели плода. Опубликованные в 2021 г. результаты опроса, проведенного среди испанских резидентов и практикующих врачей, показали, что 87,1 и 60,4% респондентов соответственно не уверены в своих навыках и чувствуют недостаток точных критериев оценки, постановки диагноза и рекомендаций по ведению пациенток при ДП плода [10]. Очевидно, что рост распространенности ожирения и СД среди беременных будет закономерно увеличивать частоту встречаемости данного осложнения в родах. Таким образом, для практикующего акушера важным является не только точное знание практических подходов к родоразрешению в случае ДП, но и возможности прогнозирования данного осложнения.
В метаанализе Beta J. et al. (2019), включавшем 17 исследований, авторы с использованием модели случайных эффектов проанализировали данные об осложнениях у матери и/или новорожденного в случае макросомии плода [11]. При массе плода >4000 г был повышен риск осложнений со стороны матери: ОШ риска экстренного кесарева сечения – 1,98 (95% ДИ 1,80–2,18), послеродового кровотечения – 2,05 (95% ДИ 1,90–2,22), глубоких разрывов промежности – 1,91 (95% ДИ 1,56–2,33). Значения ОШ при массе плода >4500 г составили: ОШ экстренного кесарева сечения – 2,55 (95% ДИ 2,33–2,78), послеродового кровотечения – 3,15 (95% ДИ 2,14–4,63) и глубоких разрывов промежности – 2,56 (95% ДИ 1,97–3,32). Подобным образом сравнивали риск неонатальных осложнений: при массе плода более 4000 г ОШ риска ДП составило 9,54 (95% ДИ 6,76–13,46), травмы плечевого сплетения – 11,03 (95% ДИ 7,06–17,23), переломы костей – 6,43 (95% ДИ 3,67–11,28). При массе плода >4500 г ОШ риска для этих категорий составило: 15,64 (95% ДИ 11,31–21,64), 19,87 (95% ДИ 12,19–32,40) и 8,16 (95% ДИ 2,75–24,23) соответственно [11]. Похожие результаты получены и в нашем исследовании.
В результате проведенного исследования установлено, что наличие любого типа СД у женщины во время беременности является независимым фактором риска ДП плода в родах. Наибольшая частота встречаемости ДП наблюдалась у рожениц с СД 2 типа (3,0–5,3%), что связано не только с гипергликемией, но и с высокой частотой ожирения среди этих пациенток, которое является независимым фактором риска ДП в родах [2, 5]. Несколько меньшие показатели встречаемости ДП определялись у пациенток с СД1 типа (1,7–3,5%) и ГСД (0,6–1,4%). Установлено, что масса плода более 4250 г является достоверным фактором повышения риска ДП в родах у женщин с нарушениями углеводного обмена.
Вклад СД у матери во время беременности как важного фактора риска ДП плода в родах впервые продемонстрировал Acker D.B. et al. в 1985 г. [12]. В данном исследовании установлен пятикратный риск ДП плода у женщин с нарушением углеводного обмена даже в том случае, когда масса плода составляла менее 4000 г [13]. В материалах обширного популяционного исследования Nesbitt T.S. et al. (1998) выявлено, что наличие СД у матери значимо увеличивает вероятность развития ДП (ОШ – 1,7) с сохранением данной закономерности при увеличении массы плода и при акушерских родоразрешающих операциях (ОШ 1,7–10,1) [7]. Авторами показано, что дети массой 3750–4000 г, рожденные от матерей с СД, имеют равнозначный риск развития ДП в родах по сравнению с детьми массой 4250–4500 г от матерей без нарушений углеводного обмена [7]. Langer O. et al. (1991), проанализировав 75 979 естественных родов (1589 родов у женщин с СД), установили, что у рожениц с СД риск развития ДП плода увеличивается в 10 раз (3,2% против 0,3% в популяции) [13]. Casey B.M. et al. (1997) показали, что у матерей с ГСД риск развития ДП у плода возрастает в 3 раза по сравнению с общей популяцией [14]. В другом исследовании показано, что частота ДП плода у матерей с СД достигает 8,4–16,7% по сравнению с 1,4% у пациенток без нарушений углеводного обмена. При массе плода более 4500 г ДП развивается в 20–50% случаев при наличии СД у матери и в 9,2–24% случаев – при его отсутствии [15].
Среди неблагоприятных последствий ДП для новорожденного выделяется паралич плечевого сплетения (ППС). Риск развития ППС прямо пропорционален риску ДП [16]. Ecker J.L. et al. (1997) на основании анализа 77 616 родов изучили факторы риска возникновения ППС, который наблюдался в 80 случаях в исследованной популяции (1,03‰) [16]. 3526 (4,5%) из 77 616 беременных женщин в исследовании имели ГСД. Результаты свидетельствуют о том, что ГСД (ОШ 3,19; 95% ДИ 1,62–6,27) и крупные размеры плода при естественных родах (ОШ 9,56–17,9) являются независимыми факторами риска ДП в родах и развития ППС [16]. Bryant et al. (1998) показали, что частота развития ППС прямо пропорционально растет с увеличением массы плода: от 0,8% (3500–3999 г); 3,3% (4000–4499 г); 8% (4500–4999 г) до >20% при массе плода более 5000 г [17].
Помимо массы плода, еще одним фактором, увеличивающим риск развития ДП, являются акушерские родоразрешающие операции. Исследование Kolderup L.B. et al. (1997) показало, что применение акушерских родоразрешающих операций при макросомии плода увеличивает риск ДП и развития ППС в 6,7 раза: акушерские щипцы – в 3,8 (95% ДИ 3,5–5,9), вакуум-экстрактор – в 2,9 (95% ДИ 1,1–8,0) [18]. С другой стороны, наличие макросомии плода также является независимым фактором риска влагалищных родоразрешающих операций (ОШ 6,8) [19]. Не менее значимым фактором, приводящим к увеличению риска ДП плода в родах, является необоснованная и агрессивная тактика ведения родов: раннее растуживание женщины, несвоевременная коррекция аномалий сократительной деятельности матки, родостимуляция окситоцином [19–23].
Важную роль в профилактике ДП плода и ассоциированного с ним родового травматизма играют способы прогнозирования данного осложнения. Наше исследование продемонстрировало, что использование простых и наглядных значений (масса плода, возраст женщины, прегестационный индекс массы тела, прибавка массы тела во время беременности, уровень гликированного гемоглобина в I триместре беременности у женщин с прегестационными типами СД) помогает отнести женщин с СД 1 и 2 типов, ГСД к различным группам риска развития ДП. Это подтверждается и другими исследованиями. В 2006 г. было опубликовано ретроспективное контроль-зависимое исследование для разработки прогностической модели определения риска ДП плода в родах [24]. Авторы сообщили, что наилучшей комбинацией переменных для выявления неонатальной травмы, связанной с ДП, являются: рост и вес матери, срок беременности, паритет и вес новорожденного [24]. При балле более 0,5 выявлено 50,7% случаев ДП с ППС, коэффициент ложноположительных результатов составил 2,7%. Однако данные, используемые для этой системы прогнозирования, были основаны на фактической массе тела при рождении, а не на предполагаемой массе плода. Стоит отметить, что клиническая оценка предполагаемой массы плода ненадежна, ультразвуковое сканирование в III триместре имеет по крайней мере 10% погрешность к фактической массе тела ребенка при рождении и только 60% чувствительность для предикции макросомии плода (более 4500 г) [25–27].
Исследование Kleitman V. et al. (2016) продемонстрировало, что женщины с ДП плода в анамнезе чаще были старше, имели ГСД, макросомию плода, многоводие, пролонгированный второй период родов [28]. Наличие ДП плода в предыдущих родах оказалось независимым фактором риска повторного развития этого осложнения (ОШ 6,1; 95% ДИ 3,2–11,8) в многопараметрическом регрессионном анализе [27].
По данным Мочаловой М.Н. и соавт. (2016), прогностически благоприятными факторами при ведении родов крупным плодом через естественные родовые пути являются: наличие родов в анамнезе, срок гестации не более 39 недель, симметричная форма макросомии плода, отсутствие ожирения у матери и периодов гипергликемии у нее во время беременности [29]. В развитии ДП значимую роль играет отношение размера головки плода к поперечному размеру плечиков [28].
Другие исследования, напротив, продемонстрировали, что ДП плода является трудно предсказуемым осложнением в родах [25, 26]. Ouzounian J.G. et al. (2016) изучили наиболее значимые прогностические факторы риска реализации данного осложнения: макросомия плода или подозрение на макросомию, пролонгированный второй период родов, наличие у матери СД и использование окситоцина в родах [26]. Авторами установлено, что ни одна из моделей не обладала высокой чувствительностью или высокой специфичностью, положительной прогностической ценностью для прогнозирования ДП плода [26].
В систематическом обзоре Al-Hawash S. et al. (2019), посвященном проблеме рецидивирующей ДП, продемонстрировано, что многие факторы риска широко распространены у рожениц, у которых данное осложнение отсутствовало в анамнезе [30]. Кроме этого, женщины с повторной ДП плода редко имели идентифицируемые факторы риска, за исключением предшествующей ДП в анамнезе [30]. Размеры выборки многих исследований, посвященных данному вопросу, представляют собой одноцентровые ретроспективные когорты с низкой частотой последующих беременностей и вагинальных родов, поскольку многие женщины предпочли выбрать кесарево сечение при последующей беременности. Таким образом, высокий уровень предвзятости и неоднородности исследований не позволил провести качественный метаанализ [30]. Таким образом, ДП плода остается в значительной степени непредсказуемым клиническим явлением.
Помимо прогнозирования, важным вопросом является вопрос профилактики ДП плода у женщин с СД. Очевидно, что индукция родов при «почти доношенном сроке» 37–39 недель может помочь избежать развития избыточного роста плода и закономерно снизить риск ДП в этой ситуации [31]. Это подтверждается и нашим исследованием, показавшим, что роды у пациенток менее 39–40 недель с прегестационными типами СД и менее 40–41 недель с ГСД ассоциированы с меньшим риском развития ДП плода (рис. 2). Похожие результаты получены и другими авторами. Рандомизированное контролируемое исследование Boulvain M. et al. (2015) показало, что индукция родов при подозрении на макросомию плода приводит к более низкой его массе при рождении, меньшей частоте ДП и родового травматизма, кесарева сечения [32]. Однако результаты работ, включенных в обзор, показывают, что для предотвращения одного перелома ключицы требуется выполнить порядка 60 индукций родов [32]. Таким образом, необходимы дальнейшие исследования, посвященные индукции родов при подозрении на макросомию плода. Особый акцент в данных работах должен быть направлен на уточнение оптимального срока для индукции родов и повышение точности диагностики макросомии плода.
Нами установлено, что стаж СД не является предиктором риска ДП плода у женщин с СД. Данный факт может быть обусловлен тем, что наличие диабетической васкулопатии, характерной для пациенток с длительным стажем СД, приводит к высокому риску развития преэклампсии и ассоциированного с ней досрочного родоразрешения (чаще путем операции кесарева сечения), а также фетоплацентарной недостаточности с формированием замедления роста плода [33].
Заключение
Проведенное нами исследование позволило определить ряд критериев, которые позволят врачу улучшить прогнозирование риска возникновения ДП во время родов у женщин с различными типами СД. Наиболее значимыми факторами риска ДП явились: масса плода более 4250 г, возраст матери (>30 лет), прегестационный индекс массы тела (>30 кг/м2), уровень гликированного гемоглобина в I триместре (>6,5%).
Тем не менее следует применять индивидуализированный подход и принимать решение исходя из анамнеза, клинических наблюдений и конкретной ситуации для компетентной оценки рисков развития ДП плода у женщин с СД в родах.



