В последние годы решение проблем репродукции сопряжено с ростом интереса исследователей к состоянию эндометрия. Обладая уникальным биологическим потенциалом, слизистая оболочка матки имеет сложное строение и постоянно меняющуюся функциональную активность, что с одной стороны позволяет осуществлять важные функции в рамках репродуктивной системы, а с другой стороны делает эндометрий уязвимым звеном этой системы [1, 2]. У женщин с бесплодием хронический эндометрит встречается в 12–68% случаев, достигая своего максимума при наличии трубно-перитонеального фактора бесплодия. Наибольшие показатели распространенности хронического эндометрита отмечены у больных с привычным невынашиванием беременности и составляют более 70% [3–5].
Хорошо изучены морфологические изменения эндометрия, возникающие при длительной и часто бессимптомной персистенции инфекционных агентов в слизистой оболочке матки [6, 7]. В многочисленных исследованиях показаны изменения в стркутуре и функции эндометрия, которые проявляются нарушением пролиферации и циклической трансформации ткани. Эндометрий содержит большое число иммунокомпетентных клеток, при этом их фенотипический состав, определяющий активность клеточного и гуморального звеньев иммунитета, оказывает прямое действие на процессы имплантации и плацентации [8–11]. Иммуноморфологическая оценка эндометрия при хроническом воспалении позволяет оценить рецептивность эндометрия при данной патологии и более обоснованно подойти к вопросам прегестационной подготовки женщин с репродуктивными нарушениями [12–19].
Материалы и методы исследования
Работа выполнена в период с 2009 по 2012 г. на кафедре акушерства и гинекологии института последипломного образования ГБОУ ВПО Красноярский государственный медицинский университет им. профессора В.Ф. Войно-Ясенецкого Минздрава России. Набор клинического материала проводился на базе ООО Медицинский Центр гинекологической эндокринологии и репродукции «Три сердца». Ииммуноморфологическое исследование эндометрия проводилось на базе патологоанатомического отделения Дорожной клинической больницы на ст. Красноярск.
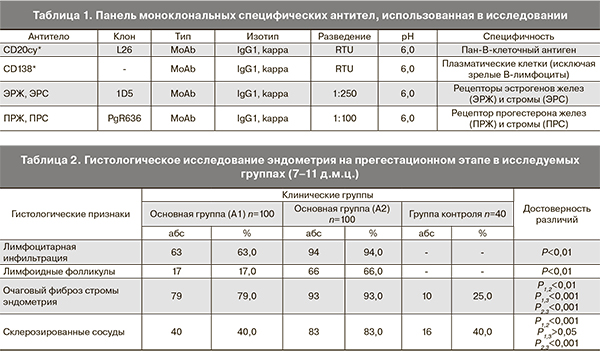
Проведено проспективное когортное исследование 283 женщин репродуктивного возраста на этапе прегестационной подготовки. В основную группу были включены 200 женщин, разделенных на подгруппу А1 – 100 женщин с трубно-перитонеальным бесплодием, которым было проведено обследование и необходимое лечение, включая программу ЭКО, и подгруппу А2 – 100 женщин с потерями беременности в анамнезе. Группу контроля составили 83 здоровые женщины репродуктивного возраста, не имевшие хронических соматических заболеваний и какой-либо патологии репродуктивной системы. Иммуноморфологическому исследованию подвергался материал, включающий вакуум-аспираты из полости матки, соскобы эндометрия, полученные в ходе гистероскопии (табл. 1).
При иммуногистохимическом исследовании рецепторов эстрогенов и прогестерона отдельно анализировались клетки стромы (отросчатые фибробласты) и эпителия желез. Определялось общее количество окрашенных клеток стромы и эпителиоцитов. При оценке результатов иммуногистохимического окрашивания в отношении стероидных рецепторов в расчетах учитывалось только ядерное окрашивание.
Расчет проводился по формуле: ∑ P(i) × I, где I = интенсивности ядерного окрашивания: 0 – нет окрашивания, 1 – слабое окрашивание, 2 – умеренное окрашивание, 3 – хорошее окрашивание, Р(i) – процент клеток с соответствующим окрашиванием.
При оценке результатов окрашивания с антителами CD20+, CD138+ учитывалось позитивное окрашивание цитолеммы клеток. Полученные результаты выражались в виде среднего количества иммуноцитов с соответствующим иммунофенотипом в поле зрения при увеличении х400. Иммуногистохимическое окрашивание проводилось с применением двухшаговой полимерной системы визуализации «EnVision+Dual Link System-HRP» Dako Cytomation.
Результаты исследования
Рутинное морфологическое исследование подтвердило наличие хронического эндометрита у женщин основной группы, имеющих репродуктивные нарушения по сочетанию всех морфологических признаков в 17,0% (17) в подгруппе А1 и в 66,0% (66) в подгруппе А2 (Р<0,01), в контрольной группе данных морфологических сочетаний не выявлено (табл. 2).
Проявления хронического воспаления сочетались у пациенток с трубно-перитонеальной формой бесплодия (А1) с полипами эндометрия. Железистые полипы выявлялись в 14,0% (14) случаев, железисто-фиброзные полипы эндометрия в 38,0% (38) с достоверностью различий Р<0,01 с пациентками подгруппы А2. Среди пациенток с невынашиванием беременности полипообразование отмечено в 12,0% (12) наблюдений.
С целью изучения субпопуляций лимфоцитов предпринято иммуногистохимическое исследование. Антиген зрелых В-лимфоцитов CD20+ в группе контроля интенсивно мембранно экспрессируется лишь в небольшом количестве клеток лимфоидного ряда. Последние немногочисленны, в ряде наблюдений единичны, распределены диффузно и не принимают участия в формировании лимфоидных скоплений. В группе женщин с трубно-перитонеальным бесплодием и после проведения эмпирической антибактериальной терапии количество зрелых СD20-позитивных лимфоцитов остается крайне низким и сопоставимым с таковым в группе контроля, составляя соответственно 0,97±0,5 и 1,05±0,5. Статистически значимые различия выявляются при подсчете CD20-позитивных клеток в группе женщин с невынашиванием беременности, где абсолютные значения данного показателя достигают в среднем 3,02±0,6. Важным отличием представляется обнаружение иммуноцитов CD20+ в непосредственной близости от базальной мембраны, в межэпителиальном пространстве, а также на поверхности покровного эпителия и в просвете желез эндометрия. Обнаружение иммуноцитов, формирующих периваскулярные и перигландулярные скопления, позволяет говорить о выраженной напряженности иммунологических процессов, протекающих в эндометрии (рис. 1а см. на вклейке). При иммуногистохимическом исследовании с применением антител в отношении мембранного эпитопа плазматических клеток в эндометрии группы контроля ни в одном из случаев не удалось выявить СD138-позитивные плазматические клетки. Важным представляется тот факт, что в группе с трубно-перитонеальным бесплодием не происходит статистически значимого увеличения содержания плазматических клеток. CD138-позитивные клетки являются редкой находкой и составляют в среднем 0,01±0,04 в 1 мм2 стромы. Иначе выглядит картина, полученная при анализе плазматических клеток в эндометрии женщин группы А2 с невынашиванием беременности, где их распределение в строме эндометрия сравнительно равномерное, с формированием небольших скоплений вокруг сосудов (рис. 1б см на вклейке). Средняя величина численной плотности CD138-позитивных клеток в строме эндометрия составляет 2,91±1,2, что, несмотря на относительно низкий уровень показателя, статистически значимо больше величин, получаемых в остальных исследуемых группах.
При оценке уровня экспрессии эстрогеновых и прогестероновых рецепторов (рис. 2) выявлено достоверное (P<0,05) снижение уровня экспрессии ЭРЖ и ЭРС у женщин основной группы в первой фазе менструального цикла, что на наш взгляд обеспечивает неадекватную пролиферацию эндометрия и имеет свое отражение при эхографической оценке срединного М-эхо. Обращает на себя внимание более высокий уровень экспрессии ЭРС и ПРС в секреторную фазу цикла у женщин с невынашиванием беременности, что, вероятно, и обеспечивает высокую пролиферативную активность стромы у этой категории пациентов и способствует полипообразованию стромы эндометрия. Динамика экспрессии ЭРЖ и ПРЖ остается достоверно более высокой во второй фазе цикла у пациенток группы А2 в сравнении с группой А1.
Оценка уровня экспрессии эстрогеновых и прогестероновых рецепторов дала нам возможность обоснования гормональной терапии под эхографическим контролем М-эхо, проведение которой более целесообразно во второй фазе менструального цикла.
У женщин с трубно-перитонеальной формой бесплодия на прегестационом этапе в периовуляторном периоде размеры срединного М-эхо составили 9,0+0,09 мм; им назначали дидрогестерон в суточной дозе 20 мг в лютеиновой фазе. Пациенткам с невынашиванием беременности назначали фемостон 2/10 в непрерывном режиме с дополнительным приемом дидрогестерона в дозе 10 мг с 17-го по 25-й день менструального цикла. Показатели срединного М-эхо составили 8,9+0,08 мм и не имели достоверных различий с контрольной группой, где толщина эндометрия без гормональной терапии была 9,3+0,1 мм. Оптимизация прегестационной подготовки пациенток с репродуктивными нарушениями в последующем способствовала достижению беременности в 46,0% у женщин с бесплодием и в 97,0% у пациенток с невынашиванием беременности.
Обсуждение
Иммуноморфологическая оценка эндометрия имеет определяющее значение в проведении этапов прегестационной подготовки пациентов с репродуктивными нарушениями. Так, высокая частота выявления полипов эндометрия у женщин с трубно-перитонеальным бесплодием убеждает в необходимости более широкого применения гистероскопического исследования и гистерорезектоскопического удаления полипов эндометрия у данных пациентов. Оценка гуморального иммунитета указывает на спорные вопросы в назначении повторных курсов эмпирической антибактериальной терапии, которая требуется не более 17,0% больных. Оценка уровня экспрессии эстрогеновых и прогестероновых рецепторов дала нам возможность обоснования гормональной терапии под эхографическим контролем М-эхо, проведение которой более целесообразно во второй фазе менструального цикла.
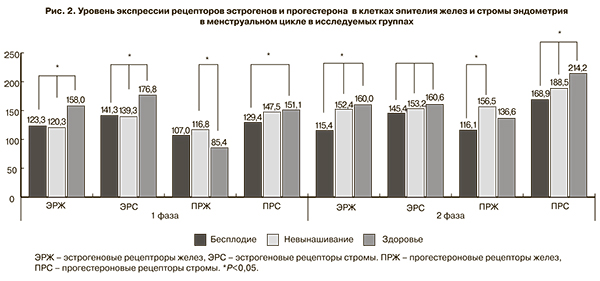
В группе женщин с невынашиванием беременности мы получили убедительные данные о необходимости проведения эмпирической антибактериальной терапии, которая приводит к снижению напряженности гуморальных иммунных реакций в эндометрии. Уровень экспрессии эстрогеновых и прогестероновых рецепторов указывает на необходимость использования 17β-эстрадиола, имеющего более высокий аффинитет к эстрогеновым рецепторам, а гиперэкспрессия ПРС эндометрия указывает на возможность использования дидрогестерона в адекватной секретирующей дозе.
Заключение
Комплексная иммуноморфологическая оценка эндометрия у женщин с репродуктивными нарушениями выявляет значительный спектр факторов определяющих рецептивность эндометрия.
Напряженность гуморального иммунитета в эндометрии обусловлена наличием длительного воспалительного процесса в ткани и значительно изменяется при проведении эмпирической антибактериальной терапии.
Изменение уровня экспрессии эстрогеновых и прогестероновых рецепторов эндометрия обосновывает проведение предгестационной гормональной терапии у женщин с репродуктивными нарушениями.