В настоящее время благодаря совершенствованию вспомогательных репродуктивных технологий, а также улучшению качества акушерской и неонатологической помощи продолжает увеличиваться популяция детей, рожденных ранее 37-й недели гестации. В 2018 г. 97 000 из 1,6 млн новорожденных родились недоношенными (около 6%), в Москве в 2018 г. родились более 5000 недоношенных детей [1]. Недоношенные новорожденные входят в группу высокого риска по развитию перинатальных поражений головного мозга [2–4]. Перинатальные поражения головного мозга проявляются нарушением структуры и функций ЦНС и служат одним из главных факторов формирования тяжелой неврологической патологии и инвалидизации недоношенных детей.
У недоношенных детей наиболее часто регистрируемым структурным повреждением головного мозга является внутрижелудочковое кровоизлияние (ВЖК), частота которого, по данным литературы, обратно пропорциональна гестационному возрасту (ГВ) недоношенных и составляет от 15% до 31% [3]. В 74% случаев ВЖК диагностируются в первые 48 ч постнатальной жизни [4]. Высокая частота ВЖК, особенно у глубоконедоношенных детей, обусловлена комплексом патогенетических факторов: наличием большого количества примитивных сосудов в зоне герминального матрикса; незрелостью ауторегуляции мозгового кровотока, нарушениями центральной гемодинамики и гемостазиологическими расстройствами [3, 5]. Второе место среди структурных поражений головного мозга у недоношенных детей занимает перивентрикулярная лейкомаляция (ПВЛ) [6].
По данным проведенных исследований, системная воспалительная реакция, возникающая у плода при угрозе преждевременных родов, играет одну из ключевых ролей в нарушении созревания олигодендроцитов, что имеет неблагоприятные последствия для развития ЦНС после рождения [3, 7, 8].
Инфекции способствуют неблагоприятным неврологическим исходам перинатальных заболеваний у недоношенных детей. Наиболее часто перинатальная инфекция проявляется в первые дни жизни клинико-лабораторными признаками врожденной пневмонии, которая в подавляющем большинстве случаев имеет бактериальную этиологию. [9]. Частота врожденной пневмонии у детей колеблется в широком диапазоне − от 4 до 20 на 1000 живорожденных, достигая при этом 10:100 среди всех недоношенных детей и 40:100 среди недоношенных, нуждающихся в проведении интенсивной респираторной терапии [9]. Наиболее доступным и информативным методом диагностики структурных нарушений ЦНС у недоношенных детей в условиях стационара является нейросонография (НСГ) [6].
Цель: определить влияние врожденной пневмонии на частоту, морфофункциональные проявления и тяжесть перинатальных поражений ЦНС у недоношенных детей ГВ 28–36 недель.
Материалы и методы
Исследование было выполнено на базе блока А отделения реанимации и интенсивной терапии новорожденных (ОРИТН) им. профессора А.Г. Антонова отделения патологии новорожденных и недоношенных детей Института неонатологии и педиатрии ФГБУ «НМИЦ АГП им. акад. В.И. Кулакова» Минздрава России (Центр). Был включен 271 недоношенный ребенок ГВ 28–36 недель, родившийся в период с января 2017 г. по февраль 2019 г. Из них 132 ребенка были от многоплодной беременности: 55 – двойни, 6 – тройни и 1 – четверня. Критерии включения: недоношенные дети с течением врожденной пневмонии ГВ 28–36 недель. Критерии включения группы сравнения: недоношенные дети с транзиторным тахипноэ новорожденных (ТТН)/респираторным дистресс-синдромом (РДС) ГВ 28–36 недель. Критерии исключения: новорожденные ГВ более 36 недель и 6 дней, недоношенные дети ГВ 22–27 недель, отказ матерей от участия новорожденных в исследовании, недоношенные с множественными пороками развития, TORCH-инфекциями, критическими врожденными пороками сердца, гнойным менингитом и остеомиелитом, отечной формой гемолитической болезни новорожденных, новорожденные, переведенные из отделения реанимации в другой стационар, дети, переведенные из других стационаров.
Проводились стандартные методы клинико-лабораторного исследования, включающие клинический анализ крови, определение кислотно-основного состояния и газов крови в динамике, микробиологическое исследование крови на стерильность, оценку концентрации C-реактивного белка в плазме крови. НСГ выполнялась всем детям в первые 48 ч и в последующие 72–144 ч жизни, последующие исследования (со 2-й недели жизни) назначались по клиническим показаниям. Контрольное нейросонографическое исследование всем детям осуществлялось в скорригированном ГВ 38–40 недель, перед выпиской из стационара. У 87 (32%) недоношенных новорожденных были выявлены поражения головного мозга: 54 (62%) ребенка – из основной группы, 33 (38%) – из группы сравнения. Недоношенным детям гестационного возраста (ГВ) 28–33 недель, у которых было подозрение на ВЖК (84 пациента), было проведено развернутое исследование гемостаза и функциональной активности тромбоцитов.
Для достижения поставленной цели дети, включенные в исследование, были разделены на 2 группы: 1-я группа (основная) – 115 недоношенных детей ГВ 28–36 недель, поступивших из родильного зала в связи с тяжелыми дыхательными расстройствами в ОРИТН, у которых в первые 72 ч жизни была диагностирована пневмония; 2-я группа (сравнения) – 156 недоношенных детей аналогичного ГВ, поступивших из родильного зала в ОРИТН, у которых дыхательные расстройства были обусловлены неинфекционными причинами. Диагноз врожденной пневмонии у детей 1-й группы основывался на комбинации следующих клинико-лабораторных признаков: выраженные дыхательные расстройства и/или очаговые изменения на рентгенограмме органов грудной клетки, лейкоцитоз, нейтрофилез и тромбоцитопения по данным клинического анализа крови, повышение уровня С-реактивного белка и/или положительный результат посева крови на стерильность (Клинические рекомендации РОН [10]).
Во 2-й группе причиной дыхательных расстройств в 69% случаев явился респираторный дистресс-синдром новорожденных (РДСН), в 31% – ТТН. Для уточнения частоты поражения ЦНС в зависимости от ГВ дети были разделены на две подгруппы: недоношенные ГВ 28–33 недель и недоношенные ГВ 34–36 недель. В свою очередь, внутри подгрупп деление осуществлялось с учетом наличия или отсутствия поражения головного мозга (по данным НСГ) (рис. 1).
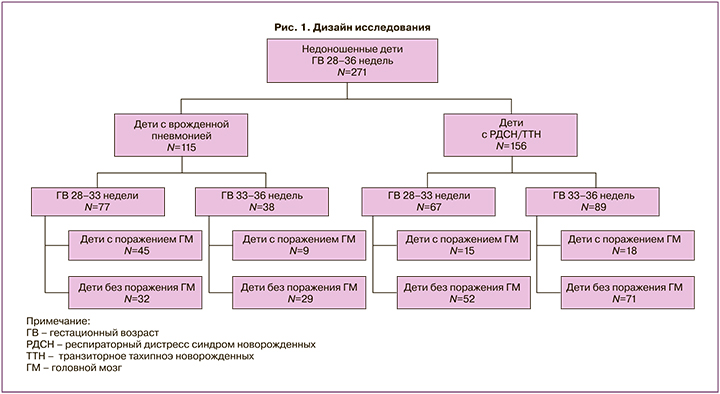
В каждой из групп проводилась сравнительная оценка акушерско-гинекологического анамнеза матерей, способов родоразрешения, гестационного возраста, оценки по Апгар на 1-й и 5-й минутах жизни, антропометрических параметров детей при рождении, клинического состояния в периоде новорожденности и результатов НСГ. Учитывая данные НСГ, все случаи ВЖК делились по тяжести на три степени, согласно классификации РАСПМ [11]. В каждой группе и подгруппах с первых дней жизни оценивались неврологический статус и результаты нейросонографического исследования в динамике, потребность детей в различных методах респираторной, вазопрессорной и кардиотонической терапии, у детей ГВ 28–33 недель дополнительно оценивались частота и характер гемостазиологических нарушений.
112 из 115 (97%) детей основной группы потребовалось проведение интенсивной респираторной терапии с первых минут жизни. После стабилизации состояния дети в транспортном кувезе были переведены из родильного зала в ОРИТН. 5 поздних недоношенных детей ГВ 35–36 недель родилось в удовлетворительном состоянии (3%) и были переведены из родильного зала в отделение новорожденных, однако в первые 48 ч жизни у них развились признаки дыхательной недостаточности, что потребовало перевода в ОРИТН и проведения интенсивной терапии. 140 из 156 (90%) недоношенных детям группы сравнения потребовалось проведение интенсивной респираторной терапии с первых минут жизни; после стабилизации состояния они были переведены из родильного зала в ОРИТН. 16 (10%) недоношенных детей ГВ 35–36 недель родились в удовлетворительном состоянии и были переведены из родильного зала в отделение новорожденных. Однако в связи с развитием дыхательных расстройств в течение первых 48 ч жизни они были переведены в ОРИТН для проведения интенсивной терапии.
В зависимости от степени выраженности дыхательных расстройств и изменений газового состава крови для лечения дыхательной недостаточности (ДН) использовались различные виды респираторной терапии: высокий поток (более 4 л/мин) воздушно-кислородной смеси, кислород через носовые канюли (так называемые высокопоточные канюли − ВПК), CPAР (Сontinuous PositiveAirwayPressure – создание постоянного положительного давления в дыхательных путях на фоне самостоятельного дыхания – СДППД), неинвазивная (через носовые канюли) искусственная вентиляция легких методом Biphasic, традиционная (через эндотрахеальную трубку) искусственная вентиляция легких (ИВЛ), высокочастотная осцилляторная вентиляция легких (ВЧОВЛ). Как правило, при легкой степени ДН использовались ВПК (у детей ГВ 34–36 недель) или CPAP (у детей ГВ 28–33 недель), при среднетяжелой ДН – неинвазивная искусственная вентиляция легких методом Biphasic, при тяжелой ДН – различные режимы традиционной ИВЛ, при крайней тяжести ДН – ВЧОВЛ. При неэффективности лечения ДН с помощью ВПК и CPAP осуществлялся перевод детей на лечение методом Biphasic, при неэффективности Biphasic − перевод на традиционную ИВЛ. При неэффективности традиционной ИВЛ использовался метод ВЧОВЛ.
У 43,2% на фоне патологического процесса в легких наблюдалось развитие острой сердечно-сосудистой недостаточности разной степени тяжести, что требовало проведения кардиотонической и вазопрессорной терапии.
Статистический анализ
Статистическая обработка данных выполнена с помощью программы SPSS v. 17.0. При нормальном распределении случайной величины для каждого количественного параметра вычислялись медиана (Ме) и квартили (Q1;Q3). Для качественных данных определялся показатель частоты (%). Перед проведением сравнительного анализа количественных данных в исследуемых группах проверяли соответствие нормальному распределению (тест Колмогорова–Смирнова, графический анализ данных). При нормальном виде распределения данных для оценки различий в группах применялись методы параметрической статистики (t-критерий Стьюдента).
При распределении признаков, отличающихся от нормального, применялись методы непараметрической статистики. Для попарного сравнения количественных данных использовался U-критерий Манна–Уитни. Для сравнения дихотомических данных и установления статистических значимых различий между ними использовали метод χ2, для вычисления которого прибегали к построению таблицы «2х2», а также точный критерий Фишера для небольших выборок. Статистически значимыми считались различия при р<0,05 (5% уровень значимости) и при р<0,01 (1% уровень значимости) при попарном сравнении.
Результаты и обсуждение
Учитывая, что тяжесть состояния недоношенных детей при рождении во многом зависит от акушерских осложнений во время беременности и родов, нами проведено сопоставление неблагоприятных пренатальных факторов, влиявших на внутриутробное состояние детей основной группы (недоношенные дети с врожденной пневмонией) и детей группы сравнения (недоношенные дети с РДСН и ТТН), в таблице 1.
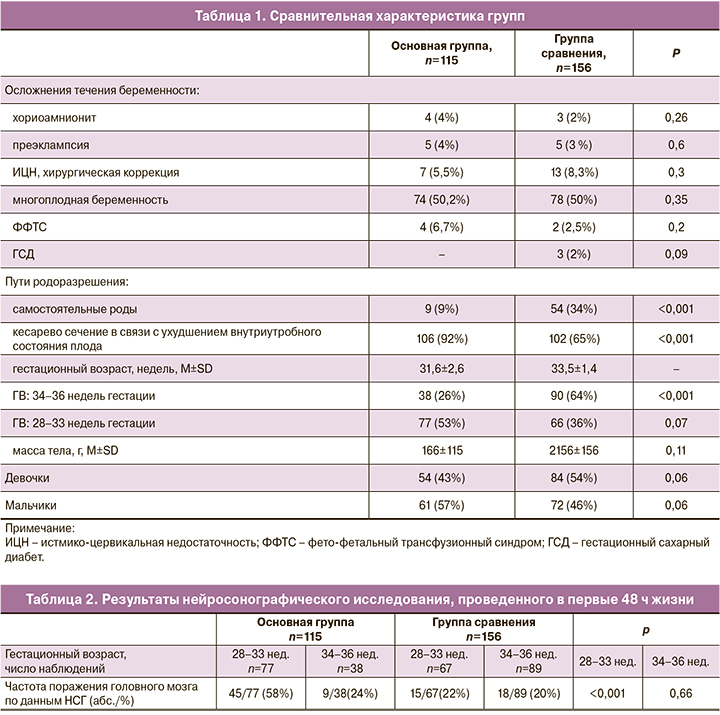
Как следует из представленных данных, по большинству факторов, осложнявших течение беременности и родов, не было выявлено статистически значимых различий. Наиболее частым осложнением у матерей во время беременности была истмико-цервикальная недостаточность, потребовавшая хирургической коррекции во время беременности (в основной группе − 5,5%, в группе сравнения − 8,3%, различия статистически незначимы). Большинство женщин родоразрешались путем операции кесарева сечения в связи с развитием дистресса плода. При этом было выявлено статистически значимое различие по частоте проведения экстренного кесарева сечения: 88% в основной группе против 62% в группе сравнения. Средние значения массы тела при рождении и процент девочек были выше в группе сравнения, однако различия оказались статистически незначимы.
Сопоставление результатов нейросонографического исследования, проведенного в первые 48 ч жизни у недоношенных детей с врожденной пневмонией (основная группа) и детей с РДСН/ТТН (группа сравнения) с учетом ГВ, представлено в таблице 2.
Следует отметить, что по данным первого нейросонографического исследования у 4 детей ГВ 28–33 недель основной группы были выявлены сочетанные нарушения структуры головного мозга (у 1 ребенка ВЖК+кровоизлияние в мозжечок, у 2 детей − ВЖК+тромбоз синусов головного мозга, у 1 – ПВЛ+паренхиматозное кровоизлияние).
Частота различных структурных нарушений ГМ, выявленных в первые 48 ч жизни, и их соотношение в основной группе и группе сравнения с учетом гестационного возраста представлены на рисунке 2.

При сопоставлении результатов НСГ основной группы с группой сравнения частота перинатальных поражений головного мозга, выявляемых у недоношенных детей ГВ 28–33 недели в первые два дня жизни, оказалась в 2,5 раза выше у детей с врожденной пневмонией, чем у детей с РДСН/ТТН (полученные различия статистически значимы, p<0,001). При этом у детей основной группы статистически значимо чаще встречались как тяжелые гипоксически-геморрагические поражения головного мозга (ВЖК II–III степени), так и тяжелые гипоксически-ишемические поражения (ПВЛ).
Важно отметить, что у большинства детей поражение головного мозга проявлялось угнетением нейрорефлекторной деятельности различной степени выраженности. У 15 детей (13%) основной группы и 6 детей (4%) группы сравнения отмечалось развитие судорожного синдрома.
Учитывая высокую частоту и особенности структурных поражений головного мозга у недоношенных детей, получавших лечение в условиях ОРИТН, с целью уточнения факторов, способствующих их развитию, все пациенты, с учетом гестационного возраста, были дополнительно разделены на две подгруппы: А − с поражением головного мозга и В − без поражения головного мозга. Частота применения различных методов респираторной терапии, использование которых отражало тяжесть ДН в разгар заболевания, у детей исследуемых подгрупп представлена в таблице 3.

Как следует из представленных данных, дети ГВ 28–33 недели в связи с более тяжелой степенью ДН статистически значимо чаще нуждались в проведении традиционной ИВЛ и ВЧОВЛ по сравнению с детьми ГВ 34–36 недель. При этом потребность в использовании этих методов респираторной терапии была статистически значимо выше у детей ГВ с врожденной пневмонией по сравнению с детьми, у которых ДН была вызвана РДСН или ТТН. Одновременно частота применения традиционной ИВЛ и ВЧОВЛ среди детей ГВ 28–33 недель с врожденной пневмонией была статистически значимо более высокой при наличии у них структурных поражений ГМ. Полученные результаты свидетельствует о том, что развитие тяжелой ДН в первые часы жизни способствует развитию тяжелых перинатальных гипоксически-ишемических и гипоксически-геморрагических поражений ЦНС у недоношенных детей.
Дополнительно было установлено, что у 72/115 (62%) детей основной группы и 45/156 (29%) детей группы сравнения отмечались признаки артериальной гипотензии, в связи с чем им проводилась вазопрессорная и/или кардиотоническая терапия. При этом острая сердечно-сосудистая недостаточность статистически значимо чаще отмечалась у детей с поражением головного мозга: в 30 (66%) и 7 (53%) случаев, в подгруппе В – в 17 (77%) и 18 (62%) случаев соответственно (статистическая значимость р<0,05).
Полученные нами данные свидетельствуют, что артериальная гипотензия и шок встречаются в два раза чаще у недоношенных детей с врожденной пневмонией по сравнению с детьми, тяжесть состояния которых обусловлена РДСН или ТТН, и согласуются с выводами других исследователей, установивших, что выраженные нарушения центральной гемодинамики являются одним из значимых патогенетических факторов развития ВЖК у недоношенных детей в раннем неонатальном периоде [5].
Согласно литературным данным [2, 4, 5], другим значимым патогенетическим механизмом развития ВЖК у детей ГВ менее 34 недель являются выраженные гемостазиологические нарушения.
Для уточнения роли нарушений системы гемостаза у детей ГВ 28–33 недели нами проанализированы результаты коагулометрических исследований у 43 пациентов в возрасте 1-х суток жизни. Проведено сравнение основных параметров гемостаза, исследованных в первые часы жизни, у 10 глубоконедоношенных детей с ВЖК, развившимися в раннем неонатальном периоде на фоне врожденной пневмонии, с аналогичными параметрами 33 глубоконедоношенных детей, у которых в раннем неонатальном периоде не было выявлено геморрагических осложнений (табл. 4).
Выявлено статистически значимое снижение концентрации фибриногена у новорожденных, течение врожденной пневмонии у которых осложнилось развитием ВЖК. Кроме того, были выявлены статистически значимые отличия показателей гемостаза, характеризующих внешний путь свертывания крови: дети с врожденной пневмонией, осложнившейся ВЖК, отличались более низким процентом протромбина по Квику, удлинением протромбинового времени и повышением международного нормализованного отношения. Активированное частичное тромбопластиновое время, отражающее состояние внутреннего пути свертывания крови, также имело тенденцию к увеличению у детей с ВЖК.
Оценка естественных антикоагулянтов – антитромбина III, протеина С – выявила их снижение у пациентов подгруппы 1А по сравнению с подгруппой 1В. При этом концентрация в плазме крови Д-димера (маркера внутрисосудистого свертывания крови) в группах не отличалась.
Несмотря на ограниченный объем выборки, полученные данные свидетельствуют о том, что ВЖК развивалось у детей с более низким коагуляционным потенциалом крови, в первую очередь обусловленным снижением белково-синтетической функции печени. Дополнительным фактором явилось снижение числа тромбоцитов периферической крови.
Заключение
Врожденная инфекция и совокупность патологических факторов, действующих в раннем неонатальном периоде, предрасполагают недоношенных детей к тяжелым перинатальным поражениям головного мозга.
При анализе постнатальных факторов выявлено, что частота перинатальных поражений головного мозга у недоношенных детей ГВ 28–33 недели оказалась в 2,5 раза выше у детей с врожденной пневмонией, чем у детей с РДСН/ТТН. При этом у детей основной группы статистически значимо чаще встречались как тяжелые гипоксически-геморрагические поражения головного мозга (ВЖК II–III степени), так и тяжелые гипоксически-ишемические поражения (ПВЛ). Также у детей с врожденной пневмонией статистически значимо чаще, чем при РДСН и ТТН, отмечалась тяжелая степень ДН, что требовало более частого проведения ВЧОВЛ и традиционной ИВЛ. Развитие тяжелой сердечно-сосудистой недостаточности у детей основной группы статистически значимо чаще (в 2 раза) отмечалось у детей с поражением головного мозга. Выявленные закономерности распространялись как на поздних недоношенных (ГВ 34–36 недель), так и глубоконедоношенных (ГВ 28–33 недель) детей.
Таким образом, полученные данные свидетельствуют о том, что высокая частота поражения головного мозга (гипоксически-геморрагического характера) у недоношенных детей с врожденной пневмонией ассоциирована с большей тяжестью ДН и сердечно-сосудистой недостаточности. Дополнительным фактором, способствующим развитию тяжелых ВЖК у глубоконедоношенных детей, является исходное снижение коагуляционного потенциала крови, вероятно, связанного с нарушением белково-синтетической функции печени у детей с врожденной пневмонией.



