Работа частично поддержана Государственным контрактом Министерства образования и науки РФ №16.522.12.2009 от 29.09.2011
Ни одна из специальностей не демонстрирует колоссальный прогресс, произошедший в медицине за последние столетия, лучше, чем акушерство [1]. Внедрение ультразвуковой и молекулярно-генетической диагностики, успехи в области микробиологии, развитие клеточных технологий дали новый вектор развития акушерству. Это позволило на высокотехнологичном уровне изучать физиологические и патофизиологические процессы, лежащие в основе течения беременности и родового акта.
Одним из важных направлений современного акушерства является изучение механизмов, инициирующих родовую деятельность [2], как при преждевременных родах, так и в доношенном сроке беременности, а также выявление причин перенашивания беременности и запоздалых родов. При этом важная роль принадлежит исследованию медиаторов межклеточного взаимодействия – цитокинов, которые формируют самостоятельную систему регуляции, существующую наряду с нервной и эндокринной и тесно взаимосвязанную с ними [3].
Неотъемлемой частью биологического действия цитокинов в маточно-плацентарном комплексе является их стимулирующее влияние на метаболизм соединительной ткани и ремоделирование экстрацеллюлярного матрикса, приводящее к созреванию шейки матки. Кроме того, ИЛ-1β и ИЛ-6 взаимодействуют с основными модуляторами сократительной функции матки, вызывая увеличение секреции окситоцина [4], повышение числа его рецепторов в миометрии, мобилизацию кальция в гладкомышечных клетках матки, что приводит к возникновению и нарастанию маточных сокращений.
Имеются данные о различиях в функционировании цитокиновой системы, обусловленных генным полиморфизмом. Было обнаружено, что определенный генотип ассоциирован с особенностями течения некоторых соматических заболеваний, а также акушерскими осложнениями – преэклампсией (гестозом) [5], синдромом задержки роста плода [6], истмико-цервикальной недостаточностью [7], а также преждевременными родами [8, 9].
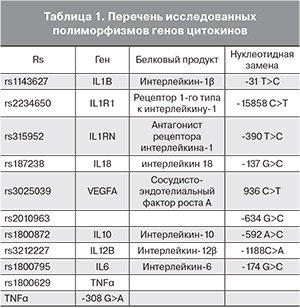
К наиболее изученным относятся полиморфизмы генов провоспалительных цитокинов и факторов роста, в частности IL6, TNF, сосудисто-эндотелиального фактора роста (VEGFA).
Замена G на C в промоторной области гена IL6 (позиция -174) сопровождается снижением продукции данного цитокина [3]. Было обнаружено, что гомозиготный аллельный вариант С/С статистически значимо реже встречается при ранних преждевременных родах [10], в то время как у женщин, гомозиготных по аллелю G, возрастает риск преждевременнымх родов.
В гене TNF замена нуклеотида G на A в позиции -308, которая локализуется в промоторной зоне гена, приводит к более высокой экспрессии данного цитокина, что сопровождается как увеличением его концентрации, так и повышенной чувствительностью к некоторым заболеваниям [3, 11], например, язвенному колиту [12], бронхиальной астме [13], а также сепсису [14]. Было обнаружено, что при наличии генотипа А/А риск развития хронического бронхита повышается в 11 раз [15].
F. Stonek и соавт. (2007) [6] изучали связь полиморфизма гена TNF и осложнений беременности (синдрома задержки развития плода, преэклампсии, антенатальной гибели плода, преждевременных родов) и сделали вывод о том, что данный полиморфизм не является генетическим маркером повышенного риска данных осложнений. В то же время в исследовании, посвященном преэклампсии, было обнаружено, что аллель А гена TNFα взаимосвязана с риском более высокого уровня среднего систолического и диастолического артериального давления и уровня протеинурии [5].
Данные литературы о взаимосвязи генотипа TNF: -308 G>А и риска преждевременных родов противоречивы.
В то же время в доступных источниках литературы мы не обнаружили исследований, посвященных взаимосвязи полиморфизмов генов цитокинов со своевременным развитием родовой деятельности и перенашиванием беременности.
Целью данного исследования стало изучение роли полиморфизма генов цитокинов в развитии своевременных родов и перенашивании беременности.
Материал и методы
А. Клиническая характеристика пациенток
 Для решения поставленных задач на базе кафедр акушерства, гинекологии, перинатологии и репродуктологии ФППОВ и акушерства, гинекологии и перинатологии лечебного факультета Первого Московского государственного медицинского университета им. И.М. Сеченова в период с 2009 по 2012 г. была обследована 181 пациентка (клинические базы: Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова и родильный дом при городской клинической больнице № 7).
Для решения поставленных задач на базе кафедр акушерства, гинекологии, перинатологии и репродуктологии ФППОВ и акушерства, гинекологии и перинатологии лечебного факультета Первого Московского государственного медицинского университета им. И.М. Сеченова в период с 2009 по 2012 г. была обследована 181 пациентка (клинические базы: Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова и родильный дом при городской клинической больнице № 7).
Критериями включения в исследование стали возраст пациенток от 18 до 45 лет, самопроизвольно наступившая, одноплодная беременность, срок гестации 37 недель и более. Критериями исключения послужили: тяжелые системные заболевания, инфекционные и аутоиммунные болезни, аномалии развития матки, пороки развития плода, преэклампсия (гестоз), суб- и декомпенсированная фетоплацентарная недостаточность.
В сроке беременности 39–40 недель женщинам был произведен забор крови из локтевой вены в объеме 3 мл. Образцы крови были помещены в пробирки с этилендиаминтетрауксусной кислотой (ЭДТА) и заморожены при температуре –70°C.
Из 181 обследованной пациентки 70 потребовалось проведение подготовки к родам и родовозбуждения, в связи с чем они были исключены из исследования. Для генотипирования были отобраны 111 пациенток, у которых родовая деятельность началась спонтанно. В зависимости от срока гестации при родоразрешении пациентки были разделены на 2 группы: со своевременными (n=87) и запоздалыми (n=24) родами. В 1-й группе роды произошли при сроке беременности от 37 до 40 недель 6 дней. У остальных пациенток – в сроке от 41 до 42 недель 4 дней. Критерием запоздалых родов послужило наличие признаков синдрома Беллентайна–Рунге у новорожденного (отсутствие сыровидной смазки, узкие швы и роднички, сухость и шелушение кожи, длинные ногти).
Б. Методы исследования
С целью выявления молекулярно-генетических предикторов перенашивания беременности нами были изучены полиморфизмы генов 9 цитокинов (табл. 1).
Выделение ДНК
Выделение ДНК проводили по методу Higuchi (R. Higuchi, H. Erlich, 1989) с некоторыми модификациями. 0,5 мл крови, взятой на ЭДТА в качестве антикоагулянта, смешивали в 1,5 мл микроцентрифужных пробирках типа Эппендорф с 0,5 мл лизирующего раствора, состоящего из 0,32 М сахарозы, 10 мМ Трис-HCl рН 7,5, 5 мМ MgCl, 1% Тритона Х-100, центрифугировали в течении 1 мин при 10 000 об/мин, супернатант удаляли, а осадки клеточных ядер два раза отмывали указанным буфером. Последующий протеолиз проводили в 50 мкл буферного раствора, содержащего 50мМ KCl, 10 мМ Трис-HCl рН 8,3, 2,5мМ MgCl, 0,45% NP40, 045% Твина 20 и 250 мкг/мл протеиназы К при 37°С в течение 20 мин. Инактивировали протеиназу К при 98°С в течение 20 мин. Полученные образцы ДНК до типирования хранили при –20°С. Концентрация ДНК, определенная на ДНК-минифлуориметре (Ноеfer, США), составляла в среднем 50–100 мкг/мл.
Генотипирование
Определение замен одиночных нуклеотидов проводили модифицированным методом «примыкающих проб» (adjacent probes, kissing probes), используя оригинальные олигонуклеотиды [16, 17].
При идентификации замен одиночных нуклеотидов вначале проводили ПЦР с праймерами, общими для обоих вариантов нуклеотидной последовательности, затем понижали температуру реакционной смеси для гибридизации полученной матрицы с олигонуклеотидными пробами. Для определения варианта последовательности использовали два типа олигонуклеотидов, гибридизующихся на матрицу рядом. Первый тип олигонуклеотидов метили флуорофором, второй – гасителем флуоресценции.
Для предотвращения неспецифического отжига праймеров и повышения чувствительности тест-систем использовали Taq-полимеразу, блокированную специфическими антителами.
В ходе генотипирования использовали один общий олигонуклеотид с гасителем флуоресценции и два сиквенс-специфичных олигонуклеотида, несущих различные флуорофоры. Олигонуклеотидные пробы, соответствующие тому или иному варианту последовательности, метили различными флуорофорами, что позволило определять оба варианта в одной пробирке. После поведения ПЦР и гибридизации измеряли уровень флуоресценции в ходе температурной денатурации дуплексов олигонуклеотидов и полученных матриц в режиме реального времени. Определение генотипа проводили путем анализа кривых плавления. Если анализируемый образец содержал только один вариант нуклеотидной последовательности гена, то есть был гомозиготен по данному полиморфизму, температура плавления для пробы, образующей совершенный дуплекс, была существенно выше, нежели для пробы, образующей несовершенный дуплекс. Если же анализировали гетерозиготный образец, содержащий оба варианта нуклеотидной последовательности, каждый из вариантов проб мог образовать совершенный дуплекс, поэтому температура их плавления была практически одинакова.
Полимеразную цепную реакцию и определение температуры плавления олигонуклеотидных проб проводили с помощью детектирующего амплификатора ДТ-96 (ООО «НПО ДНК-Технология», Россия).
Статистическую обработку данных проводили с помощью программ «SPSS Statistics 17.0 for Windows» и «MedCalc Statistical» с использованием точного теста Фишера, а для оценки силы связи применяли показатель отношения шансов (odds ratio, OR), приводимый с 95% доверительным интервалом.
Результаты исследования
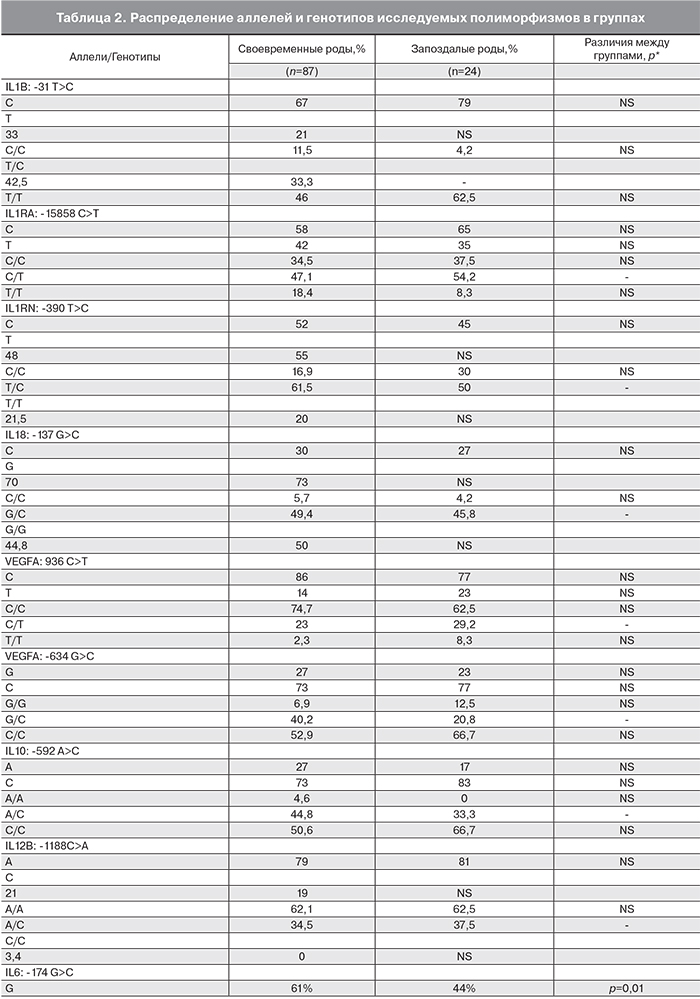
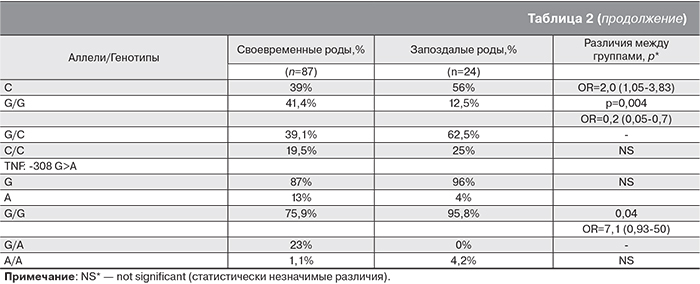
Распределение аллелей и генотипов исследованных полиморфизмов представлено в табл. 2. На основании анализа полученных данных не было обнаружено статистически значимой ассоциации со сроком родов следующих генных полиморфизмов: ИЛ-12β в локусе -1188 (C A), ИЛ-10 в области -592 А C и в двух позициях гена СЭФР-А (936 C>T и -634 G>C).
В то же время у пациенток со своевременными родами генотипическая частота встречаемости аллеля С полиморфизма IL6: -174 G>C составила 39%, тогда как у женщин с запоздалым развитием родовой деятельности – 56% (p=0,01).
При изучении ассоциации между различными генотипами полиморфизма гена IL6 и временем развития родовой деятельности было обнаружено, что генотип G/G у пациенток со своевременными родами встречался в 41,4% наблюдений, с запоздалыми – лишь в 12,5% (р=0,004), тогда как аллель С присутствовал в генотипе у 58,6 и 87,5% женщин соответственно (рис. 1, см. на вклейке). Проведенный анализ показал, что согласно аутосомно-доминантной модели, перенашивание беременности ассоциировано с данным полиморфным аллелем (OR=4,9 (1,4-17,4), р=0,004). Перенашивание беременности встречалось почти в 5 раз чаще у женщин – носительниц аллеля С (генотипы G/C и С/С) по сравнению с генотипом G/G.
При изучении полиморфизма гена TNFα: -308 G>A было обнаружено, что генотипическая частота встречаемости точечной замены в промоторе гена в позиции -308 составила 13% у женщин, родивших своевременно, и 4% у пациенток с запоздалыми родами, однако данные различия не достигали уровня статистической значимости (р=0,077) ввиду низкой частоты аллеля А.
Детальный анализ распределения генотипов по данному полиморфизму у обследуемых женщин выявил, что среди пациенток, перенашивавших беременность, чаще встречались гомозиготные по аллелю G (р=0,04) (рис. 2, см. на вклейке).
Учитывая выявленную ассоциацию полиморфизмов генов IL6 и TNF с перенашиванием беременности, мы провели изучение сочетанного влияния этих маркеров на время развития родовой деятельности. Было обнаружено, что сочетание аллеля IL6: -174C и генотипа TNF: -308G/G встречалось у 67,3% женщин со своевременными и у 83,3% с запоздалыми родами (OR=7,4 (2,3-23,6) р=0,0007). Статистически значимых различий в частоте встречаемости других сочетаний генотипов по данным полиморфным локусам выявлено не было.
Обсуждение
Роды представляют собой физиологический процесс, являющийся кульминацией беременности. Каскад изменений, происходящих в маточно-плацентарном комплексе при доношенной беременности, обеспечивает своевременное начало и физиологическое протекание родов. Изменение гормонального профиля, синтеза простагландинов, а также функционирования системы цитокинов могут приводить к нарушению процесса созревания шейки матки, развития координированных маточных сокращений и перенашиванию беременности.
Наличие в генах цитокинов специфических однонуклеотидных замен обусловливает индивидуальные колебания уровня их синтеза и секреции, что может отражаться на изменении функционирования цитокинового каскада на местном и системном уровне.
Данные литературы о взаимосвязи генов цитокинов и перенашивания беременности отсутствуют. Однако особого внимания заслуживает тот факт, что наличие запоздалых родов в анамнезе, рассматриваемое как фактор риска перенашивания при последующих беременностях [18, 19], может свидетельствовать о наличии генетической предрасположенности.
Нами впервые было обнаружено, что полиморфизм генов провоспалительных цитокинов – интерлейкина-6 и фактора некроза опухоли-α связан со временем развития родовой деятельности.
Проведенный нами анализ показал, что наличие в генотипе низкопродуктивного аллеля IL6: -174C сопровождается двукратным повышением частоты перенашивания беременности (р=0,01). Имеются данные о том, что уровень транскрипции гена IL6 и, как следствие, базальный уровень соответствующего цитокина в кровотоке, возрастает в ряду генотипов С/С→G/C→G/G [20]. Вероятно, низкий базальный уровень данного цитокина, связанный с генотипом C/C, недостаточен для инициации родового процесса. Аналогичные данные получены H.N. Simhan и соавт. (2003) [10], показавшими взаимосвязь между носительством аллеля G и повышенным риском развития преждевременных родов, в то же время гомозиготный вариант С/С статистически значимо реже встречался при преждевременных родах, происходящих до 34 недель гестации. На основании полученных данных можно сделать вывод о том, что для запоздалых и преждевременных родов характерны общие механизмы индукции родовой деятельности и, как следствие, противоположные ассоциации с генотипами IL6: -174G>C, вызывающие в случае генотипа С/С склонность к перенашиванию, а при генотипе G/G – повышение риска преждевременных родов. Учитывая широкое распространение в популяции обоих аллелей гена IL6, целесообразным представляется внедрение в практику генотипирования пациенток с высоким риском перенашивания беременности или преждевременных родов для оценки генетической предрасположенности к сроку начала родовой деятельности.
Рядом авторов была оценена роль полиморфизмов гена TNFα в развитии преждевременных родов, но мнения исследователей во многом противоречивы. В большинстве работ есть указания на наличие взаимосвязи между носительством аллеля А и более высоким риском развития преждевременных родов. G. Pu и W.Y. Zeng (2007) [21] продемонстрировали, что у женщин с генотипом G/A и A/A риск преждевременного развития родовой деятельности был в 2,9 раза выше. Те же авторы в 2009 г. обнаружили, что при генотипе А/А у пациенток с преждевременными родами имелся статистически значимо более высокий уровень мРНК гена TNF в плаценте и уровень TNFα в плазме крови. В противоположность этому, в мета-анализе, проведенном на 1846 пациентках, не было выявлено корреляции между точечной заменой в гене TNF: -308G>A и преждевременными родами [22]. Это мнение также подтвердили M. Liang и соавт. (2010) [11]. Полученные нами данные указывают на носительство генотипа G/G полиморфизма TNF: -308 G>A как фактор риска перенашивания беременности, однако сила ассоциации была существенно меньше, чем для IL6. По-видимому, существуют дополнительные факторы, которые могут модулировать биологический эффект TNF в регуляции родовой деятельности и «размывать» влияние данного полиморфизма.
Таким образом, время начала родов в доношенном сроке беременности частично связано с генетическими факторами, среди которых функционально значимые полиморфизмы генов провоспалительных цитокинов, изменяющие активность синтеза и базальный уровень соответствующих цитокинов.
Нами продемонстрирована связь между наличием низкопродуцирующего аллеля С гена полиморфизма гена IL6: -174 G>C и генотипа G/G в позиции -308 промоторной области гена TNF и запоздалыми родами. В то же время не выявлено связи между перенашиванием беременности и полиморфизмом генов цитокинов, относящихся к системе IL1, а также генов IL12B, IL10 и VEGFА.
Полученные нами данные позволили выявить новые аспекты этиологии и патогенеза перенашивания беременности. Расширение и углубление знаний о функционировании системы цитокинов в данной группе пациенток может стать основой для выявления группы риска и разработки патогенетической терапии, направленной на профилактику перенашивания беременности и его осложнений.
Выводы
- Наличие в генотипе женщины аллеля С полиморфизма гена IL6: -174 G>C сопровождается двукратным повышением частоты запоздалых родов, тогда как гомозиготный генотип G/G типичен для пациенток со своевременным развитием родовой деятельности.
- Замена нуклеотида G на A в позиции -308 промотора гена TNF является фактором, предрасполагающим к перенашиванию беременности.
- Шансы перенашивания беременности возрастают в 7,2 раза при сочетании полиморфного аллеля: -174С гена IL6 и генотипа -308 G/G гена TNF.



