В настоящее время существует много доказательств, свидетельствующих о том, что развитие физиологической, а также осложненной беременности происходит на фоне неконтролируемого усиления свободно-радикальных реакций, получившего название «оксидативный стресс» [1–3].
Полагают, что одним из главных источников прооксидантов – свободных радикалов и активных форм кислорода (АФК) при беременности является плацента и, в частности, митохондрии, ксантиноксидаза и NADPH-оксидаза гладкомышечных и эндотелиальных клеток [4–7]. Поскольку протекание физиологической беременности неразрывно связано с развитием системного воспалительного ответа [8, 9], существенный вклад в продукцию АФК при физиологической беременности могут вносить активированные фагоциты крови. В работе C.W. Redman и соавт. [10] обнаружено повышение продукции АФК лейкоцитами периферической крови у здоровых беременных женщин в III триместре беременности по сравнению со здоровыми небеременными женщинами.
Считают, что усиление продукции АФК при физиологической беременности обеспечивает регуляцию процессов пролиферации и дифференцировки трофобласта, поддержание сосудистого тонуса, формирование механизмов антиоксидантной защиты [4]. Между тем чрезмерная продукция прооксидантов на фоне ослабления антиоксидантной системы может способствовать развитию различных осложнений беременности. Так, например, увеличение в плазме крови уровня одного из маркеров оксидативного стресса, малонового диальдегиада (МДА), обнаружено у здоровых беременных женщин во II и III триместрах гестации по сравнению со здоровыми небеременными женщинами [11]. В то же время у беременных женщин с преэклампсией повышение содержания МДА в плазме крови было достоверно выше, чем у здоровых беременных женщин [11]. У пациенток с привычным невынашиванием беременности в I триместре зарегистрировано понижение активности антиоксидантных ферментов в эритроцитах крови, уменьшение уровня восстановленного глутатиона в плазме крови и ее антиоксидантной активности, а также повышение содержания в ней МДА по сравнению со здоровыми беременными женщинами [12]. Высокие по сравнению с физиологической гестацией уровни МДА обнаружены в плазме крови беременных женщин (I–II триместр) с угрозой прерывания беременности, а также различной экстрагенитальной патологией [1]. Авторы этих исследований указывают на важную роль оксидативного стресса в развитии соответствующей патологии беременности. Однако механизмы возникновения оксидативного стресса, особенно на ранних сроках физиологической беременности и беременности, осложненной урогенитальной инфекцией (УГИ), остаются все еще мало изученными.
Целью настоящей работы было исследование показателей оксидативного стресса у женщин на ранних сроках физиологической беременности, а также беременности, осложненной УГИ, которая является одной из наиболее частых причин нарушения репродуктивного здоровья женщин.
Материал и методы исследования
В данное исследование включено 90 женщин в возрасте 20–45 лет (средний возраст 30,4±6,5 года), проходивших обследование на клинических базах кафедры акушерства и гинекологии лечебного факультета ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (зав. кафедрой – д.м.н., профессор Ю.Э. Доброхотова).
Все женщины были распределены на 3 группы: 1-я группа – здоровые небеременные женщины (n=30); 2-я группа – здоровые беременные женщины (n=30); 3-я группа – беременные женщины с УГИ (n=30). Все беременные женщины находились в первом триместре гестации (8–10-я неделя). Возрастная характеристика обследованных групп и критерии исключения из групп представлены в табл. 1.

Обследование проводилось с помощью общеклинических, бактериологических, иммунологических методов. Инфекции, передающиеся половым путем, выявлялись методом полимеразной цепной реакции (ПЦР).
В 3-й группе беременных женщин с УГИ контрольная ПЦР показала наличие инфекций, передающихся половым путем. В структуре возбудителей УГИ у пациенток этой группы с наибольшей частотой выявлялась Ureaplasma urealyticum – 73,3%. Примерно с одинаковой частотой встречались Herpes simplex virus II и цитомегаловирус – 56,7 и 53,3% соответственно (табл. 2).
Забор крови осуществляли путем венопункции утром, натощак. Плазму крови отделяли от форменных элементов с помощью центрифугирования в течение 20 мин при 1500 g. В качестве антикоагулянта применяли гепарин (20—25 Ед/мл крови). Плазму крови хранили в замороженном состоянии при -30°С не более недели.
Определение функциональной активности фагоцитов цельной крови проводили с помощью метода люминол-зависимой хемилюминесценции (ЛХЛ) [13] на хемилюминометре Lum-5773 (ООО «ДиСофт», Москва). Для этого в течение 5 мин измеряли уровень спонтанного свечения. Затем в реакционную среду общим объемом 1 мл, содержащую 10 мкл крови, 100 мкМ люминола в растворе Кребса–Рингера (рН 7,4), добавляли соответствующий стимулирующий агент — зимозан (500 мкг/мл) или опсонизированный зимозан (500 мкг/мл). Функциональную активность фагоцитов цельной крови рассчитывали как разность между максимальной интенсивностью индуцированного и спонтанного свечения. Поскольку содержание фагоцитов в крови женщин может различаться, интенсивность ЛХЛ нормировали на количество этих клеток в исследуемом объеме крови, которое получали как общее количество лейкоцитов крови минус количество лимфоцитов [13]. Нормированная таким образом ЛХЛ фагоцитов крови – это интенсивность их свечения в расчете на одну клетку.
Содержание в плазме крови одного из продуктов пероксидного окисления липидов, МДА, определяли спектрофотометрическим методом по тесту с тиобарбитуровой кислотой [14].
Антиоксидантную активность плазмы крови (АОА) оценивали с помощью хемилюминесцентного метода [15], основанного на ингибировании антиоксидантами окисления люминола, индуцированного с помощью 2,2’-азобис (2-амидинопропан) дигидрохлорида, и представляли в виде концентрации стандартного антиоксиданта, в качестве которого использовали тролокс – водорастворимый структурный аналог витамина Е.
Индекс оксидативного стресса рассчитывали из отношения содержания МДА в плазме крови обследуемых женщин к величине ее АОА. Полученное значение отношения МДА/АОА умножали на 100.
Результаты исследования обработаны статистически и представлены как среднее арифметическое для анализируемой выборки ± стандартная ошибка средней (M±m). Оценку достоверности различий между выборками проводили с помощью t-критерия Стьюдента. Для установления линейной взаимосвязи между исследуемыми параметрами вычисляли коэффициент корреляции Пирсона.
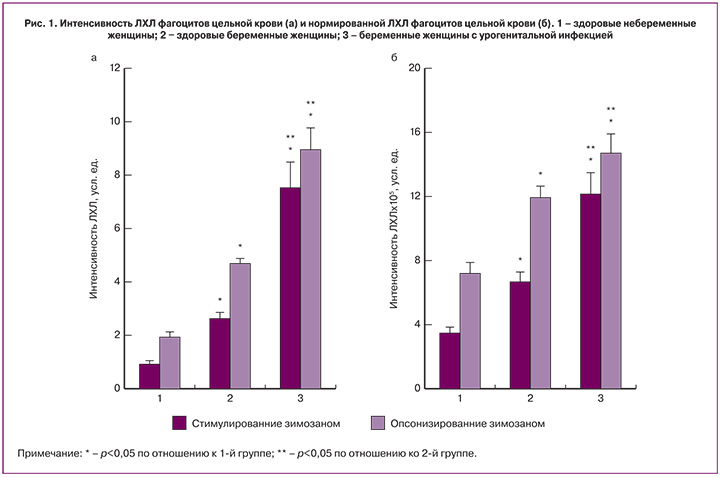
Результаты исследования и обсуждение
Способность фагоцитов периферической крови продуцировать АФК или их функциональную активность в настоящем исследовании оценивали с помощью регистрации ЛХЛ, стимулированной зимозаном или опсонизированным зимозаном. Известно, что зимозан является лигандом TLR-2, который относится к Toll-подобным рецепторам (Toll-like receptors) – распознающим рецепторам врожденного иммунитета [16–18]. Что касается опсонизированного зимозана, то фагоциты, например нейтрофилы, взаимодействуют с ним посредством Fc-рецепторов к иммуноглобулинам, опсонизирующих частицы зимозана [19]. Таким образом, регистрируемая ЛХЛ фагоцитов крови будет зависеть от экспрессии указанных рецепторов на цитоплазматической мембране клеток, а также функционирования соответствующих сигнальных путей, приводящих к активации этих клеток и последующей продукции различных АФК.
Обнаружено, что у беременных женщин 2-й и 3-й групп интенсивность ЛХЛ цельной крови была выше, чем у женщин 1-й группы (рис. 1а). Так, при стимуляции зимозаном средние значения этого показателя во 2-й и 3-й группах увеличивались соответственно в 2,8 и 8 раз, а при стимуляции опсонизированным зимозаном – в 2,4 и 4,6 раза по сравнению с 1-й группой (p<0,05). При сравнении интенсивности ЛХЛ цельной крови женщин 2-й и 3-й групп также были обнаружены достоверные различия. В частности, при стимуляции фагоцитов цельной крови пациенток 3-й группы зимозаном интенсивность регистрируемого свечения превышала интенсивность свечения цельной крови женщин 2-й группы в 2,9 раза (p<0,05), а при стимуляции опсонизированным зимозаном — в 1,9 раза (p<0,05).
Наблюдаемые изменения интенсивности ЛХЛ цельной крови у женщин 2-й и 3-й групп по сравнению с 1-й группой могут быть обусловлены как свойствами самих фагоцитирующих клеток, так и большим количеством их в крови. Чтобы исключить последнее, нами было выполнено сравнение интенсивностей ЛХЛ, нормированной на содержание фагоцитов в исследуемом объеме крови. Однако и в этом случае различия между интенсивностью нормированной ЛХЛ цельной крови у женщин указанных групп оставались достоверными (рис. 1б). Важно отметить, что при стимуляции зимозаном или опсонизированным зимозаном интенсивность нормированной ЛХЛ фагоцитов цельной крови пациенток 3-й группы была соответственно в 3,5 и 2 раза выше, чем у женщин 1-й группы (p<0,05) и в 1,8 и 1,2 раза выше, чем у женщин 2-й группы (p<0,05).

Полученные результаты показывают, что уже в первом триместре физиологической беременности наблюдается достоверное повышение функциональной активности фагоцитов крови. Наличие УГИ у беременных женщин сопровождается еще большим повышением АФК-продуцирующей способности фагоцитов. Обращает на себя внимание тот факт, что интенсивность нормированной ЛХЛ фагоцитов цельной крови, стимулированной зимозаном, у женщин 3-й группы по сравнению с женщинами 1-й и 2-й групп увеличивалась более значительно, чем при стимуляции опсонизированным зимозаном. Это свидетельствует о том, что существенный вклад в продукцию АФК фагоцитами крови в первом триместре беременности, осложненной УГИ, может вносить активация TLR-зависимых сигнальных путей. В результате активации этих сигнальных путей фагоциты крови, например нейтрофилы, продуцируют не только АФК, но также различные биологически активные вещества и, в частности цитокины – медиаторы, участвующие в регуляции экспрессии генов, роста и дифференцировки клеток, адгезии, апоптоза, воспалительного ответа и др. [16–18, 20].
Для оценки уровня оксидативного стресса у женщин обследованных групп определяли содержание МДА в плазме крови, а также ее АОА (рис. 2). Обнаружено, что содержание МДА в плазме крови у женщин 2-й и 3-й групп было соответственно в 1,3 и 1,5 раза выше по сравнению с его содержанием у женщин 1-й группы (p<0,05). Что касается АОА плазмы крови, то она была соответственно в 1,4 и 1,5 раза ниже (p<0,05). Повышение содержания МДА в плазме крови женщин 2-й и 3-й групп свидетельствует об активации в их организме процесса свободно-радикального перекисного окисления липидов, тогда как уменьшение АОА плазмы крови — о снижении уровня его антиоксидантной защиты.
На основании полученных результатов для женщин каждой группы был рассчитан индекс оксидативного стресса, который представляет собой отношение МДА/АОА. В этом отношении числитель отражает интенсивность свободно-радикальных реакций, а знаменатель характеризует состояние антиоксидантной системы. Результаты представлены в табл. 3.
Из табл. 3 видно, что индекс оксидативного стресса у здоровых беременных женщин и беременных женщин с УГИ превышает его значение у здоровых небеременных женщин соответственно в 1,8 и 2,2 раза (р<0,05). Это позволяет предположить, что у женщин 2-й и 3-й групп существует выраженный дисбаланс между продукцией прооксидантов и состоянием антиоксидантной защиты в сторону усиления продукции прооксидантов. При этом имеется тенденция в усилении свободно-радикальных реакций у женщин 3-й группы по сравнению со 2-й группой. Одними из инициаторов оксидативного стресса на ранних сроках физиологической беременности, а также беременности, осложненной УГИ, по-видимому, являются АФК, которые продуцируют активированные фагоциты крови. Нельзя исключить, что заметный вклад в общую продукцию АФК фагоцитами крови может вносить TLR-опосредованная продукция АФК. В пользу данного предположения свидетельствует тот факт, что коэффициент корреляции между нормированной ЛХЛ фагоцитов цельной крови, стимулированных зимозаном, и содержанием МДА в плазме крови у женщин 3-й группы был равен +0,71 (p<0,05), тогда как у женщин 1-й и 2-й групп он был существенно ниже и составил соответственно +0,15 и +0,23 (p<0,05).
Заключение
Полученные результаты показывают, что в первом триместре гестации у здоровых беременных женщин наблюдается развитие оксидативного стресса. Наличие УГИ у беременных женщин способствует еще большему дисбалансу между интенсивностью свободно-радикальных реакций и активностью антиоксидантной системы.



