Сегодня преэклампсия (ПЭ) и ее осложнения по-прежнему занимают лидирующие позиции в структуре материнской заболеваемости и смертности [1]. По данным ВОЗ, ПЭ осложняет 8–10% всех беременностей и занимает 2–3-е место в структуре материнской смертности. Вследствие ПЭ и осложнений, связанных с ней, ежегодно во всем мире погибают около 76 000 беременных и 500 000 детей [1, 2]. Тяжесть состояния женщины и неблагоприятные исходы для матери и плода в первую очередь обусловлены сопряженной с ПЭ полиорганной недостаточностью, в связи с чем данная патология, несомненно, требует мультидисциплинарного подхода.
В свою очередь, полиорганная недостаточность при ПЭ является следствием тромботической микроангиопатии (ТМА), приводящей к ишемическим (гипоксическим) повреждениям органов-мишеней.
ТМА – группа гетерогенных клинических состояний, в основе патогенеза которых лежит формирование микротромбов в артериолах и капиллярах в результате повреждения эндотелия и развития синдрома системного воспалительного ответа. Несмотря на разный генез повреждения эндотелия при различных видах ТМА, клинические проявления будут общими: тромбоцитопения, гемолиз, ишемические поражения органов, вплоть до полиорганной недостаточности [3].
Термин «HELLP-синдром» впервые был предложен L. Weinstein в 1982 г. для описания синдрома, включающего в себя Hemolysis – свободный гемолиз в сыворотке и моче, Elevated liver enzymes – повышение уровней печеночных ферментов, Low Platelets – тромбоцитопению. Кроме того, выделяют так называемую частичную, или парциальную, форму данной патологии – ELLP-синдром (при отсутствии гемолиза) [4].
Высокая частота состояния «near miss», а также летальности на фоне тяжелой ПЭ и HELLP-синдрома обусловлена поздним обращением женщины за медицинской помощью, недооценкой степени тяжести ее состояния и, как следствие, – запоздалой диагностикой нарушений функций жизненно важных органов, неполным объемом помощи [5].
Неадекватная и несвоевременная оценка степени тяжести состояния женщины связана с «молниеносным» развитием данного осложнения, схожестью внешних симптомов с другими заболеваниями (острый гастрит, острый холецистит, пищевая токсикоинфекция, острый вирусный гепатит и др.). Кроме того, атипичные формы тяжелой ПЭ характеризуются несоответствием тяжести состояния беременных основным критериям ПЭ – выраженности артериальной гипертензии и протеинурии [6].
В связи с этим необходим поиск современных высокоинформативных лабораторных тестов, являющихся прогностически значимыми в отношении вероятности развития тяжелой ПЭ и HELLP-синдрома.
Очевидно, что возможность прогнозирования развития того или иного заболевания зависит от знания его патогенеза. На сегодняшний день единого мнения относительно патогенеза развития ПЭ и HELLP-синдрома нет.
Согласно современной концепции, ключевым звеном в патогенезе ПЭ и HELLP-синдрома является поражение основного регуляторного звена – эндотелия сосудов системы микроциркуляции с последующим развитием ТМА [3, 5, 7].
Дискутабельными на сегодняшний день остаются вопросы – что является первичным повреждающим фактором эндотелия и почему манифестация и реализация ПЭ возможны исключительно после 20-й недели гестации?
Рассмотрение клинических проявлений тяжелой ПЭ и HELLP-синдрома с точки зрения имеющейся ТМА позволяет по-новому взглянуть на патогенез данных осложнений гестации. Так, появляется все больше данных о том, что патогенетические механизмы различных гетерогенных форм ТМА могут пересекаться. В частности, появляются данные о схожем механизме поражения эндотелия при HELLP-синдроме и другой форме ТМА – атипичном гемолитико-уремическом синдроме (а-ГУС) [8].
А-ГУС – хроническое системное заболевание генетической природы, в основе которого лежит неконтролируемая активация альтернативного пути комплемента вследствие генетического дефекта или аутоиммунной агрессии. В результате нарушаются механизмы защиты сосудистого эндотелия от атаки комплемента, что приводит к повреждению эндотелиальных клеток и активации тромбоцитов с последующим тромбообразованием в сосудах микроциркуляторного русла различных органов [8, 9].
Система комплемента представляет собой набор белков, более 40 разных видов, как растворенных в плазме, так и экспрессируемых на мембранах клеток организма. Среди белков системы комплемента различают так называемые белки-детекторы, распознающие патогенные клетки и частицы (С1–С9). Активация белков-детекторов приводит к запуску каскада реакций, что позволяет системе комплемента своевременно реагировать на попадание минимального количества патогенов в организм и вырабатывать большое количество фрагментов белков комплемента, лизирующих мембрану патогена. Конечным этапом взаимодействия белков системы комплемента является формирование мембраноатакующего комплекса (МАК), который повреждает клетки патогена и приводит к их лизису [10].
Кроме того, существует группа белков-регуляторов активности комплемента (regulators of complement activity – RCA), основными функциями которых являются регуляция и ингибирование активации комплемента [10].
Активация комплемента происходит различными путями, в зависимости от триггера. Выделяют классический, лектиновый и альтернативный пути активации.
В патогенезе ТМА большее значение имеет альтернативный путь активации. Если в случае аГУС заинтересованность альтернативного пути активации комплемента не вызывает сомнений, то при ПЭ и HELLP-синдроме активация системы комплемента хоть и происходит, но не является единственным патогенетическим путем развития патологического процесса. Однако включение именно данного пути существенно сближает клиническую картину аГУС и HELLP-синдрома.
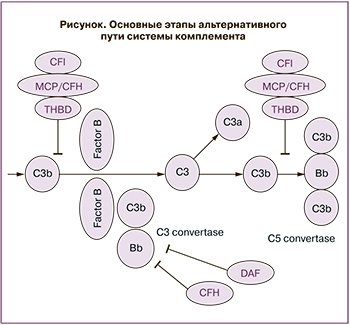 Активация альтернативного пути начинается со спонтанного гидролиза С3 (c образованием С3(H2O)), не зависящего от присутствия в организме патогенных клеток [10] (рис.).
Активация альтернативного пути начинается со спонтанного гидролиза С3 (c образованием С3(H2O)), не зависящего от присутствия в организме патогенных клеток [10] (рис.).
Далее следуют 3 основных этапа активации системы комплемента: формирование С3-конвертазы, которая расщепляет С3-компонент комплемента сыворотки; формирование С5-конвертазы, расщепляющей С5-компонент; сборка комплекса мембранной атаки (МАК или терминального комплекса комплемента-С5b-9) на поверхности чужеродной клетки и ее лизис. Встраивание МАК в мембрану клетки приводит не только к нарушению осмотического баланса и лизису клетки, но и к выходу в плазму большинства внутриклеточных молекул и белков, что ведет к гибели клетки [10, 11].
Таким образом, в альтернативном пути системы комплемента имеется положительная связь, позволяющая, при наличии небольшого количества С3(H2O), которое есть всегда, лавинообразно активировать систему комплемента. Однако, благодаря имеющимся белкам-ингибиторам системы комплемента, в организме этого не происходит. Адекватная регуляция системы комплемента необходима для нормального функционирования этой системы и организма в целом. Нарушения этой регуляции могут привести к развитию тяжелых заболеваний (в том числе а-ГУС) вследствие повышенной агрессии системы комплемента к клеткам собственного организма.
Основными регуляторными белками альтернативного пути активации комплемента являются факторы Н (CFH) и I (CFI) в плазме, а на поверхности мембран – мембранный кофакторный протеин (MCP) и тромбомодулин (THBD) (рис.).
Взаимодействие белков-детекторов и белков-регуляторов направлено, с одной стороны, на уничтожение патогенов, попавших в организм, с другой – на предотвращение повреждения собственных клеток организма. Нарушение в работе белков RCA, обусловленное генетическим полиморфизмом или поражением аутоантителами, приводит к развитию крайне тяжелых состояний, в числе которых – ТМА [11].
В современной отечественной и зарубежной литературе появляются результаты отдельных исследований, указывающие на то, что в патогенезе тяжелой ПЭ и HELLP-синдрома задействована система комплемента.
Патология системы комплемента может быть идентифицирована при помощи исследования концентрации основных маркеров активации системы комплемента в сыворотке крови, моче, плаценте, а также генетического тестирования на полиморфизм в генах, кодирующих белки системы комплемента.
Так, Arthur J. Vaught et. al. [12, 13] проводили сравнительную оценку комплемента у женщин с физиологическим течением беременности, ПЭ и HELLP-синдромом на основании модифицированного теста Хэма (отражает активацию комплемента, как долю нежизнеспособных клеток в процентах, гибель которых была комплементопосредованной), а также определения в сыворотке конечного продукта активации комплемента – МАК (C5b-9). Повышенная активация комплемента наблюдалась у женщин с HELLP-синдромом по сравнению с пациентками с физиологическим течением беременности. Кроме того, смешивание сыворотки крови пациенток с HELLP-синдромом с сывороткой, содержащей экулизумаб (препарат на основе моноклональных антител против С5-компонента системы комплемента), in vitro приводило к значительному снижению гибели клеток. Таким образом, ПЭ и HELLP-синдром, вероятно, представляют собой клинический континуум. Модифицированный тест Хэма подтвердил, что экулизумаб эффективно блокирует активацию альтернативного пути комплемента как при аГУС, так и при HELLP-синдроме.
На сегодняшний день опубликовано единичное исследование, демонстрирующее успешный опыт применения экулизумаба у беременной с HELLP-синдромом. Женщине 35 лет, течение ее беременности осложнилось развитием синдрома HELLP в 26 недель гестации, по добровольному информированному согласию проводилась комплексная консервативная терапия, включающая экулизумаб. Параллельно проводилось непрерывное наблюдение за состоянием матери и плода [14].
На фоне терапии отмечалась временная положительная динамика в виде снижения лактатдегидрогеназы, гаптоглобина, аспартатаминотрансферазы, нормализации количества тромбоцитов, артериального давления (АД). На 16-й день лечения зафиксировано нарастание степени тяжести состояния беременной, что проявлялось повышением АД до 160/100 мм рт. ст., ухудшением лабораторных показателей. В связи с чем в 29 недель гестации было произведено преждевременное родоразрешение путем операции кесарева сечения. Оценка новорожденного по шкале Апгар составила 4/8 баллов, масса – 1200 г. В течение 1-х суток после родоразрешения отмечалось восстановление спонтанного диуреза, цифр АД, клинико-лабораторных показателей. Пациентка была выписана на 4-е сутки после родов, осложнений в послеродовом периоде не наблюдалось. Таким образом, назначение экулизумаба позволило пролонгировать беременность у пациентки с развившимся HELLP-синдромом на 17 дней, что значительно улучшило перинатальный исход [14].
Исходя из опубликованных данных, необходимы дальнейшие исследования для оценки эффективности и безопасности данного препарата в лечении тяжелой ПЭ, поскольку постоянная блокировка системы комплемента экулизумабом приводит к увеличению риска менингококковых инфекций, даже при наличии вакцинации [15]. Кроме того, подобное назначение противоречит инструкции по медицинскому применению препарата.
Известно, что сосудистый эндотелиальный фактор (VEGF) защищает от аберрантной активации комплемента и ингибируется растворимой fms-подобной тирозинкиназой-1 (sFLT1) в других органах. В исследованиях Collier A.Y. et al. [16] с помощью иммунофлюоресцентного окрашивания плацент было выявлено повышенное содержание С4 и sFlt1 у женщин с ПЭ и HELLP-синдромом по сравнению с физиологическим течением беременности. Таким образом, активация комплемента была выше у пациенток с ПЭ и HELLP-синдромом. Уровни C4 сильно коррелировали с sFlt1, что предполагает ингибирование sFlt1 сосудистого фактора роста – VEGF – локально в плаценте и системно, что может быть важным для развития ПЭ. Необходимы дальнейшие исследования, выясняющие этот путь как медиатор плацентарного и системного сосудистого повреждения при ПЭ.
В 2019 г. Yonekura C. [17] предположил, что sFLT1 способствует опосредованному комплементом повреждению эндотелия плаценты. Была проведена количественная оценка активности системы комплемента и экспрессии sFLT1 у женщин с ПЭ и HELLP-синдромом. Маркеры активации комплемента – C4 и комплекс C5b-С9 (MAК), а также экспрессию в плаценте sFLT1 определяли количественно с помощью иммунофлуоресцентной микроскопии. Согласно полученным результатам, экспрессия C4, МАК в плаценте была выше у женщин с ПЭ и HELLP-синдромом по сравнению с контролем. Экспрессия плацентарного sFLT1 также была выше при ПЭ, причем C4 и MAК сильно коррелировали с уровнями sFLT1 в плаценте.
Burwick R. et al. [18, 19] исследовали маркеры нарушения регуляции системы комплемента в моче у женщин с физиологическим течением беременности, тяжелой ПЭ и хронической артериальной гипертензией. У женщин с тяжелой ПЭ наблюдалось повышение уровня C5b-9 (МАК) в моче по сравнению с женщинами с хронической артериальной гипертензией и физиологическим течением беременности. У женщин с тяжелой ПЭ также отмечены случаи значительно большей экскреции с мочой белков комплемента – C3a и C5a.
Сидорова И.С., Никитина Н.А. [20] рассматривают ПЭ как гестационный иммунокомплексный комплементопосредованный эндотелиоз, причем триггером запуска активации комплемента по аномальному пути они считают нейроспецифичные белки плода (НСБ). НСБ являются сильными иммуногенами, поскольку к ним отсутствует иммунологическая толерантность («забарьерные белки»). НСБ продуцируются у каждого плода, но в норме не проникают через гематоэнцефалический и плацентарный барьер. При попадании НСБ за пределы гематоэнцефалического барьера и далее в материнский кровоток развивается иммунная реакция с образованием антител, циркулирующих иммунных комплексов, которые запускают активацию комплемента по аномальному пути и сборку повреждающей МАК (С5b–С9).
Недавно проведенные отдельные исследования показали, что мутации в генах регуляторных белков системы комплемента могут играть решающую роль в патогенезе ПЭ и синдрома HELLP. Так, Salmon J. [21] и Батюшин М.М. [9] в результате скрининговых генетических исследований на мутации в генах, кодирующих белки системы комплемента у женщин с ТМА, наблюдали гетерозиготные мутации генов комплемента у женщин с а-ГУС и тяжелой ПЭ, причем в большинстве случаев – в генах MCP. Кроме того, наблюдались мутации в генах факторов CFI и CFH. Полученные данные можно расценивать как подтверждение генетически опосредованного нарушения активации системы комплемента у женщин с ПЭ и HELLP-синдромом.
Заключение
Таким образом, необходимо дальнейшее изучение роли комплемента в развитии ПЭ, ее течении и прогрессировании до HELLP-синдрома. Исследование роли комплементарных факторов в развитии ТМА и ее проявлений, в частности – ПЭ и HELLP-синдрома, позволит изучить отдельные звенья патогенеза вышеперечисленных заболеваний.
Следует определить диагностическую значимость комплемент-ассоциированных маркеров для прогнозирования течения ПЭ и далее разработать стратегию прогнозирования тяжелой ПЭ и HELLP-синдрома.
И наконец, третье направление изучения комплемента при ПЭ – это исследование возможности таргетной терапии тяжелой ПЭ с использованием антикомплементарных блокирующих агентов.



