Амниотическая жидкость (АЖ) – это особая среда, которая окружает плод на протяжении всего периода гестации [1, 2]. Помимо содержания питательных веществ и других факторов, необходимых для роста плода, АЖ обеспечивает механическую амортизацию и представляет собой иммунологический барьер [3], а также используется в качестве диагностического субстрата для оценки кариотипа и состояния плода [4], зрелости легочной ткани [5–8] и подтверждения/исключения внутриамниотического воспаления [9, 10].
АЖ содержит растворимые и клеточные компоненты [3, 11]. К растворимым компонентам относятся углеводы, белки, пептиды, липиды, электролиты, ферменты и др. [12]. Клеточные компоненты АЖ включают различные типы клеток, в основном слущивающийся эпителий развивающегося плода, включая кожу, дыхательную систему, мочевыводящие пути и желудочно-кишечный тракт, а также стволовые клетки [13, 14]. Цитологические исследования АЖ показывают, что даже в отсутствие патологического процесса (как инфекционного, так и асептического) она содержит иммунные клетки: макрофаги, лейкоциты, нейтрофилы, а также другие форменные элементы [10, 15, 16], уровни которых являются важными диагностическими маркерами при определении тактики ведения осложненной беременности. Кроме того, АЖ является индикатором точности при валидации возможных неинвазивных предикторов, активный поиск которых расширяется благодаря прогрессу молекулярно-биологических исследований [8, 17]. В настоящее время в связи с актуализацией проблемы фетального программирования в плане изучения внутриутробных причин развития заболеваний во взрослом возрасте наиболее остро встают вопросы проведения профилактики респираторного дистресс-синдрома плода в спорных клинических случаях: в сроках пограничной выживаемости плода, при назначении повторных курсов кортикостероидов, поздних преждевременных родах (ПР) [18–21] и т.д. В этих случаях уточнение степени зрелости легких плода по количеству ламеллярных телец (ЛТ) в околоплодных водах позволяет объективизировать показания к профилактике респираторного дистресс-синдрома плода. Как известно, ЛТ являются депо сурфактанта и по своему размеру равны тромбоцитам периферической крови, что позволяет их детектировать с помощью гематологического анализатора [22]. Кроме того, отсутствие маркеров воспаления в АЖ позволяет избежать нерационального применения антибактериальной терапии. Таким образом, клиническая целесообразность оценки состава АЖ для оптимизации акушерского менеджмента у беременных высокого риска развития ПР является обоснованной.
Цель исследования – изучение особенностей состава АЖ у беременных высокого риска ПР.
Материалы и методы
На базе 1-го акушерского отделения патологии беременности проведено проспективное исследование, в которое вошли 46 беременных высокого риска ПР. Для оценки влияния изменений различных параметров и вклада в развитие ПР пациентки были разделены на 2 группы по срокам родоразрешения: основную группу составили 12 беременных с ПР; средний срок родоразрешения составил 35,1 (1,5) недели; в контрольную группу вошли 34 соматически здоровых женщины со спонтанными своевременными родами в 38,6 (0,9) недели.
У всех обследованных детально анализировались анамнестические и клинико-лабораторные данные: соматический и акушерско-гинекологический анамнез, течение беременности, исследование периферической крови, инфекционный контроль генитального тракта, ультразвуковая фетометрия и допплерометрия. Также были проанализированы методы родоразрешения и неонатальные исходы.
Критериями включения были: одноплодная беременность, срок гестации 280–366 недель. Критериями формирования высокого риска ПР являлись анамнестические данные (спонтанные ПР в анамнезе, потери беременности во II триместре), а также клинические и эхографические признаки укорочения шейки матки. Важным условием являлось наличие добровольного информированного согласия пациентки на проведение трансабдоминального амниоцентеза с целью забора АЖ и участие в данном исследовании. Критериями невключения пациентов были: многоплодная беременность, предлежание плаценты, тяжелая экстрагенитальная и акушерская патология. Из исследования были исключены пациентки с преждевременным излитием околоплодных вод, контаминацией околоплодных вод при заборе биоматериала (кровью, меконием и т.д.), а также в случае появления симптомов острых инфекционных и/или обострения хронических заболеваний и отказа от участия в исследовании. Исследование (протокол № 9 от 16.11.2017) было одобрено комиссией по этике биомедицинских исследований ФГБУ «НМИЦ АГП им. академика В.И. Кулакова» Министерства здравоохранения Российской Федерации.
Комплексное исследование АЖ проводилось с помощью гематологического XS-800i (SYSMEX, Япония) и биохимического ВА-400 (BioSystems, Испания) автоматических анализаторов. Во избежание конфаундеров для получения достоверных результатов преаналитическая пробоподготовка не проводилась, включая этап центрифугирования.
Статистический анализ
Статистический анализ полученных данных проводили с использованием методов описательной и вариационно-математической статистики программами GraphPad Prism 8.3 и IBM SPSS Statistics 22 с соблюдением общих рекомендаций для медицинских и биологических исследований. Описание количественных данных, имеющих нормальное распределение, представлено как среднее арифметическое и стандартное отклонение, при распределении отличающееся от нормального, данные представлены в виде медианы и квартилей. Для определения нормальности распределения использовали обобщенный тест Д'Агостино–Пирсона. В работе были применены следующие методы обработки данных: тест χ2 с расчетом поправки на непрерывность для таблиц сопряженности 2×2 и критерий Фишера, сравнительный анализ переменных с помощью параметрического t-критерия Стьюдента для несвязанных совокупностей, при отсутствии нормального распределения данных применялись методы непараметрической статистики – U-критерий Манна–Уитни. Оценка диагностической значимости исследуемых показателей оценивалась по результатам ROC-анализа, данные представлены в виде площади под кривой с 95% доверительным интервалом (ДИ). Для исследования зависимостей между параметрами применяли линейный коэффициент корреляции r-Пирсона. Статистически значимыми различиями для всех видов анализа считались различия при p<0,05.
Результаты
В исследование вошли 46 беременных высокого риска ПР с интактными плодными оболочками. Согласно гестационному сроку на момент родоразрешения, пациентки были разделены на 2 группы (преждевременные и своевременные роды), сопоставимые по возрасту, сроку беременности на момент включения в исследование, массо-ростовым показателям и индексу массы тела; между указанными группами не было статистически значимых различий по перечисленным показателям. Клиническая характеристика пациенток представлена в таблице 1.

С целью оценки потенциальных предикторов ПР проведен детальный сравнительный анализ лабораторного состава АЖ с оценкой статистической значимости полученных данных. Результаты представлены в таблице 2.
Статистически значимой оказалась разница в количестве ЛТ (р=0,048), нейтрофилов (р=0,048) и общего белка (р=0,049). С целью выявления порогового значения количества нейтрофилов, при котором наименее вероятны ПР, был проведен ROC-анализ (рис. 1). Полученные данные показали, что при уровне нейтрофилов менее 64,2% с чувствительностью 91,7% и специфичностью 67,6% более вероятно своевременное наступление родов. Площадь под кривой (AUC) составила 0,69 [95% ДИ 0,53–0,86; р=0,047].

Для оценки влияния воспалительного процесса на зрелость легочной ткани плода проводился корреляционный анализ с использованием линейного коэффициента корреляции r-Пирсона между уровнем нейтрофилов и количеством ЛТ. Отмечалась положительная корреляционная зависимость (r=0,33; р=0,046), что может свидетельствовать о потенцирующем эффекте воспаления на выработку сурфактанта пневмоцитами II порядка, это согласуется с данными мировой литературы [23]. Рисунок 2 отражает зависимость между уровнем нейтрофилов и количеством ЛТ.
С целью поиска возможных неинвазивных предикторов зрелости плода нами был проведен корреляционный анализ данных количества ЛТ и результатов ультразвуковой фетометрии и допплерометрии, значимые показатели которых представлены в таблице 3.
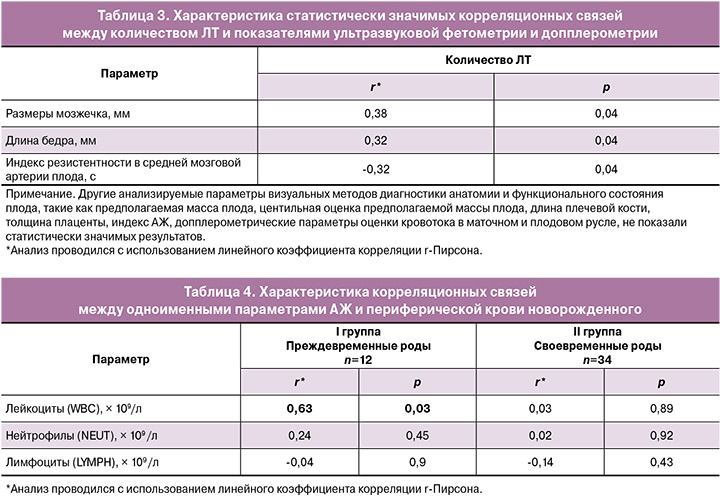
Нами также был проведен множественный анализ корреляционных связей (с использованием линейного коэффициента корреляции r-Пирсона) одноименных показателей АЖ и периферической крови матери. Анализировались количество лейкоцитов (r=0,26; p=0,09), нейтрофилов (r=-0,27; p=0,07) и уровень глюкозы (r=0,27; p=0,07), которые не выявили статистически значимых ассоциаций.
В то же время при применении одноименного статистического метода была отмечена корреляция между уровнем лейкоцитов в АЖ матери и периферической крови новорожденного в группе ПР (r=0,63; p=0,03). При анализе своевременных родов таких статистически значимых корреляций не выявлено (табл. 4).
Обсуждение
Нейтрофилы АЖ можно рассматривать в качестве предиктора ПР; их повышение свидетельствует о развитии данного осложнения (р=0,048). В качестве более слабых маркеров можно отметить уровень общего белка (р=0,049). Как известно, одним из косвенных подтверждений наличия инфекционного процесса в АЖ является низкий уровень глюкозы [9, 23], однако в нашем исследовании статистически значимой разницы не было. Данный факт, вероятнее всего, обусловлен отсутствием микробной инвазии в амниотическую полость по данным расширенного микробиологического исследования, которое проводилось параллельно с биохимическим анализом АЖ. Оценка зрелости легких плода, основанная на измерении количества ЛТ, является бюджетным и эффективным методом объективизации клинической информации. Согласно полученным результатам, наличие признаков воспалительного процесса ассоциировано с большей зрелостью легких плода (r=0,3; р=0,046). В качестве неинвазивных предикторов зрелости легких плода можно рассматривать такие ультразвуковые критерии, как размеры мозжечка (r=0,38; p=0,04), длина бедра (r=0,32; p=0,04), индекс резистентности в средней мозговой артерии плода (r=-0,32; p=0,04). Не найдено значимых ассоциаций между маркерами воспаления (лейкоциты, нейтрофилы) в АЖ и периферической крови беременных. Как указывалось выше, повышенное количество лейкоцитов в АЖ было ассоциировано с лейкоцитозом у недоношенных новорожденных (в группе ПР – r=0,63; р=0,03).
Заключение
АЖ является уникальным биоматериалом, так как отражает изменения микроокружения плода с минимальным влиянием материнских факторов. Инвазивный метод получения АЖ определяет ограничения ее исследования в научных целях. Однако отсутствие корреляций с периферической кровью матери, современные тенденции к демедикализации ведения беременных, особенно в плане антибактериальной терапии и повторных курсов антенатальной профилактики респираторного дистресс-синдрома, свидетельствуют о целесообразности разумного расширения показаний к проведению трансабдоминального амниоцентеза. Лабораторный анализ АЖ является бюджетным point-of-care методом, который целесообразно использовать в перинатальных центрах и который позволяет ответить на ряд важных вопросов: наличие/отсутствие признаков внутриамниотического воспаления, степень зрелости легких плода и определить перинатальные прогнозы с последующей коррекцией акушерского менеджмента.



