Современные акушерская наука и практика в силу ряда как субъективных, так и объективных причин переживают пандемию роста частоты абдоминальных родоразрешений. Это связано с практически полуторакратным ростом частоты кесарева сечения – с 250,7 тыс. в 2005 г. до 390,4 тыс. в 2022 г. В результате возросшей оперативной активности акушеров неминуемо последовал рост не только частоты инфекционно-воспалительных осложнений, но и ниш, истмоцеле, разрывов матки и такого грозного осложнения, как предлежание и врастание плаценты. В сегодняшних реалиях в структуре показаний для последующего абдоминального родоразрешения рубец миометрия занимает первое место. Тем не менее все большее число акушеров обращают свое внимание на возможность самопроизвольных вагинальных родов у женщин с оперированной маткой. Поэтому продолжается поиск методов, улучшающих регенерацию миометрия после предшествующего кесарева сечения. Для оптимизации репаративных процессов более 15 лет используются клеточные технологии, демонстрирующие определенный оптимизм [1–3]. В то же время до сих пор не преодолены некоторые затруднения для их более значимого использования [4–7]. Среди различных патогенетических механизмов действия клеточных продуктов обращает на себя внимание их возможность в коммуникативном участии как на протеиновом, так и генетическим уровнях за счет секреции экзосом. Эти продукты межклеточных коммуникаций оказались очень перспективными для повышения регенеративных способностей тканей, поскольку они могут работать в качестве модулятора [8–16].
Серия предыдущих клинических работ, проведенных в ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» Министерства здравоохранения Российской Федерации (директор – академик РАН Г.Т.Сухих) и в ГБУЗ НСО «Новосибирский городской клинический перинатальный центр» (главный врач – профессор И.М.Поздняков), наглядно продемонстрировала, что использование клеточных технологий, а именно введение экзосом мезенхимальных стромальных клеток (ЭМСК) улучшает течение послеродового периода и дает надежду на снижение частоты абдоминального родоразрешения за счет самопроизвольных вагинальных родов у женщин с рубцом на матке после кесарева сечения [3, 14–21]. Выдвинутое утверждение базируется на проведенных экспериментальных исследованиях, в ходе которых была создана модель кесарева сечения у лабораторных крыс. Уже 4 года назад была убедительно продемонстрирована способность экзосом находиться в миометрии не менее 8 суток [17–21].
Цель исследования: определить вероятность успешных самопроизвольных родов у женщин с рубцом миометрия, которым в ходе предшествующего кесарева сечения применялись клеточные технологии, а именно вводились ЭМСК.
Материалы и методы
Обследованы и родоразрешены 160 пациенток. В зависимости от ведения послеоперационного периода все они были разделены на 2 группы:
1-я группа (основная) – 60 беременных и рожениц, которым в ходе кесарева сечения после ушивания матки однорядным непрерывным викриловым швом в область разреза вводилось 500 мкл ЭМСК, полученных в лаборатории клеточных технологий ФГБУ «НМИЦ АГП им. В.И.Кулакова» [15–20, 22]. Разрешение на использование клеточных технологий было получено на основании решения локального этического комитета;
2-я группа (сравнения) –100 беременных и рожениц, которым в ходе кесарева сечения проводилось традиционное ушивание нижнего сегмента матки однорядным непрерывным викриловым швом.
Кроме того, проведена интранатальная оценка состояния рубца у 71 пациентки, в том числе у 19 из основной группы, 22 – из группы сравнения, и состояния нижнего сегмента у 30 рожениц (контрольная группа) без рубца на матке после кесарева сечения, которым проводилось ультразвуковое исследование (УЗИ) [23]. Использовали надлонное расположение объемного конвексного датчика RAB6-D частотой 2–8 МГц и внутриполостной датчик IC5-9-D частотой 4–9 МГц аппарата GE Voluson E8 (США).
В качестве первичных изучаемых исходов оценивались результаты течения беременности и родов у пациенток основной группы и группы сравнения. В качестве вторичных изучаемых исходов анализировались результаты повторного родоразрешения пациенток с рубцом на матке в условиях использования клеточных технологий и без экзосомной поддержки.
Все пациенты подписали информированное согласие на введение экзосом.
Получение культуры МСК
Материал получен после родов здоровых женщин 25–30 лет, родоразрешенных путем кесарева сечения в ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» Министерства здравоохранения Российской Федерации.
Образцы пуповин, полученных после рождения, промывали в фосфатно-солевом буферном физиологическом растворе (Paneco, Москва, Россия) несколько раз. После удаления кровеносных сосудов ткань пуповины измельчали на фрагменты размером 1–2 мм3. Клетки выращивали в полной питательной среде (ППС), состоящей из культуральной среды DMEM/F12 («БИОЛОТ», Москва, Россия) (1:1), 7% фетальной бычьей сыворотки (HyClone, Cytiva, Австрия) с добавлением пенициллина (100 ЕД/мл), стрептомицина (100 мкг/мл) (Gibco, Нью-Йорк, США) и 2 мм L-глутамина («Панэко», Москва, Россия), и инкубировали во влажной атмосфере с 5% СО2 при 37°С. Питательную среду заменяли раз в 3–4 дня. Эту же среду использовали для получения экстрацеллюлярных микровезикул (ЭМВ), продуцируемых МСК.
Для этого ее предварительно центрифугировали (108 000×g в течение 1,5 ч при 4°C) с целью очищения от ЭМВ, содержащихся в фетальной бычьей сыворотке. Центрифугированную среду добавляли к МСК на 3-м пассаже, достигшем конфлюэнтности 80–90%, и отбирали через 24 ч. Рост и морфологию клеток контролировали ежедневно под инвертированным световым микроскопом. По достижении 80% конфлюэнтности клетки трипсинизировали, центрифугировали (1600×g в течение 3 мин), ресуспендировали в ППС и пересаживали на новые культуральные флаконы. МСК, использованные в работе, были положительными для маркеров МСК (CD73 – 98%, CD90 – 100%, CD105 –100%) и содержали небольшую примесь гемопоэтических клеток (около 4,6% CD14, CD20, CD45, CD34).
Статистический анализ
Для статистической обработки данных использовали электронные таблицы Microsoft Excel и пакет программ GraphPad Prism 6 (GraphPad Software, USA). При описании количественных данных, имеющих нормальное распределение, использовали среднее арифметическое (M) и стандартное отклонение (SD). При анализе параметрических данных рассчитывали среднее значение и среднеквадратичное отклонение. Различия считали значимыми при p<0,05.
Результаты
Проведенный клинико-демографический анализ беременных и рожениц не выявил значимых различий в группах сравнения ни по возрасту, ни по частоте экстрагенитальной и генитальной патологии, ни по репродуктивному анамнезу [16].
В группе пациенток с применением клеточных технологий предыдущее плановое кесарево сечение было произведено 26/60 (43,3%) беременным. В структуре плановых кесаревых сечений преобладали пациентки с полным (смешанным) ягодичным предлежанием – 21/26 (80,8%). Также первое плановое кесарево сечение с экзосомной поддержкой было произведено 5/26 (19,2%) беременным с краевым предлежанием плаценты, которые в анамнезе имели 2 артифициальных аборта [16]. У всех беременных и рожениц абдоминальное родоразрешение было проведено под эпидуральной анестезией и в условиях интраоперационной антибактериальной профилактики, согласно клиническим рекомендациям [24]. Среди пациенток из группы сравнения, которым интраоперационно не вводились ЭМСК, не было достоверных отличий как по продолжительности операции, так и общей кровопотере. Также группы сравнения не различались по такому показателю, как продолжительность I периода родов. В то же время обращало на себя внимание достоверное отличие во времени послеоперационного койко-дня у родильниц с клеточными технологиями, который был значительно меньше, чем у женщин без предшествующего использования экзосом, р=0,03. Также у пациенток без экзосомной поддержки было более значимое расширение полости матки, p=0,006. Аналогичная ситуация выявлена и в ходе анализа лейкоцитарной формулы крови, р=0,03. При этом у пациенток основной группы, несмотря на достоверно больший безводный промежуток, не было послеродовых инфекционно-воспалительных осложнений, тогда как у у 8/100 (8%)родильниц без введения экзосом было зафиксировано осложнение течения послеродового периода [16].
С 2019 г. у 22/60 (36,7%) женщин, которым в ходе первого кесарева сечения вводились ЭМСК, и у 29/100 (29%) пациенток из группы сравнения возникли желанные беременности в естественном цикле, которые в обеих группах протекали без осложнений. Практически каждая вторая – 12/22 (54,5%) пациентка с рубцом на матке из основной группы поступила на роды со спонтанным развитием родовой деятельности; в группе сравнения регулярная родовая деятельность наблюдалась у 17/29 (58,6%) беременных. Остальные 22/51 (43,1%) беременные из обследованных групп были госпитализированы для подготовки к родам в плановом порядке при сроке беременности 40 недель и родоразрешены в Новосибирском городском клиническом перинатальном центре. Их возрастная характеристика и гестационный срок были сопоставимы и значимо не различались (табл. 1).
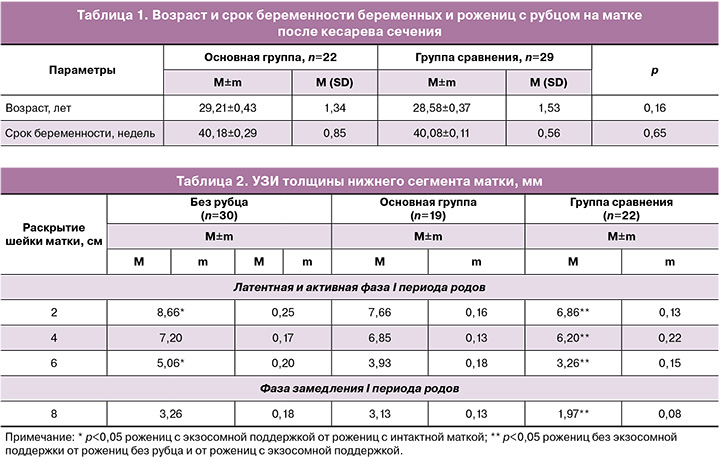
Единственным показанием к преиндукции родов была тенденция к перенашиванию беременности. Данное состояние встречалось у 11/22 (50%) беременных основной группы и у 12/29 (41,4%) пациенток из группы сравнения. Этим 23/51 (45,1%) пациенткам с рубцом на матке после кесарева сечения проводилась преиндукция при помощи баллона для ускорения созревания шейки матки, что не противоречит Клиническим рекомендациям МЗ РФ «Роды одноплодные, родоразрешение путем кесарева сечения» [24].
В I периоде пациенткам после абдоминального родоразрешения, которым в плане ведения родов было запрограммировано самопроизвольное родоразрешение для оценки состояния и полноценности рубца на матке, а также 30 роженицам с интактным миометрием проводили динамическое УЗИ как в латентной, так и в активной фазе родов (табл. 2). Анализ ультразвуковых параметров показал отсутствие значимых различий толщины нижнего сегмента между пациентками, которым применялись клеточные технологии, и роженицами с интактной маткой практически на протяжении всей активной фазы родов (4 и 8 см – 6,85±0,13 мм и 3,13±0,13 мм соответственно). При этом толщина миометрия в области нижнего сегмента у женщин с экзосомной поддержкой в латентной фазе (2 см) и в середине активной фазы (6 см) была значимо ниже по сравнению с пациентками без рубца на матке (7,66±0,16 мм и 3,93±0,18 мм соответственно), но достоверно выше, чем у пациенток без экзосомной поддержки (p<0,05). В то же время у пациенток, которым в ходе первого кесарева сечения не применялись клеточные технологии, миометрий оставался достоверно тоньше на протяжении всего I периода родов по сравнению как с пациентками основной группы, так и с женщинами с интактной маткой.
Длительность I и III периодов родов, а также продолжительность безводного промежутка как в группе с экзосомной поддержкой, так и в группе сравнения была практически одинаковой (табл. 3) и соответствовала нормативным значениям, указанным в Клинических рекомендациях РОАГ «Роды одноплодные, самопроизвольное родоразрешение в затылочном предлежании (нормальные роды)», утвержденных в 2021 г. Минздравом России [24].
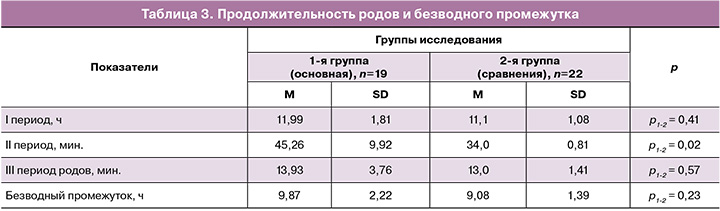
Так, продолжительность I периода находилась во временном диапазоне от 11,08±0,32 в 1-й группе до 11,99±0,41 ч в группе сравнения (р1-2=0,41). Обращало на себя внимание, что у 2/19 (10,5%), т.е. у каждой десятой пациентки с рубцом на матке после кесарева сечения, родивших в конечном счете самопроизвольно, I период родов осложнился первичной/вторичной слабостью родовой деятельности, что явилось основанием для применения окситоцина под непрерывным кардиомониторным контролем.
На сегодняшний день, согласно Клиническим рекомендациям РОАГ (2021), применение роженицам с рубцом на матке после кесарева сечения утеротонических препаратов, за исключением простагландинов Е1, не противопоказано. Всем роженицам с рубцом на матке после кесарева сечения в I периоде родов с целью купирования болезненности схваток проводилась эпидуральная аналгезия, в том числе 1/19 (5,2%) роженице для коррекции дискоординации родовой деятельности, что также не противоречит Клиническим рекомендациям (2021).
Что касается продолжительности III периода родов, то в 1-й и 2-й группах она колебалась от 13,93±0,97 до 14,71±0,92 минут (р1-2=0,57). При этом у 2/19 (10,5%) пациенток основной и 3/22 (13,6%) группы сравнения III период родов осложнился наличием частичного/полного плотного прикрепления плаценты, потребовавшего проведения ручного отделения плаценты и выделения последа. Остальным родильницам, согласно Клиническим рекомендациям РОАГ «Послеоперационный рубец на матке, требующий предоставления медицинской помощи матери во время беременности, родов и в послеродовом периоде», утвержденным Министерством здравоохранения Российской Федерации в 2021 г., не потребовалось проведения рутинного контрольного ручного обследования стенок полости матки. Этим пациенткам было проведено УЗИ матки непосредственно в родильном зале. Целостность органа подтверждена во всех случаях.
В то же время у женщин основной группы было зарегистрировано достоверно значимое увеличение II периода родов – 45,26±2,56 минут, по сравнению с группой сравнения, р1-2 =0,02. Это можно объяснить накоплением опыта и повышением акушерского терпения, при том, что у 1/19 (5,3%) роженицы основной группы и 1/22 (4,5%) пациентки из группы сравнения пришлось завершать самопроизвольные роды путем наложения вакуум-экстрактора по поводу слабости потуг при локализации головки на тазовом дне.
Заключение
Таким образом, на момент подачи статьи в редакцию журнала родоразрешена 51 беременная с рубцом на матке. У 14/22 (63,6%) пациенток, которым в ходе предшествующего абдоминального родоразрешения применялись клеточные технологии, а именно введение ЭМСК плацентарного происхождения, роды благополучно завершились через естественные родовые пути. Полученные проспективные данные родоразрешения пациенток с рубцом на матке после кесарева сечения продемонстрировали высокую эффективность интраоперационного применения клеточных технологий – введения ЭМСК по сравнению с традиционным ведением послеродового периода. На это указывают отсутствие инфекционно-воспалительных осложнений и достоверное повышение толщины рубца по данным интранатального УЗИ. Пациентки с экзосомной поддержкой в 3 раза чаще рожали самопроизвольно по сравнению с группой контроля (63,6 и 20,7% соответственно).



