Системная красная волчанка (СКВ) – мультисистемное аутоиммунное заболевание, поражающее преимущественно женщин репродуктивного возраста. Оно характеризуется гиперпродукцией аутоантител к компонентам цитоплазмы и ядра клеток и развитием иммуновоспалительного повреждения различных органов и тканей. Основой заболевания является генетически обусловленное несовершенство иммунорегуляторных процессов, потеря иммунной толерантности к собственным антигенам и персистентная продукция патогенных аутоантител [1–3]. Течение СКВ представляет собой многоступенчатый процесс, включающий индукцию, поддержание и прогрессирование заболевания, который продолжается длительное время и в конечном итоге приводит к повреждению тканей [4].
Иммунорегуляторный дисбаланс и гиперпродукция аутоантител различной специфичности, возникающая вследствие гиперактивности поликлональных B-клеток, считаются основой аутоиммунного процесса. Аномалии дифференцировки B-клеток могут приводить к аутоиммунному заболеванию или являться вторичными по отношению к воспалительному процессу, характерному для больных с СКВ [5]. Известно, что у больных с СКВ наблюдаются множественные B-клеточные патологии и продукция аутоантител, направленных против ядерных и цитоплазматических аутоантигенов, а также аутоантигенов клеточной поверхности [6, 7]. B-клеточные аномалии проявляются увеличением количества циркулирующих плазматических клеток, нарушением иммунологической памяти, изменением субпопуляций наивных клеток, активированным фенотипом В-клеток и снижением их ответа на стимуляцию in vitro [8].
Среди аутоантител, образующихся при СКВ к множеству аутоантигенов, доминируют аутоантитела к двухспиральной ДНК (обнаруживаются у 95% больных), особенно классов IgG1 и IgG3, обладающих высоким патогенным потенциалом. Их образование способствует реализации эффекторных механизмов иммунитета при взаимодействии с компонентами комплемента, фагоцитами и естественными цитотоксическими клетками (NK-клетками). Главными механизмами действия аутоантител являются цитотоксичность, избыточное формирование свободных иммунных комплексов, которые связываются с Fc-рецепторами и откладываются в тканях, привлекая и активируя макрофаги, что способствует развитию локального воспаления. Взаимодействие иммунных комплексов с Fc-рецепторами типа FcγRIIA (CD32) на поверхности В-клеток представляет собой один из механизмов поликлональной активации В-лимфоцитов, сопутствующих обострению СКВ.
Важную роль в поддержании иммунной толерантности к собственным антигенам играют регуляторные Т-клетки. Одной из наиболее изученных популяций являются так называемые естественные регуляторные Т-клетки тимусного происхождения, с поверхностным фенотипом CD4+CD25+ и конститутивной экспрессией транскрипционного фактора Foxp3 (forkhead box р3), ответственного за их регуляторную активность. Регуляторные CD4+CD25+Foxp3+-T-клетки (Treg) подавляют пролиферацию и эффекторные функции T-хелперов первого типа (Th1), продуцирующих провоспалительные цитокины интерферон (IFN)-γ, интерлейкин (IL)-2 и фактор некроза опухоли (TNF)-β, поддерживая иммунную толерантность в периферических тканях. Показано, что Treg-клетки могут непосредственно подавлять функции B-клеток, продуцирующих аутоантитела, в том числе те, которые относятся к патогенным подтипам, образуемым при активной СКВ [9]. Таким образом, патогенез аутоиммунных заболеваний может быть связан с нарушениями регуляторного клеточного звена иммунитета.
Механизмом подавления функций B-клеток при СКВ считается высвобождение цитотоксических продуктов (перфорина и гранзима) активированными Treg-клетками и индукция апоптоза [9]. При изучении Treg-клеток у больных с СКВ получены неоднозначные данные, свидетельствующие как о снижении [10–12], так и об увеличении их количества [13].
Поскольку СКВ в подавляющем большинстве случаев развивается у женщин репродуктивного возраста, предположено, что половые стероиды являются важными модуляторами генетического риска аутоиммунных заболеваний, что было подтверждено эпидемиологическими наблюдениями и экспериментальными данными [14, 15]. Изменение иммунных реакций важно для выживания плода, вероятность которого выше в случае подавления иммунного ответа, опосредованного Th1-цитокинами [16]. Во время беременности у здоровой женщины возрастает число регуляторных Т-клеток, проявляющих иммуносупрессивное действие [17, 18]. У беременных женщин с СКВ также может происходить подавление иммунных реакций за счет физиологических процессов, свойственных беременности, благодаря чему в период гестации в ряде случаев отмечается ремиссия СКВ, а после родоразрешения обострение основного заболевания.
До настоящего времени в литературе недостаточно представлены результаты сравнительного исследования фенотипических особенностей различных субпопуляций лимфоцитов у беременных женщин с СКВ и их новорожденных детей. Остаются невыясненными вопросы, касающиеся влияния СКВ матери на становление иммунной системы у плода.
Цель настоящего исследования – определить особенности субпопуляционного состава лимфоцитов периферической крови беременных женщин с СКВ и пуповинной крови их новорожденных.
Материал и методы исследования
В проспективное исследование были включены беременные женщины с СКВ (n=34), которые находились под наблюдением в ФГБУ НЦАГиП им. академика В.И. Кулакова (в 2011–2013 гг.), в возрасте от 21 до 38 лет, родоразрешенные самопроизвольно или путем операции кесарева сечения, со сроком гестации 28 и более недель, а также их новорожденные дети (основная группа).
Критериями включения служили СКВ I–III степени активности и беременность. Сравнивали показатели женщин с СКВ и их новорожденных с показателями женщин без аутоиммунных заболеваний, с физиологическим течением беременности и родов (n=21), и их новорожденных детей (контрольная группа). Проводили общеклиническое и иммунологическое обследование, изучение анамнестических данных женщин, особенностей течения основного заболевания, особенностей течения беременности, родов, послеродового периода у женщин и раннего неонатального периода у их новорожденных. Лабораторными диагностическими критериями служили характерные для СКВ антиядерные аутоантитела (АНФ), антитела к нативной ДНК (нДНК), к экстрагируемым ядерным антигенам Sm, Ro/SS-A, La/SS-B, которые выявляли непрямым иммунофлуоресцентным методом c помощью тест-системы ImmuGlo ANA HEp-2 Cells IFA (Immco, США) и иммуноферментным методом с использованием тест-систем и автоматического иммуноферментного анализатора ALEGRIA (ORGENTEC, Германия).
Для оценки иммунного статуса исследовали периферическую кровь матери, полученную перед родами, и пуповинную кровь новорожденного. Фенотипирование лимфоцитов осуществляли методом проточной цитометрии с использованием флуоресцентно меченных моноклональных антител к CD45, CD3, CD4, CD5, CD8, CD11b, CD16, CD19, CD25, CD56, CD95, CD127, HLA-DR маркерам (Beckman Coulter, USA). Лимфоцитарный гейт, позволяющий исключить из анализа другие клетки крови, выявляли с помощью моноклональных антител к СD45, меченных перидинин-хлорофилл протеином (Per-CP) (Dako, Дания). Анализ проводили с использованием проточного цитофлуориметра FACSСalibur (Becton Dickinson, США).
Статистическую обработку данных проводили общепринятыми методами вариационной статистики с использованием пакетов статистического анализа для Microsoft Office Excel 2007 и MedCalc для Windows7. При характеристике выборок, удовлетворяющих критериям нормального распределения, использовали среднее значение и стандартное отклонение. Значимость наблюдаемых средних значений измеренных параметров оценивали с помощью t-критерия Стьюдента с различными дисперсиями для средних значений.
Результаты исследования и обсуждение
Возраст женщин с СКВ составил 29,7±3,1 года. Средняя длительность течения СКВ – 9,4±4,3 года, длительность ремиссии СКВ до наступления беременности – 2,6±2,3 года; СКВ у 29 (85,3%) пациенток – I степени, у 4 (11,8%) II степени, у 1 2,9%) – III степени активности заболевания.
В основной группе беременных наблюдалась высокая частота поражения органов: у 21 (61,8%) пациентки. Наиболее часто поражались суставы (23,5%), почки (17,6%), кожа (23,5%) и сосуды (23,5%). У 7 (20,6%) женщин основное заболевание сочеталось с антифосфолипидным синдромом.
Всем женщинам с СКВ на протяжении беременности проводили терапию основного заболевания. Причем большинство женщин – 26 (76,5%) находились на комбинированной двухкомпонентной терапии (глюкокортикостероиды + плаквенил). Глюкокортикостероиды без применения цитостатиков получали 7 (20,6%) пациенток. Обострение СКВ во время беременности отмечалось у 11 (32,4%), что потребовало увеличения дозы препарата либо проведения пульс-терапии глюкокортикостероидами.
Различные осложнения беременности имели место практически у всех беременных с СКВ. Наиболее часто встречались: угрожающий ранний выкидыш у 16 (47%), угрожающий поздний выкидыш – у 2 (5,9%), угрожающие преждевременные роды – у 3 (8,8%), активация внутрисосудистого свертывания крови – у 15 (44,1%), плацентарная недостаточность – у 2 (5,9%), анемия – у 18 (52,9%) женщин.
Беременность закончилась своевременными родами на 37–41-й неделе у 25 (73,5%) женщин с СКВ, преждевременными родами на 28–36-й неделе – у 26,5%). Роды через естественные родовые пути произошли у 14 (41,2%) женщин, путем операции кесарева сечения родоразрешены 20 (58,8%) женщин. Осложнения послеродового периода встречались у 7 (23,5%) женщин (субинволюция матки, дефект последа, лактоз). У 1 (2,9%) женщины развился послеродовой эндометрит.
Средний срок гестации на момент родоразрешения для доношенных детей составил 38,5±0,96 недели, для 9 (26,5%) недоношенных – 34,4±2,2 недели. Средняя масса тела доношенных детей составила 3223±394,09 г, недоношенных детей – 2333±329,4 г, длина тела – 50,5±1,9 см и 46,4±2,8 см соответственно. Средняя оценка состояния доношенных новорожденных по шкале Апгар на 1-й минуте составила 7,6±0,65 баллов, на 5-й – 8,1±0,6 балла, недоношенных новорожденных – на 1-й минуте – 7,2±0,8 балла, на 5-й –8,2±0,7 балла.
Осложнения раннего неонатального периода встречались у 11 (32,4%) новорожденных: тромбоцитопения – у 2 (5,9%), геморрагический синдром у 1 (2,9%), неонатальная желтуха – у 3 (8,8%), инфекционные осложнения – у 6 (17,6%), дыхательные нарушения – у 3 (8,8%), атриовентрикулярная блокада – у 1 (2,9%). В связи с осложнениями раннего неонатального периода 11 (32,4%) детей, рожденных от женщин с СКВ, переведены на второй этап выхаживания для дополнительного обследования и лечения. Выписка детей проводилась в среднем на 13,3±10,7 сутки жизни (от 4 до 60 суток).
Иммунологические и гематологические изменения у беременных с СКВ (наличие АНФ, антител к нДНК, Sm, SS-A (Ro) или SS-B (La), ревматоидного фактора, С-реактивного белка, снижение С3, С4 компонентов комплемента, анемия, тромбоцитопения, лейкопения, лимфопения) выявлены у 13 (38,2%) пациенток. Превышающие нормативные показатели уровни аутоантител к нДНК во время беременности были определены у 20 58,8%) беременных, Ro-антитела – у 14 41,2%), АНФ – у 26 (76,5%) женщин, La-антитела – у 5 14,7%) женщин, aSm – у 8 (23,5%) женщин, в большинстве случаев в различных сочетаниях. Ранее было показано, что на фоне иммуносупрессивной терапии, получаемой до и во время беременности, у женщин с СКВ в III триместре наблюдается дисрегуляция иммунной системы [19]. В настоящей работе проведен субпопуляционный анализ лимфоцитов крови данной группы женщин в динамике беременности (в I, II и III триместрах), в результате которого не выявлено статистически значимых изменений показателей в ходе гестационного процесса. Также они не найдены в послеродовой период. Однако при сравнении с группой беременных без СКВ обнаружены существенные отличия в содержании клеток разных фенотипов.
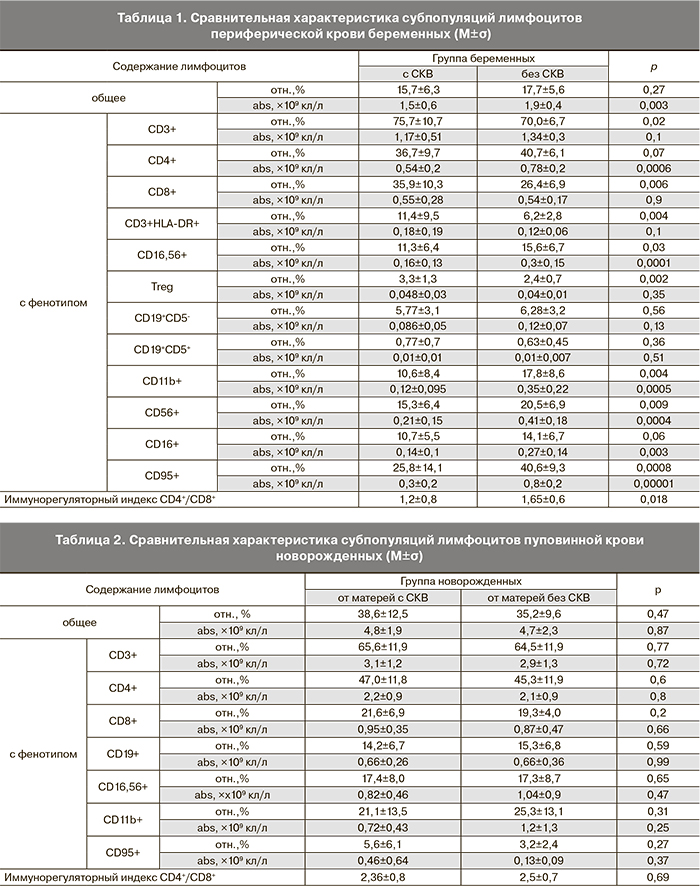
При оценке иммунного статуса нами получены результаты, свидетельствующие о значительном снижении количества лимфоцитов в периферической крови у наблюдаемых беременных с СКВ: 1,45±0,59(×109) против 1,9±0,4(×109) клеток/л (p<0,05) у беременных без аутоиммунных заболеваний. Также выявлены определенные изменения в субпопуляционном составе Т-лимфоцитов и снижение количества NK-клеток (табл. 1).

Как можно видеть, у беременных с СКВ происходит статистически значимое увеличение относительного содержания Т-лимфоцитов (CD3+) и лимфоцитов, относящихся к субпопуляции Т-цитотоксических клеток (CD8+), при снижении абсолютного количества Т-хелперных клеток (CD4+) и иммунорегуляторного индекса (CD4+/CD8+). Определяется значимое увеличение доли активированных Т-лимфоцитов (CD3+HLA-DR+) и тенденция к увеличению абсолютного количества этих клеток. Увеличена доля Т-регуляторных клеток (CD4+CD25high/CD127low/-). В последние годы все большее распространение для идентификации популяции Foxp3-позитивных T-регуляторных клеток человека приобретает использование маркера СD127 (α-цепь рецептора к интерлейкину-7), так как было установлено, что субпопуляция Т-клеток с фенотипом CD4+CD25highCD127low/- представлена Т-регуляторными клетками (CD4+CD25+Foxp3) [20]. Очевидно, что использование цельной крови, а также фенотипирование лимфоцитов с помощью поверхностных маркеров, позволяющее избежать процедуры пермеабилизации и анализировать живые клетки, является оптимальным подходом для оценки содержания Т-регуляторных клеток в периферической крови.
У женщин с СКВ, по сравнению с контролем, отмечается более низкое содержание естественных цитотоксических клеток (CD16+56+). Снижено количество лимфоцитов, экспрессирующих маркеры: СD11b (рецептор для С3-фрагмента комплемента), СD16 (низкоаффинный рецептор для FcRIII IgG), CD56 (молекула, участвующая в межклеточной адгезии), а также содержание CD95+-лимфоцитов, несущих Fas-антиген – маркер готовности клетки к апоптозу. Таким образом, у беременных с СКВ выявляются диспропорции в содержании клеток разных субпопуляций Т-лимфоцитов и NK-клеток.
При определении количества В2-лимфоцитов (CD19+CD5-) и В1-лимфоцитов (CD19+CD5+) в группе беременных с СКВ статистически значимого различия с контролем не выявлено ни по относительному, ни по абсолютному содержанию клеток в периферической крови (p>0,05).
Выявленные изменения в соотношениях иммунокомпетентных клеток не имеют однозначного объяснения. Они могут зависеть не только от активности СКВ, так как нельзя исключить, что в состояние клеточного звена иммунитета, определяемого сложными иммуноэндокринными взаимодействиями [14, 16], существенный вклад вносит лечение кортикостероидами и цитостатиками. Поэтому расхождения при фенотипической характеристике лимфоцитов крови могут возникать как из-за состояния иммунной системы у беременных с СКВ, так и в результате применения различных схем лечения. Так, неоднозначные результаты получены при определении Т-регуляторных клеток. Нами установлено увеличение относительного содержания этих клеток у беременных с СКВ. Некоторые авторы обнаружили снижение содержания регуляторных Т-клеток у больных СКВ [10–12], другие не выявили снижения [21, 22]. Увеличение доли CD4+CD25-Foxp3+Т-клеток в популяции CD4+-лимфоцитов наблюдалось у больных СКВ с неактивной и, в еще большей степени, с активной формой заболевания, причем определена положительная корреляция между долей CD4+CD25-Foxp3+Т-клеток и активностью заболевания [13]. Авторы пришли к выводу, что увеличенное содержание регуляторных Т-клеток при СКВ свидетельствует о снижении их функциональной активности, то есть о потере способности к индукции периферической толерантности.
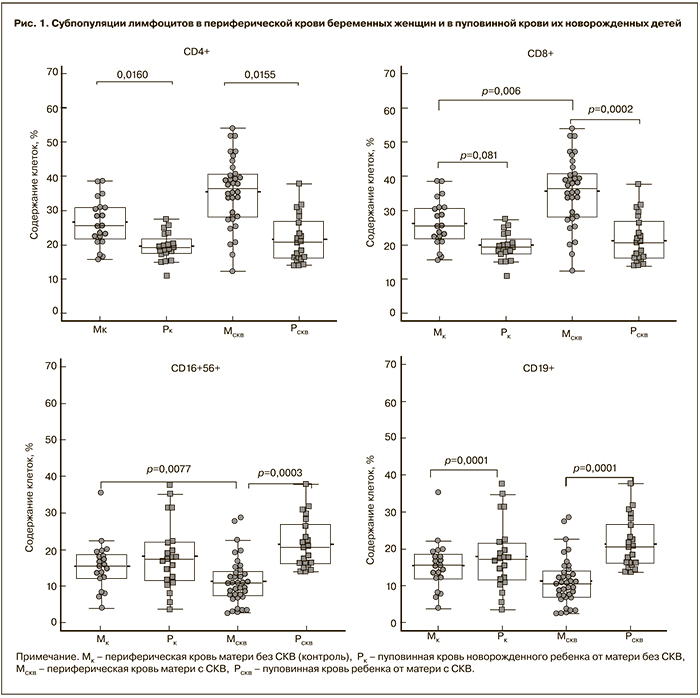
В табл. 2 представлено содержание основных субпопуляций лимфоцитов в пуповинной крови новорожденных детей у матерей с СКВ и у матерей контрольной группы. Не наблюдалось статистически значимых различий между группами новорожденных при оценке как абсолютного, так и относительного содержания лимфоцитов и их субпопуляций в пуповинной крови. Таким образом, несмотря на значимые изменения в содержании лимфоцитов ряда субпопуляций в крови матерей с СКВ, получающих иммуносупрессивную терапию, изменений в пуповинной крови их новорожденных не обнаружено (рис. 1).
Иммунорегуляторные индексы у беременных с СКВ и у женщин контрольной группы значимо отличались (1,2±0,8 и 1,65±0,6 соответственно, р=0,018). В пуповинной крови индексы составляли 2,5±0,7 и 2,36±0,8 соответственно, различия между группами отсутствовали (р=0,58), но были значительно выше, чем у матерей (р=0,0001 и р=0,0002). Кроме того, обращает на себя внимание более высокая вариабельность этого показателя внутри группы матерей с СКВ по сравнению с показателями в контрольной группе и в группах новорожденных (рис. 2), что означает более выраженные индивидуальные различия в этой группе, которые могут зависеть от различий как в форме и активности заболевания, так и в лечебной тактике.
Существенных различий между группой новорожденных, родившихся у матерей с СКВ, получающих иммуносупрессивную терапию, и контрольной группой по содержанию и соотношению лимфоцитов различных субпопуляций в пуповинной крови не было выявлено. К выводу об отсутствии влияния иммуносупрессивной терапии матери на состояние иммунной системы у ребенка пришли авторы, проводившие в течение года сравнительное исследование детей от матерей с аутоиммунными заболеваниями, получавших и не получавших во время беременности лечение иммунодепрессантами [23]. Авторы не наблюдали различий между группами по содержанию лимфоцитов, относительному содержанию B- и T-лимфоцитов, а также по уровню иммуноглобулинов.
В представленной работе обнаружены изменения в содержании и соотношениях иммунокомпетентных клеток у обследованных беременных женщин с СКВ, однако в большинстве случаев изменения не носят ярко выраженных признаков гиперактивации или угнетения иммунной системы. Отсутствие гиперактивации иммунокомпетентных клеток, характерной для СКВ, может объясняться как влиянием состояния беременности, так и воздействием получаемых женщинами во время беременности иммунодепрессантов – глюкокортикостероидов и цитостатиков. Значимых изменений в иммунном статусе новорожденных у матерей с СКВ по сравнению с иммунным статусом новорожденных контрольной группы не было обнаружено, что может свидетельствовать о минимальном воздействии на эмбрион и плод лекарственной терапии, необходимой для подавления активности заболевания и обеспечения успешного протекания беременности.
Выводы
- У беременных женщин с СКВ на фоне иммуносупрессивной терапии наблюдаются признаки дисбаланса в клеточном звене иммунитета, выражающиеся в увеличении содержания активированных Т-лимфоцитов и Т-регуляторных клеток, снижении содержания естественных цитотоксических клеток.
- Рожденные женщинами с СКВ дети отличаются более низкими массо-ростовыми показателями и повышенной частотой осложнений раннего неонатального периода, что нередко требует помещения их в отделение реанимации и интенсивной терапии новорожденных и перевода на второй этап выхаживания. Однако никаких значимых различий между контрольной группой и группой с СКВ по субпопуляционному составу лимфоцитов в пуповинной крови не было обнаружено.
- По-видимому, оказание женщинам с СКВ лечебной помощи, направленной на достижение необходимого периода ремиссии заболевания до зачатия, а также возможность последующей коррекции терапии во время беременности, имеет решающее значение для успешного исхода беременности и не препятствует нормальному становлению и развитию клеточных основ адаптивного иммунитета у плода.



