Этиология самопроизвольного прерывания беременности разнообразна и зависит от многих факторов. Одни из них непосредственно приводят к закладке аномального эмбриона (генетические факторы), другие создают неблагоприятные условия для его нормального развития (иммунологические эндокринные нарушения, инфекционно-воспалительные заболевания, тромбофилии и многие другие). В настоящее время известно более 80 иммунологических биомаркеров, которые могут приводить к прерыванию беременности на всех сроках гестации [1–3].
Исследование аллоиммунитета беременной, первые работы по изучению которого относятся к началу 1980-х гг. [4–8], подтверждает связь привычного выкидыша с индивидуальными особенностями системы HLA I и II класса (Human leukocyte antigen, главный комплекс гистосовместимости), что может приводить к нарушению выработки антител, блокирующих реакцию смешанной культуры лимфоцитов супругов (mixed lymphocyte reaction blocking antibodies, MLR-Bf), антиотцовских цитотоксических антител (anti-paternalcyto-toxicantibodies, APCA) и антиидиотипических антител (антиидиотипы, anti-idiotypic antibodies, Ab2), необходимых для успешной имплантации и развития беременности [9, 10].
Доказано, что у беременных тканевая экспрессия белковых продуктов гена HLA-G – неклассической молекулы HLA I класса – в основном, осуществляется клетками трофобласта. Этим белковым продуктам экспрессии отводится иммуномодулирующий эффект, влияющий на взаимодействия различных клеток иммунной системы (децидуальные натуральные киллеры (dNK), Т-клетки, макрофаги) и регулирующий миграцию клеток во время развития плаценты, что, в конечном счете, определяет исход беременности.
Продукция HLA-G представляется критическим фактором дифференцировки трофобласта и полноценной инвазии. Известно, что напрямую экспрессия HLA-G не связана с защитой эмбриона/плода от атаки материнскими клетками иммунной системы, однако существует влияние на ремоделирование тканей и сосудов. Секретируемые молекулы растворимой формы HLA-G клетками вневорсинчатого трофобласта (EVT) регулируют децидуальную и эндоваскулярную инвазию [11–13]. Их клетки постепенно замещают эндотелий в спиральных артериях матки, увеличивая их диаметр, что обеспечивает надлежащий приток крови к межворсинчатому пространству для питания плода. Этот процесс требует присутствия dNK-клеток – самой многочисленной клеточной популяции на границе раздела матери и плода.
Кроме того, мРНК HLA-G обнаружена во всех клеточных популяциях EVT, включая культуру клеток трофобласта: интерстициальный и эндоваскулярный трофобласт, а также клетки плацентарного ложа. Транскрипты HLA-G были обнаружены в цитотрофобласте и мезенхимальных клетках ворсин хориона. Показано, что синцитиотрофобласт (ST) не экспрессирует HLA-G. Кроме EVT, белковые продукты экспрессии HLA-G были обнаружены в клетках амниона и клетках печени плода. При инвазии трофобласта и на клетках базальной пластинки плаценты тяжелые цепи HLA-G и HLA-C представлены в связи с 2β-микроглобулином. Эти же цепи могут быть обнаружены и в виде отдельных молекул, но не на каждой клетке. Напротив, клетки гладкого хориона экспрессируют исключительно HLA-G антиген, но не HLA-A, B или HLA-C антигены. Это различие в экспрессии классических и неклассических антигенов I класса указывает на наличие тканеспецифической регуляции.
Передача сигналов от эндосом dNK стимулирует толерогенную активность NK-клеток, поддерживая при этом способность к противовирусному иммунитету на границе раздела матери и плода [14]. «Универсальный» рецептор HLA-G, экспрессируемый во всех исследованных NK-клетках, был описан в конце 1990-х: KIR2DL4 [15]. Так, HLA-G может взаимодействовать своими внеклеточными доменами с рецепторами лейкоцитов, включая CD8, LILRB1 и LILRB2, и с иммуноглобулиноподобным рецептором киллерных клеток KIR2DL4 [16]. Было показано, что клетки EVT проявляют значительно большую активность в синтезе и сборке молекул HLA-G, чем все остальные окружающие клетки матери и плода. Однако экспрессия HLA-G молекул на поверхности клеток не коррелирует с этой повышенной активностью. Постоянное смывание молекул HLA-G c поверхности трофобласта играет центральную роль в защите плода от иммунной атаки матери. HLA-G обеспечивает выживание трофобласта в тканях матери, являясь протективной молекулой против цитотоксичности NK-клеток. Защиту клеток-мишеней от цитолиза проявляет только HLA-G антиген, но не классические HLA антигены I класса. Система распознавания беременности включает в себя пептиды, которые специфически активируют ингибиторные рецепторы NK-клеток (KIR) или специфически активируют активаторные рецепторы NK-клеток (KAR), включая цитотоксическую реакцию. На больших гранулярных лимфоцитах матки имеются оба типа рецепторов. Эти рецепторы относятся к суперсемейству иммуноглобулинов. HLA-G антигены распознаются KIR-рецепторами, и таким образом цитотоксическая реакция выключается. Активация KAR может приводить к отторжению трофобласта. Хоть HLA-G и подавляет пролиферацию и цитотоксическую активность Т-клеток, он активирует dNK для секреции цитокинов и пролиферации [14].
Исследований, посвященных экспрессии HLA-G и рецептора KIR2DL4 в ворсинах хориона и в гравидарном эндометрии на ранних сроках гестации в случае неразвивающейся беременности по различным этиологическим причинам, нет.
Целью данного исследования явилось изучение экспрессии HLA-G и KIR2DL4 рецептора в абортивном материале при неразвивающейся беременности (при нормальном кариотипе плода и при полиплоидии) и при нормальной прогрессирующей беременности (при медицинском аборте).
Материалы и методы
Дизайн исследования
Материал был набран на базе ФГБНУ «НИИ АГиР им. Д.О. Отта» и Центра планирования семьи и репродукции. Исследование было одобрено Этическим Комитетом ФГБНУ «НИИ АГиР им. Д.О. Отта». В ходе работы было получено 115 образцов абортивного материала: основная группа при неразвивающейся беременности (n=71) и контрольная группа при медицинском аборте при прогрессирующей беременности (n=44). На основании проведенного цитогенетического исследования (кариотипирование абортивного материала), были определены 3 группы: группа 1 – 36 образцов при неразвивающейся беременности с нормальным кариотипом плода, группа 2 – 35 образцов при неразвивающейся беременности с аномальным кариотипом плода по типу полиплоидии и группа 3 – 44 образца при медицинском аборте при прогрессирующей беременности генетически нормальных эмбрионов. Критериями включения были: абортивный материал от 3 групп женщин, проживающих на территории Северо-Западного региона при одноплодной неразвивающейся беременности или прерванной по желанию женщины (медицинский аборт) на сроке гестации 6–12 недель.
В данной работе применялись: цитогенетическое исследование (кариотипирование абортивного материала) и морфологическое исследование (гистологический и иммуногистохимический, морфометрический методы) для оценки экспрессии HLA-G и KIR2DL4 в ворсинчатом хорионе и гравидарном эндометрии.
Цитогенетическое исследование
Цитогенетическое исследование клеток ворсин хориона проводили по стандартной методике. Было проведено кариотипирование 115 образцов хориона, как при неразвивающейся, так и при прогрессирующей беременности, прерванной по желанию женщины. Операционный материал был представлен фрагментами хориона, доставленными в течение 2–4 часов после операции в физиологическом растворе.
Препараты метафазных хромосом получали из клеток цитотрофобласта ворсинчатого хориона ускоренным «прямым» методом. Окрашивание хромосом проводили с использованием флуорохрома Hoechst 33258 с контрастированием актиномицином D. Препараты анализировали с помощью микроскопа Zeiss Axio Imager.Z2, оснащенного камерой Cool Cube 1, и программного обеспечения MetaSystems Ikaros V 5.9.1 CM.
При кариотипировании руководствовались правилами, рекомендованными для цитогенетических исследований в учреждениях медико-генетической службы.
Гистологическое и иммуногистохимическое исследование
Гистологическое и иммуногистохимическое исследование проводили по стандартной методике. При гистологическом исследовании оценивали гравидарную трансформацию эндометрия, строение ворсин хориона, состояние сосудистого русла и стромы ворсин [17]. Оценку проводили на микроскопе Olympus CX31. Иммуногистохимический метод исследования включал: количественную и качественную оценку экспрессии Anti-HLA-G (clone MEM-G/1, мышиные моноклональные) во вневорсинчатом трофобласте с применением антител производства Abcam (Великобритания) в стандартном разведении 1:200 и Anti-KIR2DL1+KIR2DL3+KIR2DL4+KIR2DS4 (ab197927, кроличьи поликлональные) производства Abcam (Великобритания) в разведении 1:30 в ворсинах хориона.
Цифровая микроскопия и морфометрия
Количественную оценку результатов иммуногистохимической реакции проводили на 1150 микрофотографиях, полученных с помощью системы фиксации микроскопических изображений, состоящей из микроскопа Olympus BX46 и программного обеспечения CellSens 47 Entry. Долю занимаемой экспрессии изучаемого маркера рассчитывали с помощью программы VideoTest-Morphology 5.2 (VideoTest, Россия). В каждом срезе в 5 полях зрения оценивали следующие показатели: оптическую плотность экспрессии (величина вычислялась автоматически) и относительную площадь экспрессии (отношение площади иммунопозитивных клеток к общей площади препарата):

После чего вычислялись средние величины исследуемых показателей.
Статистический анализ
Статистическая обработка результатов проводилась с использованием программы STATISTICA 10 (StatSoft, США). Перед описанием количественных данных была проведена проверка распределения. В данном случае проверку гипотезы о нормальном распределении осуществляли, используя критерий Шапиро–Уилка для выборок с числом наблюдений 50 и менее. Все необходимые условия, которые должны соблюдаться в нормально распределенных совокупностях, для использования параметрических методов (t-критерий Стьюдента) были соблюдены с обоснованием их применимости, к которым относятся нормальное распределение признаков и равенство дисперсий в сравниваемых группах – максимальная близость значений средней арифметической; показатели измерены в количественной шкале, соблюдено правило «трех сигм». Так, все выборки соответствовали критериям нормального распределения. При проведении попарного сравнения групп применялась поправка на множественные сравнения – поправка Бонферрони – перерасчет уровня значимости р для множественных парных сравнений. При использовании поправки Бонферрони традиционный уровень ошибки 1 типа делится на количество сравнений для получения нового критического уровня значимости. Число пар сравнения рассчитывается по формуле:
m=n(n-1)/2, где n – количество групп – 3.
Для данного исследования было определено критическое значение t-критерия Стьюдента для требуемого уровня значимости. Так, при сравнении 3 групп, различия между двумя средними величинами считали статистически значимыми при новом критическом уровне 0,05/3=0,017. Значимость различий относительных показателей, характеризующих частоту самостоятельного наступления беременности, частоту женщин с репродуктивными потерями в анамнезе, количество выскабливаний полости матки в анамнезе и частоту беременных с угрозой прерывания при настоящей беременности оценивали с помощью критерия χ2. Различия считали значимыми при р<0,05.
Результаты и обсуждение
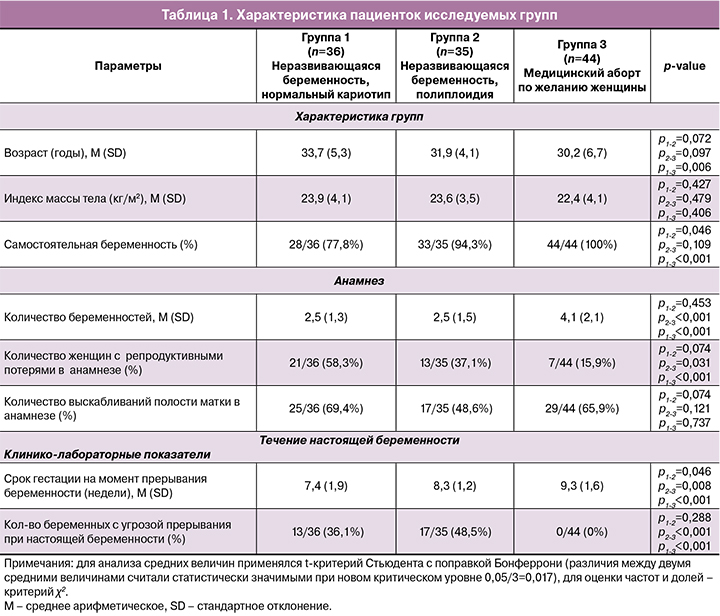
Пациентки трех групп не отличались по возрасту, индексу массы тела, количеству беременностей и сроку беременности на момент ее прерывания. Пациентки из группы 1 в 3,5 раза чаще имели репродуктивные потери в анамнезе, по сравнению с группой контроля (58,3 и 15,9%, р=0,014 соответственно). Отмечено, что у каждой второй женщины из группы 2 наблюдались симптомы угрозы прерывания беременности, что отсутствовало в группе 3 (48,5 и 0%, р=0,012 соответственно) (табл. 1).
Цитогенетическое исследование
Результаты проведенного нами цитогенетического исследования среди 115 образцов ворсинчатого хориона показали, что хромосомная патология трофобласта по типу полиплоидии была выявлена при каждой третьей беременности (35/115 (30,43%)) от общего числа исследуемого материала (n=115). Так, аномальные кариотипы были подразделены на следующие варианты: 18 случаев с кариотипом 69XXY (18/35 (51,43%) от общего количества аномальных кариотипов), 8 случаев с кариотипом 69ХХХ (8/35 (22,86%)), а также по одному случаю 70ХХУ(Х)+13 и 92ХХХУ(Х). В группе 1 с неразвивающейся беременностью при нормальном кариотипе плодов были определены 20 образцов с кариотипом 46XX (20/36(55,56%)) и 16 образцов с кариотипом 46ХY (16/36 (44,44%)); в контрольной группе – 23 хориона с женским кариотипом (23/44 (52,27%)) и 21 хорион с мужским кариотипом (21/44 (47,73%)).
Гистологическое исследование
В группе 1 при гистологическом исследовании 36 случаев неразвивающейся беременности I триместра полноценная гравидарная трансформация компактного и спонгиозного слоев эндометрия выявлена в 23/36 (63,9%) случаях. Неполноценная трансформация спонгиозного слоя присутствовала в 7/36 (19,4%) случаях. Ворсины хориона характеризовались гидропическими изменениями стромы, неравномерной редукцией кровеносного русла и дистрофическими изменениями хориального синцития. Кроме того, в 2 случаях выявлена фибриноидная альтерация ворсин хориона.
В группе 2 полноценная гравидарная трансформация отмечена в 22/35 (62,9%) случаях. Неполноценная трансформация спонгиозного слоя присутствовала в 13/35 (37,1%) случаях. При гистологическом исследовании ворсин хориона отмечается редукция кровеносного русла, от гиповаскуляризации до бессосудистой стромы, их дистрофически и гидропически измененное строение.
В группе контроля полноценная гравидарная трансформация отмечена во всех случаях. Гистологическое строение ворсин хориона соответствовало эмбриогистологическому сроку.
Иммуногистохимическое исследование
В иммуногистохимическом исследовании верифицирована экспрессия HLA-G в клетках EVT и экспрессия KIR2DL4 в строме, железах и поверхностном эпителии эндометрия, как в группах с неразвивающейся беременностью, так и при физиологической беременности.
Для HLA-G характерен мембранный тип локализации экспрессии (рис. 1). Площадь экспрессии HLA-G в обеих группах с неразвивающейся беременностью статистически не различалась. Тогда как при неразвивающейся беременности было показано, что площадь экспрессии HLA-G была значительно ниже по сравнению с группой контроля (в группе 1 с нормальным кариотипом – 37,7 (9,9), в группе 2 – 36,4 (8,4), в группе контроля – 67,09 (5,6), p<0,001). Оптическая плотность не имела статистически значимых изменений (0,09 (0,02), 0,09 (0,02) и 0,08 (0,02), соответственно). При делении на подгруппы в зависимости от кариотипа были получены следующие данные: в группе с неразвивающейся беременностью при нормальном кариотипе плодов мужского пола отмечается тенденция к более низкой экспрессии молекул HLA-G, по сравнению с плодами женского пола (32,96 (10,22) и 41,45 (9,36), p=0,17 соответственно), чего не наблюдалось внутри групп 2 и 3 (табл. 2).

Экспрессия рецептора KIR2DL4 верифицирована в ворсинах хориона (в цитотрофобласте и ST) (рис. 1), а также в структурах эндометрия – как в железах, строме, так и в поверхностном эпителии (рис. 2) независимо от кариотипа. Для рецептора KIR2DL4 характерен клеточный мембранный тип локализации экспрессии (рис. 1). Площадь экспрессии рецептора KIR2DL4 статистически не различалась между тремя группами (29,6 (6,18), 33,1 (3,21) и 27,55 (5,76), p=0,75). Оптическая плотность также не имела статистически значимых изменений (0,09 (0,01), 0,08 (0,02) и 0,09 (0,01) соответственно).

Известно, что полуаллогенный трофобласт образует несколько интерфейсов с материнской иммунной системой в зависимости от срока гестации и анатомического расположения [18]. На ранней стадии имплантации бластоциста окружена трофэктодермой, которая впоследствии преобразуется как в ворсинчатый хорион, состоящий из цитотрофобласта и ST, так и в клетки EVT, лежащие отдельно в виде островков или тяжей, которые обнаруживаются в составе материнской части плаценты, присоединяясь, таким образом, к материнскому кровоснабжению.
Интерфейс I (до 8 недель гестации) – ST имплантируемого эмбриона в децидуальную оболочку плаценты. Это самая ранняя стадия взаимодействия между двумя организмами, и единственный раз, когда ST находится на границе раздела тканей. Ворсинки хориона омываются непосредственно кровью материнского организма, обеспечивающего таким образом гистиотрофное питание [19, 20] до установления межворсинчатого кровообращения через 8 недель.
Во II триместре три новых модели заменяют интерфейс I: Интерфейс II – в промежуток между внедрением EVT и материнскими иммунными клетками в децидуальную оболочку; Интерфейс III – между децидуальной, париетальной и амниотическими оболочками; Интерфейс IV – между ST и материнской кровью. В данном случае ST представляет собой эпителиальный подтип, который окружает ворсинки хориона с большой площадью поверхности, непосредственно контактирующей с материнской кровью.
Стоит отметить, что ST непрерывно выделяет внеклеточные везикулы (extracellular vesicles, EV) в межворсинчатое пространство и, таким образом, в кровоток матери. EV представляют собой связанные с мембраной частицы клеточного происхождения, высвобождаемые как часть нормальных физиологических функций, таких как регуляция гемостаза и поддержание клеток, так и как следствие клеточного стресса (например, при преэклампсии). Термин EV включает экзосомы (диаметром ~ 100 нм), микровезикулы (0,1–1 мкм) и апоптотические тельца (0,5–5 мкм) [21]. EV, происходящие из синцитиотрофобласта (syncytiotrophoblast-derived extracellular vesicles, STEV), высвобождаются в межворсинчатое пространство, где переходят в венозную систему матки, и возвращаются обратно в сердце, проходя легкие матери, через капиллярное русло, таким образом, попадая в большой круг кровообращения. При физиологической беременности STEV постоянно выделяются и, как считается, играют роль в индукции адаптивных изменений у матери, в том числе, в иммунной супрессии, опосредованной клетками матери. Действительно, STEV содержат сложный груз, состоящий из РНК, белков, гликанов и липидов, перемещающихся от апикальной поверхности ST к клеткам-мишеням матери. Их считают биологическими проводниками между материнским и плодовым организмами. Принято, что STEV, выпущенные в материнский кровоток, представляют собой расширение Интерфейса IV.
В первой половине беременности преобладают Интерфейс I и II, и именно здесь на ранней стадии определяется успех при пролонгировании и развитии беременности. Интерфейс II уменьшается через 16 недель, в то время как Интерфейс IV активируется с началом маточно-плацентарного кровообращения на 8–9-й неделе [22] и увеличивается с ростом плаценты, становясь доминирующей моделью через 20 недель [23]. Более того, количество EV, выделяемых ST в кровоток матери, прогрессивно увеличивается с I по III триместр беременности, что способствует преобладанию Интерфейса IV во второй половине гестации.
Строгий контроль экспрессии человеческих лейкоцитарных антигенов (HLA) I и II классов в хорионе и EVT имеет важное значение для благоприятного течения и развития беременности [24]. Известно, что ворсинчатый ST не экспрессирует никаких молекул HLA I или II класса, так что Т-клетки теоретически не способны распознавать основной плацентарный барьер и связываться с ним. Это «сокрытие антигенов», несомненно, является высокоэффективным механизмом защиты плаценты от отторжения материнским иммунитетом.
Напротив, клетки EVT экспрессируют только молекулы HLA I класса, а не класса II; таким образом, они не действуют как антиген-презентирующие клетки и не могут инициировать прямое аллораспознавание материнских CD4+ Т-клеток [25].
Отсутствие экспрессии молекул HLA-A и HLA-B и отсутствие экспрессии HLA II класса на клетках EVT исключает какое-либо воздействие материнскими Т-клетками на отцовские антигены HLA. Кроме того, считается, что HLA-C и атипичные антигены класса I (Ib), такие, как молекулы HLA-G и HLA-E, защищают EVT от разрушения dNK и Т-клетками.
Поскольку клетки EVT проникают в ткани матки во время процесса имплантации, 80% материнских лейкоцитов представлены dNK, 10% – макрофагами, а остальные 10% – Т-клетками. Однако эти пропорции сильно различаются в зависимости от срока беременности. При доношенной беременности Т-клетки являются преобладающей популяцией лимфоцитов в децидуальной ткани матки (40–70% лейкоцитов CD45+), хотя также dNK (20–50%) и децидуальные макрофаги (10–15%) присутствуют в относительно высоких концентрациях [26].
Хорошо известно, что децидуальные клетки обладают способностью активно препятствовать инвазии и развитию аномальных эмбрионов, однако каким образом запускается этот механизм отторжения эмбрионов с генетическими нарушениями, до конца не изучено. В то же время показано, что морфологическая картина при неразвивающейся беременности, как при генетических аномалиях, так и при иммунологических нарушениях, схожа. Этот вопрос касается и тех генетически нормальных эмбрионов, которые оказались в условиях низкой экспрессии молекул HLA-G.
Заключение
Независимо от кариотипа плода при неразвивающейся беременности морфологическая картина имела общность – это гидропические изменения стромы ворсин хориона с неравномерной редукцией кровеносного русла и дистрофическими изменениями хориального синцития. Статистически значимое повышение экспрессии HLA-G в ворсинах хориона в группе контроля с прогрессирующей беременностью генетически нормальных эмбрионов, по сравнению с основными группами с неразвивающейся беременностью, вероятно, связано с адекватной реакцией в иммунной системе матери на полуаллогенный плод.
Результаты нашей работы показали, что снижение экспрессии HLA-G является одним из иммунологических факторов, детерминирующих ранние репродуктивные потери.



