Согласно данным литературы, имеется взаимосвязь состояния вагинальной микробиоты и осложнений беременности [1–3]. Микрофлора влагалища характеризуется разнообразием видового состава и разделяется на облигатную и транзиторную. Колонизационная резистентность вагинального биотопа обеспечивается лактобациллами – резидентной составляющей вагинальной микрофлоры. Транзиторный компонент микрофлоры представлен условно-патогенными микроорганизмами (УПМ), которые в силу конкурентного сдерживания колонизируют влагалище в низких титрах. Под влиянием эндогенных и экзогенных воздействий на организм женщины может происходить нарушение состояния гармоничного равновесия между лактобациллами и УПМ, что приводит к дисбалансу микрофлоры и развитию инфекционного процесса [4, 5]. В литературе сообщается о роли дисбиотических нарушений микробиоценоза влагалища в развитии инфекционных осложнений беременности, родов и послеродового периода [6], их возможной связи с определенными видами лактобацилл и нестабильностью вагинальной микробиоты. Имеются сообщения о том, что состав влагалищной микрофлоры изменяется в зависимости от гестационного срока, а доминирующими в норме являются лактобациллы четырех видов: L. crispatus, L. jensenii, L. gasseri и L. iners [7].
Цель настоящего исследования: изучить особенности микробиоты влагалища и ее стабильность у женщин в процессе динамического наблюдения в течение беременности.
Материалы и методы
Обследованы 26 женщин в возрасте от 18 до 40 лет на протяжении беременности (в I–III триместрах). Критерии включения: первобеременные женщины в возрасте от 18 до 40 лет с одноплодной беременностью. Критерии исключения: врожденные пороки развития у плода, отягощенная соматическая патология у беременных.
Комплексное микробиологическое исследование включало оценку микробиоценоза влагалища по данным микроскопии мазка вагинального отделяемого, окрашенного по Граму, и культурального исследования в соответствии с медицинской технологией «Интегральная оценка состояния микробиоты влагалища. Диагностика оппортунистических вагинитов». Вагинальное отделяемое засевали на стандартные питательные среды. Для выделения факультативно-анаэробных микроорганизмов использовали: колумбийский агар, маннит-солевой агар (Сonda, Испания), среду Эндо и агар Сабуро (ФГУН «ГИЦПМ и Б», Оболенск, Россия). Лактобациллы культивировали на среде лактобакагар (ФГУН «ГИЦПМ и Б», Оболенск, Россия), строгие анаэробы – на прередуцированном агаре Schaedler (Сonda, Испания) с необходимыми добавками. Инкубировали посевы в условиях СО2-инкубатора (Jouan, Франция). Строгие анаэробы и лактобациллы культивировали в анаэробном боксе (Jouan, Франция) в атмосфере трехкомпонентной газовой смеси (N2 – 80%; CO2 – 10%; Н2 – 10%). Видовую идентификацию микроорганизмов проводили методом MALDI TOF MS с использованием времяпролетного масс-спектрометра AutoFlex III c программным обеспечением MaldiBioTyper (BrukerDaltoniks, Германия), который ранее помог идентифицировать 101 выделенный штамм лактобацилл до вида, из которых 76,3% культур были определены в высоком титре (lg score – 1,9–>2) и 23,7% в низком(lg score <1,9).
Статистический анализ. При статистической обработке полученных результатов для оценки значимости различий по частоте встречаемости состояний микробиоты (нормоценоза и нарушения микроценоза) между триместрами использовали метод χ2. Анализ динамики видовой представленности микробиоты проводился с учетом частоты изменения состава по триместрам. Оценивалась доля видов, не меняющихся по представленности от триместра к триместру, для каждой пациентки. Для изучения зависимости количества видов, по-разному изменяющих свою степень обсемененности, от перехода между триместрами проводился расчет точного критерия Фишера для каждой пациентки: проводилось сравнение частоты повышения концентрации видов и понижения (повышение или понижение: бинарный признак) при переходе между триместрами I–II (1-я группа) и между триместрами II–III (2-я группа). Такой расчет проводился для каждой беременной, участвовавшей в исследовании, то есть 26 раз.
Для всех видов анализа статистически значимыми считали значения р<0,05. Статистическая обработка проведена с применением пакета прикладных программ Statistica 7.0 и дополнительных программных разработок на языке Python 2.7 и его библиотек: Sklearn, Skipy, Pandas, Matplotlib.
Для описания данных в статье использовали следующие форматы:
- качественные показатели, представленные в абсолютных (n) и (%) относительных величинах в формате описательной статистики n (%):
- частота выявления различных состояний микробиоты у беременных в процессе динамического наблюдения по триместрам;
- частота выявления вагинальных микробных сообществ с разной степенью обсемененности по триместрам;
- частота выявления беременных с относительно стабильным или вариабельным видовым составом микробиоты между триместрами;
- количественные показатели, имеющие отличное от нормального распределение, описанные в виде медианы (Me) и квартилей Q1и Q3 в формате Me (Q1;Q3):
- количество видов с неизменной степенью обсемененности между триместрами; распределение по пациенткам.
Результаты
По результатам комплексного микробиологического исследования проведена оценка состояния микробиоценоза влагалища у обследованных женщин в процессе динамического наблюдения (табл. 1), а также произведен расчет статистической значимости частоты встречаемости основных состояний микробиоты по триместрам методом χ2 (табл. 2).
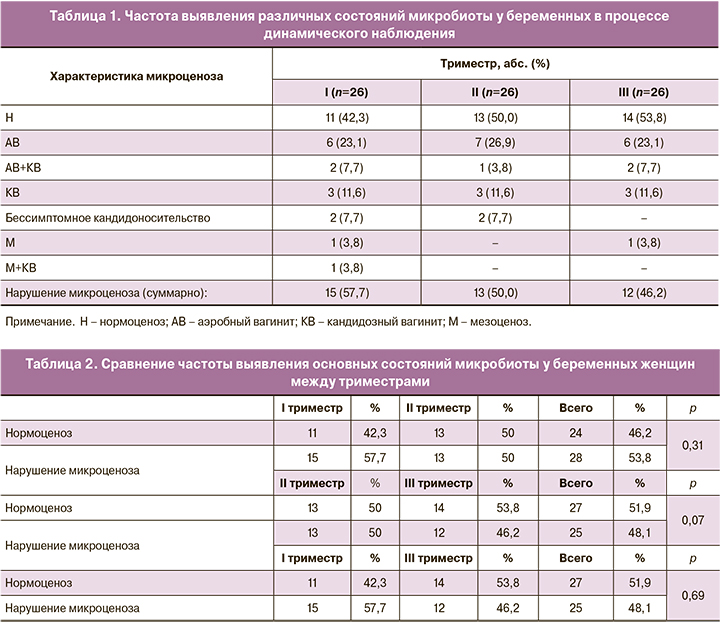
Результаты применения критерия χ2 показали, что в частотах встречаемости нормоценоза (Н) и нарушений микроценоза (суммарно) в I–III триместрах статистически значимые отличия не были обнаружены (при сравнении I и II триместров, р=0,31; II и III триместров, р=0,07; I и III триместра, p=0,69). Однако наиболее частые состояния и тенденции были выявлены. Из таблицы 1 следует, что наиболее часто встречающимся состоянием микробиоты был Н, выявление которого в I–III триместрах беременности составило 42,3; 50,0 и 53,8% случаев соответственно. Нарушение вагинальной микроэкологии отмечено соответственно в 57,7%; 50,0% и 46,2% случаях. Установлено, что по мере увеличения срока гестации наблюдалась тенденция к сокращению случаев отклонения от нормы с 57,7 до 46,2%, что, по-видимому, является благоприятным прогностическим фактором успешного пролонгирования беременности. Вторым по частоте встречаемости вариантом микроценоза был аэробный (неспецифический) вагинит (АВ). В динамике этот показатель был практически неизменным (по 30,8% случаев в каждом триместре) и отмечался как моноинфекция (23,1; 26,9 и 23,1% беременных соответственно) либо в сочетании с кандидозным вульвовагинитом (КВ) (7,7; 3,8 и 7,7% соответственно). Дрожжевые грибы рода Candida наиболее часто выделяли у пациенток в I триместре (30,8%) и несколько реже — во II и III триместрах (23,1 и 23,1% соответственно). Известно, что грибы рода Candida способны вегетировать во влагалище в ассоциации со многими видами УПМ на фоне кислого и щелочного значений рН. В нашем наблюдении их выявляли при классическом варианте КВ, при сочетании КВ с АВ, мезоценозом (М), а также при бессимптомном кандидоносительстве. Нами не было зарегистрировано ни одного случая бактериального вагиноза (БВ). В трех случаях выявлен М (состояние промежуточное между Н и БВ): в двух случаях – в I триместре (7,7%) и в одном – в III триместре (3,8%).
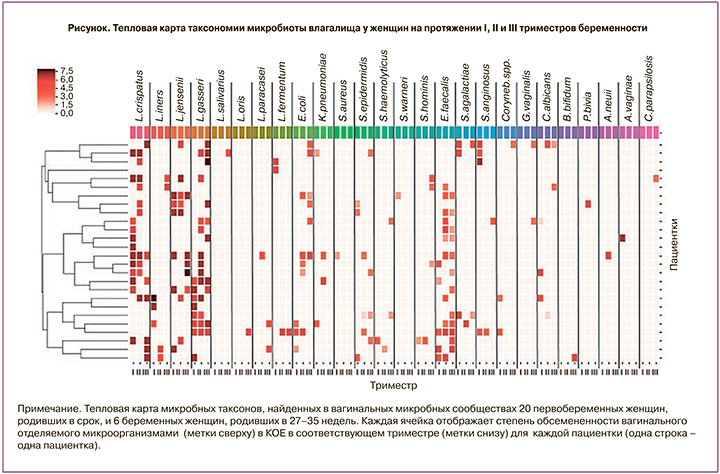
На рисунке представлен видовой состав вагинальной микробиоты пациенток в динамике по триместрам.
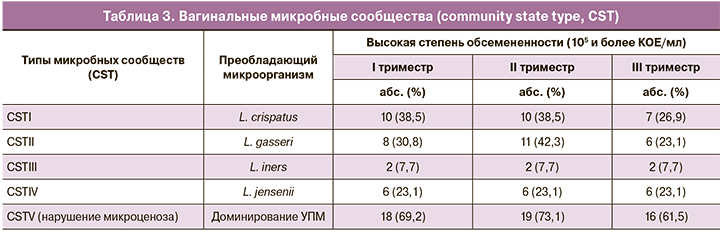
Как видно из таблицы 3, условно выделены 5 преобладающих типов CST (степень обсемененности лактобацилл – 105 и более КОЕ/мл). В 4 из них соответственно преобладали следующие лактобациллы: CSTI – L. crispatus; CSTII – L. gasseri; CSTIII – L. iners; CSTIV – L. jensenii; тогда как для CSTV характерно доминирование разнообразных УПМ.
Видовой спектр лактобацилл был представлен 11 видами. Лидирующими были 4 вида: L. crispatus (26,9–38,5%), L. gasseri (23,1–42,3%), L. jensenii (23,1%) и L. iners (7,7%). Доля прочих видов (L. fermentum, L. salivarius, L. galinarum, L. oris, L. delbrueckii, L. paracasei, L. rhamnosus) составила от 1,0 до 3,8%.
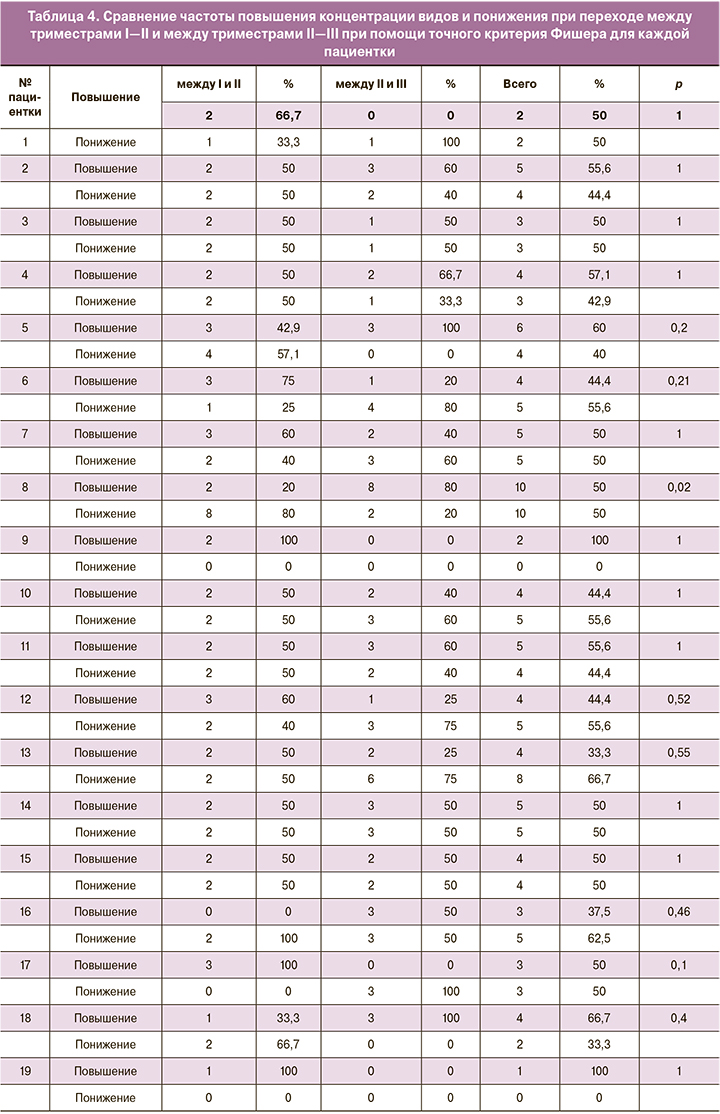
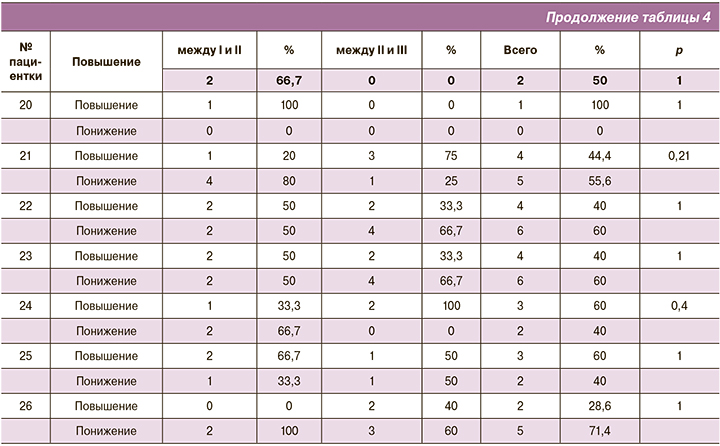
Изменение общей видовой представленности между I–II и II–III триместрами оценивалось по количеству видов, у которых степень обсемененности повысилась, понизилась и осталась неизменной. Всего была исследована представленность 26 видов микроорганизмов. Между I и II триместрами у пациенток не изменялась степень обсемененности по 22 (22; 23) видам; между II и III триместром – 22 (21; 23, 75). Эти данные свидетельствуют о стабильности видового состава микроорганизмов в течение беременности. Анализ зависимости частоты видов, по-разному изменяющих свою степень обсемененности, от перехода между триместрами I–II или II–III был выполнен при помощи точного критерия Фишера, который показал высокий уровень значимости (p=0,02) только в одном случае (3,8%) из 26 пациенток (полные результаты применения критерия Фишера см. в табл. 4). Таким образом, у подавляющего большинства беременных (25 (96,2%)) видовой состав микроорганизмов оставался относительно постоянным даже с учетом локальных вариаций в характере изменения видовой представленности между триместрами, и только для 1 (3,8%) беременной он претерпел значительные изменения в течение всей беременности.
У беременных с преждевременным разрывом плодных оболочек (ПРПО) в 27–35 недель беременности наблюдались дисбиотические нарушения. При посеве отделяемого из цервикального канала после излития околоплодных вод УПМ выделены у 5 женщин. Из них в одном случае был выделен Enterococcus faecalis в монокультуре, а у других обнаружены ассоциации: E. coli + E. faecalis, S. hominis+ C. albicans, E. coli + S. lugdunensis + S anginosus + G. vaginalis и S. epidermidis + S. agalactiae+ E. faecalis + S. lugdunensis соответственно каждому случаю. У одной пациентки УПМ не обнаружены. У 4 из 6 женщин также выделены лактобациллы: в 3 случаях – L. gasseri и в 1 – L. iners. У 2 женщин без роста лактобацилл в предыдущем посеве также выявлен вид L. gasseri. Обращает на себя внимание, что у 5 пациенток из 6 в течение наблюдения отмечен хотя бы один эпизод АВ. Полученные результаты могут служить основой для изучения взаимосвязи между вагинальной микробиотой и неблагоприятным исходом беременности.
Обсуждение
Проведенное динамическое исследование вагинальной микробиоты показало отсутствие статистически значимой разницы в частоте Н и микроэкологических нарушений (суммарно) во все периоды наблюдения. В то же время наметилась тенденция возрастания случаев Н к концу гестационного периода с 42,3% в I триместре до 53,8% в III триместре. Среди нарушений микробиоты во всех триместрах наиболее часто отмечали АВ (у каждой третьей женщины в каждом триместре). При Н в динамике из этиологически значимых УПМ выделяли Enterococcus faecalis (18,2–42,9%) и Escherichia coli (18,2– 21,4%), всегда в низких титрах. При АВ наиболее часто высевали Enterococcus faecalis, с выраженной тенденцией к возрастанию от I к III триместру от 16,7 до 87,5%, Escherichia coli (25,0–37,5%) и стрептококки 3 видов: S. anginosus, S. agalactiae и S. oralis (в III триместре обнаружен только S. agalactiae – 25,0%). УПМ при АВ чаще высевали в умеренных или высоких титрах. Обращает на себя внимание высокая степень присутствия указанных УПМ как при Н, так и при АВ. Полученные нами данные о частоте выявления УПМ факультативно-анаэробного происхождения согласуются с результатами других исследований [8]. Дрожжевые грибы рода Candida наиболее часто выделяли у пациенток в I триместре (30,8%) и несколько реже во II и III триместрах (23,1% и 23,1% соответственно) при различных вариантах микробиоценоза. Что касается БВ и М, ассоциированных со строгими анаэробами и Gardnerella vaginalis, то в нашем исследовании эти варианты микробиоценоза встречались редко. В исследовании R. Romero и соавт. [9] было показано, что обилие видов, ассоциированных с БВ, редко наблюдается у женщин, родивших в срок. При патологическом течении беременности частота таких нарушений встречается чаще [10].
Анализ исходов беременности показал, что у 20 (76,9%) женщин беременность завершилась рождением живых здоровых новорожденных, у 6 (23,1%) имели место преждевременное излитие околоплодных вод в 27–35 недель беременности и рождение недоношенных детей. У беременных с ПРПО наблюдались выраженные дисбиотические изменения в составе вагинальной микробиоты. Видовой спектр УПМ, выделенных у пациенток с ПРПО, ассоциируется с наиболее часто встречающимися видами УПМ, колонизирующими вагинальный биотоп на протяжении беременности, как при Н, так и при патологическом состоянии микробиоты, особенно при АВ (E. faecalis, E. coli). ПРПО – это состояние, при котором происходит разрыв амниотического мешка до 37 недель беременности. Одна из причин ПРПО – выработка бактериальных ферментов, вызывающих деградацию коллагена, основного компонента внеклеточного матрикса плодных оболочек. B. Hammond и соавт. [11] показали, что вагинальные УПМ могут оказывать влияние на состояние плодных мембран. Нарушение состояния нормобиоты является фактором повышенного риска для ПРПО. Для более глубокого понимания роли бактерий в патогенезе ПРПО авторы исследовали способность G. vaginalis и других БВ-ассоциированных микроорганизмов прямо или косвенно влиять на целостность мембран плода путем сокультивирования G. vaginalis в анаэробных условиях с ED27 клетками млекопитающих (линия клеток – производных трофобласта). Результаты показали, что G. vaginalis не продуцирует бактериальные коллагеназы, которые непосредственно разрушают плодные оболочки, однако может нарушать целостность тканей, выделяя вещества, вызывающие изменение экспрессии металлопротеиназ в тканях мембраны плода. Контакт патогена с плодными оболочками чаще всего реализуется посредством восходящего инфицирования. Известно, что одним из механизмов, обеспечивающих проникновение УПМ, в том числе БВ-ассоциированных, в верхние отделы гениталий, является их способность разрушать защитные барьеры. Репродуктивный тракт женщин богат гликопротеинами – белками, содержащими сиаловые кислоты, обеспечивающие высокую вязкость секретов слизистых оболочек полового тракта, защищающих слизистые оболочки от механических повреждений и бактериального воздействия. Установлено, что многие БВ-ассоциированные микроорганизмы и другие УПМ, в том числе и кишечная палочка, способны вырабатывать ферменты (сиалидаза, муциназа), разрушающие гликопротеины защитного слизистого слоя. Разрушение муцина – необходимый этап в колонизации вагинально-шеечного эпителия и проникновения вагинальных УПМ в матку [12]. Кроме того, есть доказательства, что разрушение вагинальных муцинов приводит к снижению продукции специфического иммуноглобулина А [13], что также увеличивает риск восходящей инфекции у беременных. S. Cauci и соавт. [14] установили, что повышенный уровень сиалидазы в вагинальном отделяемом на 12-й неделе беременности коррелировал с ранними спонтанными преждевременными родами и поздними выкидышами. Полученные нами данные по видовому составу УПМ при ПРПО согласуются с исследованиями других авторов. В обзоре Li-nan Zeng и соавт. [15], посвященном анализу высеваемости УПМ у женщин с ПРПО за 32-летний период в клиниках Китая, показан видовой спектр выделенных 1706 изолятов УПМ: Staphylococcus spp., Enterococcus spp., Streptococcus spp., Escherichia coli, Enterobacter spp., Gardnerella vaginalis, строгие анаэробы, грибы рода Candida. Наиболее часто высевали Staphylococcus spp. и Escherichia coli.
В литературе дискутируется вопрос о роли видового состава лактобацилл у здоровых женщин и при инфекционной патологии влагалища. Известно, что лактобациллы составляют резидентную часть микрофлоры урогенитального тракта женщин репродуктивного возраста. Колонизируя пристеночную зону слизистой влагалища, они формируют микробно-тканевые комплексы, включающие микроколонии лактобацилл и их метаболиты, эпителиальные клетки, слизь (муцин), клетки стромы (фибробласты), лейкоциты, лимфоциты, нейроэндокринные клетки [16]. Полученные нами данные показали, что видовой спектр лактобацилл был представлен 11 видами. Лидирующими были 4 вида: L. crispatus (26,9–38,5%), L. gasseri (23,1–42,3%), L. jensenii (23,1%) и L. iners (7,7%) как по частоте выделения, так и по степени обсемененности ими вагинального отделяемого (105 и более КОЕ/мл).
Доля прочих видов (L. fermentum, L. salivarius, L. galinarum, L. oris, L. delbrueckii, L. paracasei, L. rhamnosus) составила от 1,0 до 3,8%. При Н в течение всей беременности (в I–III триместрах) доминировали три вида: L. crispatus (54,5; 46,2 и 28,6% соответственно), L. jensenii (45,4; 30,8 и 35,7% соответственно) и L. gasseri (18,2; 46,2 и 42,9% соответственно). Отмечено некоторое снижение к концу беременности частоты выделения L crispatus до 28,6% и увеличение – L. gasseri с 18,2 до 42,9%. Доминирующим среди лактобацилл видом при АВ, в отличие от Н, был вид L. gasseri, который выделяли с частотой 50% в I триместре и 37,5% – во II и III. Частота выделения преобладавших при Н L. crispatus и L. jensenii у пациенток с АВ существенно сократилась, составив 25,0–12,5% в I–III триместрах для L. crispatus, и ограничилась 25,0% (только во II триместре) для L. jensenii. Исследование изменения видового состава вагинальной микробиоты у всех 26 женщин показало, что у подавляющего большинства беременных – 25 (96,2%) видовой состав оставался относительно постоянным, и только для одной беременной (3,8%) он претерпевал значительные изменения в течение всей беременности. Аналогичные данные получены R. Romero и соавт. [10]. Наиболее продуктивными видами в обеспечении стабильности нормофлоры были L. crispatus и L. jensenii, и, напротив, дисбиотические нарушения (АВ, М) имели место при колонизации влагалища видом L. gasseri. Следует заметить, что все случаи ПРПО ассоциировались с присутствием, помимо УПМ, лактобацилл вида L. gasseri. В исследованиях А.Р. Мелкумян и соавт. [17], Н. Меджидовой [18] показана доминирующая роль L. crispatus у здоровых женщин. H. Verstraelen и соавт. [19] отметили, что максимальная стабильность вагинальной экосистемы определяется видом L. crispatus, а минимальная – L. gasseri и L. iners. Они показали, что риск дисбиотических нарушений десятикратно возрастает в случае заселения влагалища лактобациллами видов L. gasseri/L. iners. Уникальные данные, полученные J.P. Ghartey и соавт. [20], свидетельствуют о том, что максимальное сдерживание пролиферации Escherichia coli у беременных наблюдается в случае колонизации влагалища L. crispatus. Кроме того, авторы продемонстрировали ингибирующий эффект супернатанта L. crispatus на рост Escherichia coli in vitro. Два случая ПРПО в нашем исследовании были вызваны ассоциациями УПМ, в состав которых входила Escherichia coli в высоком титре. В обоих случаях в составе ассоциаций присутствовал вид L. gasseri. Более того, все шесть случаев ПРПО ассоциировались с видами L. gasseri/L. iners. L. Petricevic и соавт. [21] проанализировали частоту выделения L. iners у пациенток с преждевременными родами и у пациенток, родивших в срок, и установили, что этот вид лактобацилл обнаружен в 85% случаев преждевременных родов и только у 16% беременных с благоприятным исходом беременности.
Заключение
Таким образом, данное исследование позволило получить новые сведения о составе микробиоты влагалища у беременных и оценить состав микробного сообщества, которое может повлиять на исход беременности. Своевременная коррекция микроэкологических нарушений вагинального биотопа позволит предотвратить развитие инфекционных осложнений во время беременности и в послеродовом периоде. Оценка влагалищной микробиоты при беременности может иметь прогностическую, диагностическую и терапевтическую ценность.



